Статья опубликована в рамках: I Международной научно-практической конференции «Естественные и математические науки в современном мире» (Россия, г. Новосибирск, 24 декабря 2012 г.)
Наука: Химия
Секция: Органическая химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
ПРИМЕНЕНИЕ LR В КАЧЕСТВЕ РЕАГЕНТА ДЛЯ ТИОНИРОВАНИЕ ГЛИКОЛИЗИЛМЕТИЛМОЧЕВИН
Эрназарова Бактыгул Кочкорбаевна
канд. хим. наук, доцент, зав. кафедрой ЖАГУ,
г. Жалал-Абад
e-mail: nauca_07@ mail.ru
Бакирова Аида Адилбековна
науч. сотр., ИХ и ХТ НАН КР.
г. Бишкек
" target="_blank">
Джаманбаев Женис Анаркулович
д-р. хим. наук, профессор, гл. науч. сотр., ИХ и ХТ НАН КР
г. Бишкек
Производные тиомочевины применяются в различных областях экономики использовании их в качестве лекарственных препаратов, стимуляторов роста растений, зооцидов, родентицидов, для получения полимерных материалов и гетероциклических соединений, что определяет перспективность развития новых путей синтеза производных тиомочевин.
До настоящего времени, единственным доступным способом синтеза углеводных производных тиомочевин является изотиоцианатный метод разработанный в 1914 г. Э. Фишером [2] по схеме 1.
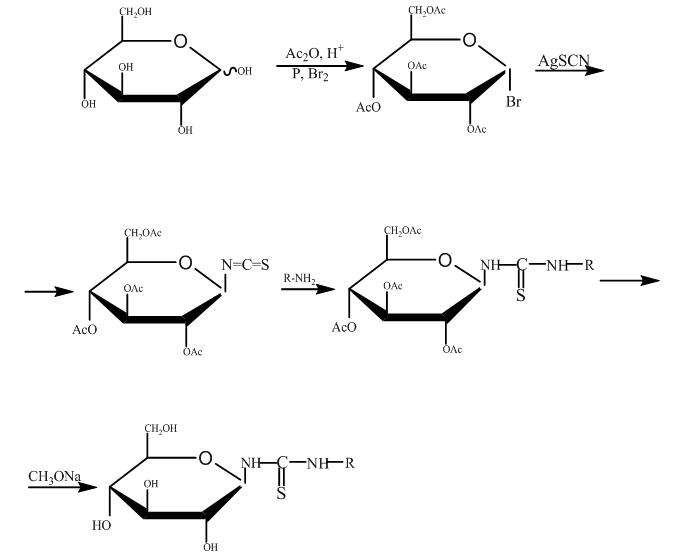
Схема 1.
Синтез гликозилтиомочевин, как правило, осуществляется по классическому методу представленному схемам 1, которая на наш взгляд имеет ряд существенных недостатков, а именно многостадийность, дорогостоящих реагентов (соли серебра), агрессивных веществ, использование дорогостоящего катализатора (двуокиси платины), ядовитых реагентов (азида натрия, брома), дефицитного производного изотиоцианата, проведение реакции при высоком давлении, в течение длительного времени.
Учеными Кыргызстана [1] был разработан способ получения гликозилметилмочевин в условиях нуклеофильного катализа (схема 2).
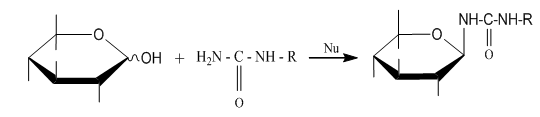
Схема 2.
Попытки применить данную реакцию к углеводным производным тиомочевин не увенчались успехом. По видимому, это связано с более высокой нуклеофильностью атома серы по сравнению с атомом азота.
В связи с этим нам представлялось интерес использовать реагент Lawesson's для превращения гликозилметилмочевин в гликозилметил-тиомочевины в одну стадию.
Углеводные производные тиомочевины с применением реагента Lawesson's являются неизученными объектами. В связи с этим актуальным является изучение реакции тионирования углеводных производных мочевин с использованием реагента Lawesson (LR) с целью получения новых углеводных производных тиомочевин и расширит область их использования в медицине и народном хозяйстве.
Цель настоящей работы — разработка новый, простой и упрощенный метод синтеза гликозилметилтиомочевин с применением реагента Lawesson's на основе который, можно синтезировать ценные серосодержащие физиологически активных соединений с углеводными фрагментами.
Нами разработана новый метод получение гликозилметилтиомочевин. Предлагаемый способ относится к химии углеводов и может быть использовано для получения производных гликозилтиомочевин. Задача предлагаемого способа — упрощение и ускорение и исключение из технологического процесса высокого давления, дорогостоящей реактивы.
Сущность нового способа заключается во взаимодействии гликозилметилмочевин с 2,4-бис-(п-метоксифенил)-1,3,2,4-дитиадифосфетан-2,4-дисульфидом (LR) при соотношении 1:1 в среде пиридина, в присутствии углекислого газа (схема 3).

Схема 3.
где . R=H; R1= H; R2=OH;
R=CH2 OH; R1=OH; R2=H;
R=CH2 OH; R1=H; R2=OH
Синтезированные соединения по новому способу представляют собой кристаллические вещества, характеризующиеся химической стабильностью. Они хранятся без разложения при комнатной температуре, устойчивы в условиях ТСХ. Физико-химические характеристики продуктов приведены в табл. 1
Индивидуальность и строение целевых продуктов подтверждено методами спектроскопии ЯМР 13С, 1Н, ИК-спектроскопии, а также элементным анализом. В спектрах ЯМР 13С, 1Н синтезированных соединений наблюдается сигналы всех соответствующих ядер, входящих в состав полученных веществ.
В ИК-спектрах в частности N-метил-N1-(b-D-глюкопиранозил) тиомочевины фиксируется широкая полоса в области 3550—3000 см-1 характерная для валентных колебаний групп ОН и NН. Полосы поглощения в области 1024, 1108 см-1 относятся к валентным колебаниям углеводного кольца. Наличие сигнала при 926 см-1 свидетельствует β-положения пиранозного кольца. Колебания в области 1256—1461 см-1 можно отнести к валентным колебаниям группы (C=S). В области 2940 см-1 относится колебаниям группы (CH3) (табл. 2).
Таблица 1.
Физико-химические характеристики N- метил- N1-(b-D-гликопиранозил) тиомочевины
|
|
|
|
|
|
|
|||
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
*система — ацетонитрил : этанол (3:2)).
Таблица 2.
Характеристические полосы поглощения в ИК-спектрах N- метил- N1-(b-D-гликопиранозил) тиомочевины
|
№ |
Синтезированные соединения |
Колебание углеводного фрагмента, v, см-1 |
Колебание агликона, v, см-1 |
||||
|
-С-О- |
ОН |
β-форм |
N-H |
С=S |
СН3 |
||
|
1 |
|
1029 1145 |
3000 3500 |
955 |
3288 |
1257 1453 1508 |
3047 |
|
2 |
|
1024 1108 |
3000 3550 |
926 |
3403 |
1256 1461 1500 |
2837 2940 |
|
3 |
|
1030 1074 1144 |
3000 3300 |
949 |
3288 |
1257 1453 1508 |
2837 2959 |
Важную структурную информацию несут спектры ЯМР на ядрах 1Н. По данным спектра ПМР, структуры полученных продуктов представляют собой соединения, образованные из гликозиламидной связи, с b-расположением глюкозилметилтиомочевины. Cлабопольная часть ПМР спектра содержит сигналы, которые проявляются в виде мультиплета с центром при 3,6 м.д—3,8 м.д., соответственно принадлежащие пятому аксиальному и пятому экваториальному атому водорода углеводного кольца. Экваториальный атом водорода при С-2 проявляется в виде дублета с химическим сдвигом при 3,8 м.д. Сигнал в виде уширенного синглета принадлежащий к протоном метильной группы СН3 наблюдается в области 2,7 м.д. В области 4,6 м.д—4.85 м.д. относится к углеводным кольцам ( табл. 3).
Таблица 3.
Химические сдвиги протонов N- метил- N1-(b-D-гликопиранозил) тиомочевины
|
№ |
Синтезированные соединения |
Химический сдвиг δ=м.д. |
|||
|
Углеводная часть |
Агликоновая часть |
||||
|
СН |
ОН |
NH |
СН3 (3Н) |
||
|
1 |
|
4,7 уш.с. 3,2—3,7 м. |
4,5—4,8 уш.с. (3 ОН) |
5,4 с (1Н) |
2,7 уш.с. (3Н) |
|
2 |
|
3,5триплет 3,6—3,8 м. |
4,6—4,8 уш.с (4 ОН) |
5,4 с (1Н) |
2,7 уш.с (3Н) |
|
3 |
|
3,2—3,9 м. |
4,6—4,7 уш.с (4 ОН) |
5,4 с (1Н) |
2,7 уш.с (3Н) |
В спектрах ЯМР 13С N-метил-N1-(b-D-глюкопиранозил) тиомочевины аномерных атомов углерода обнаруживается в области d 76—81 м.д., что также свидетельствует в пользу β-конфигурации гликозидной связи. Сигналы в области d 60.69 м.д. и d 69.42 говорят о том, что глюкозидный остаток в обсуждаемых соединениях находится в пиранозной форме. Сигналы в области d 26,28 м.д. относится метильной группы.
Совокупность спектральных характеристик синтезированных соединений не оставляет сомнений в том, что все полученные вещества представляют собой индивидуальные соединения.
Таким образом, проведены экспериментальные исследования, которые подтверждают, что при взаимодействии N- метил- N1-(b-D-гликопиранозил) мочевина с реагентом Lawesson (LR) при соотношении 1:1 в среде пиридина, в присутствии углекислого газа происходит образование N- метил- N1-(b-D-гликопиранозил) тиомочевина, который преимуществом данного способа является упрощение, ускорение процесса и исключение из технологического процесса высокого давления, дорогостоящей двуокиси платины, ядовитых азида натрия и брома.
Экспериментальная часть
Идентификация новых соединений осуществлялась методами ТСХ на Silufol, ИК -, Н1 ЯМР-спектроскопия и элементным анализом. Спектры Н1 ЯМР получены на приборе «Tesla BS 567» с рабочей частотой по Н 100 МГц, в качестве внутреннего стандарта использовались ГМДС. Спектры сняты в дейтерированных растворителях — ДМСО- d6 и Ру - d5.
ИК- спектры получены на спектрометре ИКС — 29 при 400—4200 см" (KBг в таблетках). Температуру плавления полученных соединений измеряли на микронагревательном столике Boetuis. Скорость подъема температуры на столике составляла 4°С в минуту.
Контроль за ходом реакции и чистотой синтезированных соединений осуществлялся с помощью ТСХ на пластинках «Silufol UV-254» (сорбент: силикагель), бумажной хроматографии с использованием бумаги марки FN-5 и FN-2, при использовании следующих систем: для тонкослойной хроматографии система — ацетонитрил: этанол (3:2), для бумажной хроматографии бутанол-уксусная кислота-вода (4:1:5). Удельное вращение определяли на сахариметре марки СУ-2 в стеклянной кювете.
Методика работы
Синтез 2,4-бис (п-метоксифенил)-1,3-дитиадифосфетан-2,4-дисульфид (LR)
В колбу снабженную обратным холодильником, хлоркальциевой трубкой помещают 3,661 г (0,114 моль) серы и 1,4 г (0,045 моль) красного фосфора и кипятят. Реакционную массу охлаждают, добавляют 12 мл (0,11 моль) анизола и кипятят. После охлаждения до комнатной температуры выпавшие кристаллы отфильтровывают и промывают абс. эфиром и бензолом. Перекристаллизовывают из абс. толуола.
Выход: 4,36 г., (47,8 %), Тпл=228—2290С.
ИК-спектр (КВr, v, см-1): 689 (Р=S), 615 (Р=С), 1022, 1095, 1180 (R-О-СН3), 1267, 1294, 1308, 1458, 1493, 1592 (аром.).
С14Н14О2Р2S4 404,475 Найдены %: С-41,95; Н-3,78; Р-15,1; S-32,0.
Вычислено %: С-41,57; Н-3,49; Р-15,32; S-31,71.
Синтез N-метил-N1-(b-D-ксилопиранозил)тиомочевины. В колбу помещают 0,05 г (0,2ммоль) N-метил-N1-(b-D-ксилопиранозил) мочевины, 0,1 г (0,24ммоль) 2,4-бис (п-метоксифенил)-1,3-дитиадифосфетан-2,4-дисульфида (LR) и 3 мл абс. пиридина. Колбу наполняют сухим углекислым газом и кипятят с обратным холодильником и хлоркальциевой трубкой в течение 45 мин. Раствор упаривают под вакуумом при температуре бани 50—600С досуха. К остатку добавляют 3 мл дист. воды и кипятят с обратным холодильником в течение пяти минут. Раствор отфильтровывают и фильтрат упаривают. Остаток перекристаллизовывают из смеси (спирт:бензол). Выпавшие кристаллы отфильтровывают и высушивают на воздухе. Выход: 0,0265 г., (53,00 %).
N-метил-N1-(b-D-галактопиранозил)тиомочевины и N-метил-N1-(b-D-глюкопиранозил)тиомочевины синтезируют аналогично.
Список литературы:
1.Афанасьев В.А., Джаманбаев Ж.А., Синтез гликозилмочевин на основе N-гликозида м-нитроанилина как гликозилирующего агента. Изв. АН Киргиз. ССР, 1973, 2. 64 с.
2.Fisher E. Senthere Neuer Glycoside. — Ber . 1914, Bd 47, s. 1377—1393.
дипломов


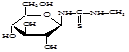
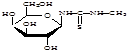
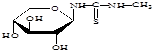
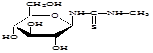
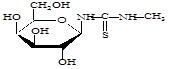
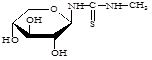
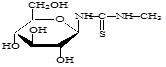
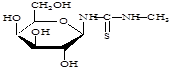
Оставить комментарий