Статья опубликована в рамках: I Международной научно-практической конференции «Естественные и математические науки в современном мире» (Россия, г. Новосибирск, 24 декабря 2012 г.)
Наука: Химия
Секция: Органическая химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
ВЗАИМОДЕЙСТВИЕ ГЛИКОЗИЛМЕТИЛНИТРОЗОМЕТИЛМОЧЕВИН С АРИЛАМИНАМИ
Эрназарова Бактыгул Кочкорбаевна
канд. хим. наук, доцент, зав. кафедрой ЖАГУ, г. Жалал-Абад
e-mail: nauca_07@ mail.ru
Установлено, что N-метил-NI-b-гликопиранозил-N-нитрозомочевины легко вступают в реакции нуклеофильного замещения при взаимодействии с ариламинами, имеющими величину рКа не ниже 3,8 [1]. Изучена также возможность образования глюкопиранозил-п-аминофенилмочевин, реакцией взаимодействия гликозилнитрозоалкилмочевин с п-фенилендиамином, однако, к сожалению, из-за сильного осмоления реакционной среды предполагаемый продукт реакции выделить в индивидуальном состоянии не удалось. Возможно, на наш взгляд, это связано резонансной формой п-фенилендиамина в условиях данной реакции:
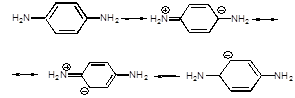
В результате исследований реакции гликозилкарбамоилирования ароматических аминов получен ряд новых углеводсодержащих производных карбамидов, характеристики которых приведены в таблице 1.
Установлено, что при непродолжительном нагревании эквимолекулярных количеств реагентов в водно-спиртовых средах гликозилнитрозометилмочевины гладко вступают в реакцию конденсации с ариламинами.
Таблица 1.
Физико-химические характеристики производных гликозилмочевин
|
№ сое- дине ния |
Названия соединения |
Вых од |
Т.пл., °С |
[λ]20 |
Rf (элюент) |
Вычислено (найдено) |
||
|
|
|
|
|
|
|
С |
Н |
N |
|
1 |
N-(β-D-глюкопиранозил)-п-бромфенилмочевина |
60 |
246 |
-41,6 (пиридин) |
0,1 (хлф-метанол) |
41,39 41,07 |
4,54 4,75 |
7,73 7,90 |
|
2 |
N-(β-D -ксилопиранозил)-п-бромфенилмочевина |
52 |
255 |
-33,9 (пиридин) |
0,12 (хлф-метанол) |
41,50 41,24 |
4,35 4,71 |
8,07 8,45 |
|
3 |
N-(β-D-галактопиранозил)-п-бромфенилмочевина |
50 |
230 |
-50 (пиридин) |
0,14 (хлф-метанол) |
41,39 41,02 |
4,54 4,81 |
7,73 7,80 |
|
4 |
N-(β-D-глюкопиранозил)-п-хлорфенилмочевина |
55 |
258 |
-49 (пиридин) |
0,15 (хлф-метанол) |
46,92 46,69 |
5Д5 5,09 |
8,42 8,85 |
|
5 |
N-(β-D-ксилопиранозил)-п-хлорфенилмочевина |
52 |
250 |
-38 (пиридин) |
0,1 (хлф-метанол) |
47,61 47,35 |
4,99 5,33 |
9,25 9,40 |
|
6 |
N-(β-D-галактопиранозил)-п-хлорфенилмочевина |
50 |
233 |
-55 (пиридин) |
0,08 (хлф-метанол) |
46,92 46,55 |
5,15 5,06 |
8,42 8,90 |
|
7 |
N-(β-D- глюкопиранозил)-2,4-дихлорфенилмочевина |
60 |
223 |
-35,5 (пиридин) |
0,5 (хлф-метанол) |
42,52 42,20 |
4,39 4,35 |
7,63 7,80 |
|
8 |
N-(β-D -ксилопиранозил)-2,4-дихлорфенилмочевина |
60 |
236 |
-41,6 (пиридин) |
0,66 (хлф-метанол) |
42,75 42,25 |
4,18 4,34 |
6,31 6,20 |
|
9 |
N-(β-D- галактопиранозил)-2,4-дихлорфенилмочевина |
57 |
215 |
-40 (пиридин) |
0,6 (хлф-метанол) |
42,52 42,45 |
4,39 4,25 |
7,63 7,55 |
При взаимодействии N-метил-NI-b-гликопиранозил-N-нитрозомочевины с п-хлор- бром-, 2,4-дихлоранилином в кипящем водно-спиртовой среде образуются игольчатые кристаллы индивидуальных соединений.
Структура полученных соединений подтверждена спектрами ПМР, ИК и элементным анализом. А также величины оптического вращения синтезированных соединений определено. В частности, в ИК-спектре N-(b-D-глюкопиранозил)-п-бромфенилмочевины, наиболее характерны интенсивные полосы поглощения в области 3200—3400 см-1 обусловленные валентным колебаниями N-H. Полосы поглощения в области 1530 и 1700 см-1 относятся к колебаниям NН-(aмид1) и С=0 (aмид 2) групп. В области 890—1150 см-1 наблюдается ряд полос, относящихся к колебаниям углеводного кольца. Интенсивные полосы при 900 см-1 указывают на наличие агликона b-положении углеводного кольца. Полосы при 825 см-1, 500—600 см-1 и 790—865 см-1 можно отнести к колебаниям группы С-СI, С-Br.
В ПМР спектрах содержатся сигналы протонов углеводного кольца в области 3,75—4,7 м.д. (протон СН резонирует при 4,7 м.д.). Протоны агликона проявляются в виде характерных мультиплетов в области 7.4—8.05 м.д. В виде уширенного синглета, принадлежащего NH-протону, связанного с фенильным кольцом, наблюдается при 7,4 м,д. Сигнал, принадлежащий NH-протону, связанный с b-глюкопиранозным остатком, проявляется в виде дублета при d=7,8 м.д. Ацетилированные соединения представляют собой белые порошкообразные вещества, растворимые в спирте, диметилсульфоксиде и пиридине,
В ИК-спектрах наблюдается ацетильная группа в области 1200—1300 см-1 (ОАс). В спектрах ПМР также присутствуют синглеты групп 0-Ме ацетатных групп в области 2,00 м.д.
Квантово-химические расчеты приведенных соединений проводились с помощью программ кооперации полуэмпирическим методом MNDO. Данный метод позволяет привести полную оптимизацию геометрических параметров молекул и получить равновесные конфигурации исследуемых соединений (рис. 1.).
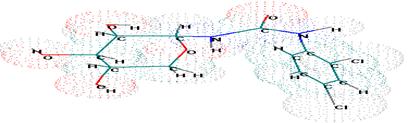
Рисунок 1. Пространственное расположение молекулы N-(b-D-гликопиранозил)-2,4-дихлорфенилмочевины
Согласно расчетам, оптимизация геометрических параметров молекулы N-(b-D-глюкопиранозил)-2,4-дихлорфенилмочевины (рис. 1.) показывает, что углеводное кольцо существует в конформации 4С1, а дихлор (бром)фенилмочевинный фрагмент повернут относительно плоскости углеводного кольца (проходящей через атомы С1 и С4).
В результате расчетов были получены следующие ИРС: теплота образования (Н), потенциал ионизации (I), дипольный момент (µ), энергия высших заполненных молекулярных орбиталей (Евзмо) (Енсмо) значения зарядов (q), валентные углы и длины связи которые представлены в таблице 2,3.
Таблица 2.
Квантово-химические индексы реакционной способности молекул методом MNDO
|
|
|
|
|
|
|
|
|||
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 3.
Квантово-химические геометрические параметры молекул методом MNDO
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Анализ данных показывает, что введение нитрозогруппы не оказывает существенного влияние на элктронную структуру углеводного кольца, но изменяет индексы порядка связей по Вибергу С8 –N9 и N9-С10 и заметно удлиняет связь С8 –N9 (от 1,2188 до 1,4701Ао). Выявлены наиболее вероятные центры для нуклеофильной атаки-атомы С8, N17, C1 несущие наибольшие отрицательные заряды. Принципиальное значение имеет вывод о существенном ослаблении связи С-N, смежной с N-алкильным заместителем, при введении N-нитрозогруппы в структуру N-алкилмочевинного агликона.
Следует отметить, что в таблице приведены заряды N7 C8 N9 О16 подлежащие обсуждению в дальнейшем, с целью выявления предполагаемого механизма реакции гликозилкарбамоилирования. В расчетах были приняты следующие обозначения:

Анализ данных таблицы 1—2 показывает, что зарядовые распределения в молекулах соединений, почти не отличаются на атомах С8 для глюкозы и галактозы, несколько меньше для соединений, полученных на основе ксилозы. Для понимания механизмов реакции важное значение имеет вопрос о внутримолекулярном взаимодействии функциональных групп в N-нитрозоалкил-мочевинном фрагменте. Исходя из квантово-химических индексов реакционной способности, выявлены наиболее вероятные реакционные центры для нуклеофильной атаки, как следовало ожидать, эти атомы C8 и N9, несущие положительный заряд (0,505 и 0435) соответственно.
Энергии высших заполненных молекулярных орбиталей (Евзмо) пропорциональные первым потенциалом ионизации, и, в свою очередь связаны с донорной способностью молекулы. Значение потенциала ионизации представляет собой взятую с обратным знаком величину (Евзмо) (удаление электрона с соответствующей молекулярной орбиты).
Из таблицы 2 видно, что в гликозилнитрозометилмочевине (потенциал ионизации -10,560 эВ) нуклеофильная атака осуществляется преимущественно по атому С8. Очевидно, что чем выше значение Евзмо тем легче отдаются электроны, и тем больше донорную способность проявляет молекула. Таким образом, чем ниже Ензмо (энергия низших свободных молекулярных орбиталей), тем более акцепторными свойствами обладает молекула. Следует отметить, что углеводный фрагмент моносахарида (глюкоза, галактоза и ксилоза) мало влияет на выше перечисленные физико-химические показатели (I, Евзмо, Ензмо, ∆Н), но заметный вклад оказывает на величину дипольного момента при сравнении значений µ производных глюкозы (галактозы) и ксилозы. При последующем введении N-агликонов (хлор, бром замещенные ариламины) в исходный гликозилнитрозо-алкилмочевин, как видно из квантово-химических расчетов, нуклеофильная атака должны осуществляется по С8. Причем, тем легче, чем больше основность N-агликонов, что подтверждается величинами зарядов по N9.
Длины связи и валентные углы в соединениях 1—9 близки к значениям, характерным для веществ данного класса. Углеводные фрагменты во всех изученных соединениях отвечают b-форме и обладают конформацией кресла 4С1.
В связи с вышеприведенными расчетами, можно обнаружить общность взаимодействия субстрат (гликозилированный карбамид) реагент (N-производные агликонов). Наличие сильного электрофильного центра в нитрозоалкилмочевинной группе (атом С8) активизирует карбамоилирующую способность в реакциях со многими нуклеофилами. Также можно наблюдать хорошие корреляции между основностью атома N9 и значениями энергий ВЗМО и НСМО, что подтверждает предположение о взаимодействии субстрат-реагент по следующему механизму:

Cогласно схеме, нуклеофильная атака аминогруппы на карбонильный углеродный атом N-нитрозомочевинного фрагмента, имеющий наибольший эффективный положительный заряд, приводит к разрыву связи C-N, смежной с нитрозогруппой, нуклеофиль присоединяется благодаря свободной электронной паре атома азота N-агликона и образуется новый интермедиат. Затем происходит стабилизация молекулы за счет внутримолекулярной перегруппировки с образованием конечного продукта.
Структуры N-нитрозоалкилмочевин с образованием внутримолекулярных эфиров карбаминовой кислоты дают основание полагать, что N-нитро-зопроизводные гликозилмочевин должны легко вступать в реакции нуклеофильного присоединения и замещения при взаимодействии с внешними нуклеофильными агентами. При этом наиболее вероятным местом нуклеофильной атаки должен быть углеродный атом карбонильной группы N-агликона, обладающий наибольшим эффективным положительным зарядом.
Таким образом, с помощью квантово-химических индексов реакционной способности можно провести корреляцию «структура-химическая активность» синтезированных соединений, где за наиболее информативную физико-химическую характеристику ответственна основность атома азота N9
Список литературы:
1.Эрназарова Б.К. Переамидирование нитрозокарбамидов сахаров: дис. кан. хим. наук. — Бишкек, 2002. — С. 75—76.
дипломов


Оставить комментарий