Статья опубликована в рамках: XII Международной научно-практической конференции «Научные достижения биологии, химии, физики» (Россия, г. Новосибирск, 07 ноября 2012 г.)
Наука: Химия
Секция: Органическая химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
СИНТЕЗ НОВЫХ ПИРАЗОЛО[3,4-b]ПИРИДИНОВ И ИХ БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
Максимова Вероника Николаевна
аспирант Чувашского государственного университета имени И.Н. Ульянова, г. Чебоксары
Е-mail: nikamaxim@mail.ru
Гетероциклические соединения пиридинового ряда являются перспективными объектами исследования, что связано, прежде всего, с широким спектром биологической активности их производных. В настоящее время в литературе имеются данные по изучению свойств 2-галогенпиридин-3-карбонитрилов, где они являются субстратами для синтеза разнообразных гетероциклических систем с различной биологической активностью, например противогрибковой [2, с. 593], противовоспалительной [4, с. 4547], болеутоляющей [1, с. 240], противотуберкулезной [3, с. 2929], противоопухолевой [6, с. 1079]. В ряду производных важное место занимают конденсированные гетероциклы, синтез которых становится доступным благодаря наличию необходимых групп в исследуемых соединениях. В данной работе описан синтез новых производных ряда пиразоло[3,4-b]пиридинов на основе 2-галогенпиридин-3,4-дикарбонитрилов. Образование 3-амино-1H-пиразоло[3,4-b]пиридинов в реакции 2-хлорпиридин-3-карбонитрилов с гидразином может идти двумя различными путями. Первый включает нуклеофильное замещение атома хлора гидразиновым фрагментом, а затем внутримолекулярную атаку сучастием электронодефицитного атома углерода цианогруппы. Второй заключается в нуклеофильном присоединении гидразина поцианогруппе с формированием гидразидинов (амидразонов) ипоследующем внутримолекулярном замещении атома галогена [5, с. 420].
3-Аминопиразоло[3,4-b]пиридины 3а-в были получены в результате реакции 2-хлорпиридин-3,4-дикарбонитрилов 1 с двойным избытком гидразингидрата при кипячении в пропаноле-2 с высокими выходами (82—95 %). При комнатной температуре нам удалось выделить 2-гидразинопиридин-3,4-дикарбонитрилы 2, которые при нагревании (70—80°С) в среде пропанола-2 далее превращаются в пиразоло[3,4-b]пиридины3. Этот факт подтверждает формирование 3-аминопиразоло[3,4-b]пиридинов через стадию образования гидразинопиридинов 2 в качестве промежуточных соединений.
Таким образом, в первоначально образующимся продукте замещения хлора гидразиновым фрагментом 2 реализуется внутримолекулярная циклизация с участием второго нуклеофильного центра и сближенной с ним цианогруппы (сх. 1).
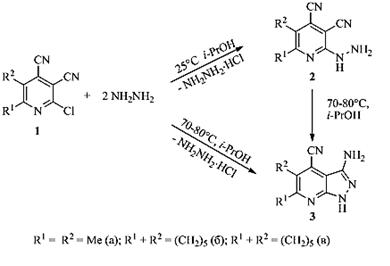
Схема 1.
Структура соединений 2, 3 предложена на основании данных ИК, ЯМР 1Н спектроскопии и масс-спектрометрии. В ИК спектрах имеются полосы поглощения валентных колебаний аминогруппы в области 3123—3448 см-1 и сопряженной нитрильной группы в области 2209—2225 см-1. Для спектров ЯМР 1Н 2-гидразинопиридинов 2 характерны сигналы протона при атоме азота в виде синглета в области 8,64—8,72 м.д., протонов аминогруппы в виде синглета в области 4,53—4,59 м.д. Сигналы протонов N-H и NH2 пиразоло[3,4-b]пиридинов 3 смещаются в слабое поле и резонируют в области 12,39—12,44 и 5,09—5,14 м.д. соответственно (приведены примеры спектров соединений 2в и 3в на рис. 1 и рис. 2 соответственно). Масс-спектры соединений 2, 3 характеризуются наличием молекулярного иона.
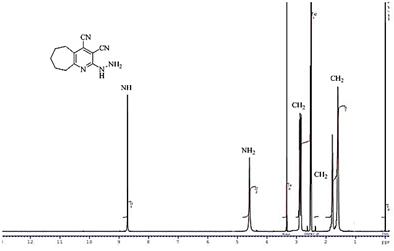
Рисунок 1. Спектр ЯМР 1Н соединения 2в
(Растворитель — ДМСО-d6, частота прибора — 500,13 MHz, эталон — ТМС)
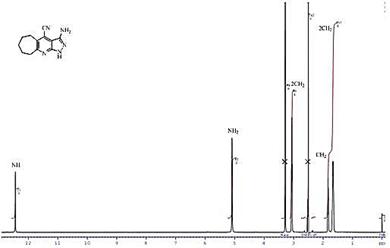
Рисунок 2. Спектр ЯМР 1Н соединения 3в
(Растворитель — ДМСО-d6, частота прибора — 500,13 MHz, эталон — ТМС)
Спектр потенциальный биологической активности соединений 2,3 полученных на основе 2-хлорпиридин-3,4-дикарбонитрилов, анализировали при помощи программы PASS (PredictionofActivitySpectraforSubstances). В ходе проведения прогнозирования было выяснено, что 2-гидразинопиридин-3,4-дикарбонитрилы 2 возможно будут эффективными вазодилататорами, пиразоло[3,4-b]пиридины 3 могут выступать в качестве противоопухолевых препаратов.
Среди спектров предсказанных биологических эффектов наиболее перспективным направлением изучения возможных воздействий синтезированных нами цианосодержащих гетероциклов на биологические объекты является исследование их противоопухолевой активности. Эта работа была проведена в США, в Национальном институте рака. При испытании в NCI синтезированных соединений на противоопухолевую активность использовалась модель invitro позволяющая стандартизировать условия эксперимента для повторяющихся серий. Исследования проведены на 60 клеточных линиях, полученных из твердых опухолей легких, прямой кишки, мозга, яичников, почек, предстательной железы, молочной железы, а также лейкемии и меланомы человека. Определяли процент роста (ПР) опухолевых клеток. Наиболее чувствительны к этим веществам опухолевые клетки рака крови. Процент роста составил при концентрации 1.00E-5 моль/л для соединения 3а 53 %, а для соединения 3б при той же концентрации 8 %.
Таким образом, наличие необходимых групп делает 2-галогенпиридин-3,4-дикарбонитрилы предшественниками пиразолопиридинов и позволяет осуществить реакцию с гидразином при комнатной температуре, с образованием 2-гидразинопиридин-3,4-дикарбонитрилов 2. Нагревание последних в среде пропанола-2 приводит к новым пиразоло[3,4-b]пиридинам 3, которые являются перспективными соединениями для дальнейших исследований.
Списоклитературы:
- Abdel-Hafez, Sh. H. Selenium-Containing Heterocycles: Synthesis and Pharmacological Activities of Some New 4-Methylquinoline- 2(1H) Selenone Derivatives / Sh. H. Abdel-Hafez, M.A. Hussein // Archiv der Pharmazie (Weinheim, Germany). — 2008. — Vol. 341. — № 4. — P. 240—246.
- El Mariah, F. Synthesis, reactions and antimicrobial activity of thieno[2,3-c]pyridazine derivatives / F. El Mariah // Journal of Chemical Research, Synopses. — 2009. — № 10. — P. 593—598.
- Gangjee, A. Synthesis of 2,4-Diamino-6-(thioarylmethyl)pyrido [2,3-d]pyrimidines as Dihydrofolate Reductase Inhibitors / A. Gangjee, O. Adair, Sh.F. Queener // Bioorganic & Medicinal Chemistry. — 2001. — Vol. 9. — № 11. — P. 2929—2936.
- Hamdy, N.A. New pyridone, thioxopyridine, pyrazolopyridine and pyridine derivatives that modulate inflammatory mediators in stimulated RAW 264.7 murine macrophage / N.A. Hamdy, A.M. Gamal-Eldeen. // European Journal of Medicinal Chemistry. — 2009. — Vol. 44. — № 11. — P. 4547—4556.
- Lynch, B.M. Pyrazolo[3,4-b]pyridines: Syntheses, reactions, and nuclear magnetic resonance spectra / B.M. Lynch, M.A. Khan, H.C. Teo, F. Pedrotti // Canadian Journal of Chemistry. — 1988.— Vol. 66. — № 3. — P. 420—428.
- Zink, M. Structural variations of piritrexim, a lipophilic inhibitor of human dihydrofolate reductase: synthesis, antitumor activity and molecular modeling investigations / M. Zink, H. Lanig, R. Troschuetz // European Journal of Medicinal Chemistry. — 2004. — Vol. 39. — № 12. — P. 1079—1088.
дипломов

Оставить комментарий