Статья опубликована в рамках: VII Международной научно-практической конференции «Научные достижения биологии, химии, физики» (Россия, г. Новосибирск, 07 мая 2012 г.)
Наука: Химия
Секция: Неорганическая химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
Исследование влияния внешних условий и исходных веществ на рост и форму кристаллов
Разина Светлана Михайловна
преподаватель, Самарский машиностроительный колледж, г. Самара
e-mail: nikitapopov01@mail.ru
Теоретическая часть
С миром кристаллов, чудесным и разнообразным, человек встречается на каждом шагу. Например, когда добавляет в чай мелкие кристаллы сахарного песка. Поваренная соль, без которой не обходится ни один человек, также состоит из отдельных маленьких частичек, хотя в природе встречаются большие прозрачные кристаллы каменной соли, немного похожие на хрусталь. Зимой лужи покрываются тонким слоем льда – это кристаллическая вода. Люди, посвящающие свою жизнь кристаллу, часто воспринимают его живым. Они говорят о нём как о живом существе. Металловеды говорят об усталости металлического кристалла, о его старении, способности отдыхать, издавать звуки. Геологи говорят о памяти минерала, о его способности разумно приспосабливаться к внешним условиям. Жидким кристаллам не повезло. Хотя их открытие совпало с моментом, когда закладывался фундамент здания современной физики. Их место именно в фундаменте! Ведь за всю историю, с глубокой древности до наших дней, человеку не удавалось выйти за пределы трёх понятий, описывающих, казалось бы, все состояния материи: газ, жидкое и твёрдое тело. [1]
Обратимся к определению: Кристалл – твердое вещество, которое имеет четкую геометрическую форму с острыми углами и плоскими, гладкими поверхностями.
Если пронаблюдать за историей изучения кристаллов, то можно узнать, что кристаллом (от греч. krystallos- "прозрачный лед") вначале называли прозрачный кварц (горный хрусталь), встречавшийся в Альпах. Горный хрусталь принимали за лед, затвердевший от холода до такой степени, что он уже не плавится. Первоначально главную особенность кристалла видели в его прозрачности и это слово употребляли в применении ко всем прозрачным природным твердым телам. Позднее стали изготавливать стекло, не уступавшее в блеске и прозрачности природным веществам. Предметы из такого стекла тоже называли "кристальными". Еще и сегодня стекло особой прозрачности называется хрустальным. Удивительной особенностью горного хрусталя и многих других прозрачных минералов являются их гладкие плоские грани. В конце 17 в. было подмечено, что имеется определенная симметрия в их расположении.
|
Рисунок 1. Варианты огранки кристаллов |
Было установлено также, что некоторые непрозрачные минералы также имеют естественную правильную огранку и что форма огранки характерна для того или иного минерала. [3] |
В конце концов, кристаллами стали называть все твердые вещества, имеющие природную плоскую огранку. Заметной вехой в истории кристаллографии явилась книга, написанная в 1784 французским аббатом Р. Гаюи. Он выдвинул предположение, что кристаллы возникают в результате правильной укладки крохотных одинаковых частиц, которые он назвал "молекулярными блоками". Гаюи показал, каким образом можно получить гладкие плоские грани кальцита, укладывая такие "кирпичики". Различия в форме разных веществ он объяснил разницей, как в форме "кирпичиков", так и в способе их укладки. Следует заметить, что в природе различаются жидкие кристаллы, кристаллы кварца. Жидкие кристаллы – это те кристаллы, которые при нагревании становятся мутными. Они применяются в жидкокристаллических дисплеях (ЛСД) в часах, калькуляторах и телевизорах. Когда через жидкий кристалл пропускается электрический заряд, его молекулы выстраиваются в ряд и блокируют поступление света. Телевизионные экраны содержат много тысяч мельчайших кристаллических единиц. Именно они выстраивают движущуюся картинку, которую мы видим при включении телевизора в сеть. Когда электрический ток проходит через кристалл кварца, он вибрирует, совершая едва уловимые колебания со скоростью 32768 раз в секунду. Это называется пьезоэлектрический эффект. Колебания кварца научились использовать для измерения времени в часах. В земле иногда находят камни такой формы, как будто их кто-то тщательно выпиливал, шлифовал, полировал. Трудно поверить, что такие идеальные многогранники образовались сами, без помощи человека. Кристаллы, залегающие в земле, бесконечно разнообразны. Размеры их достигают подчас человеческого роста. Встречаются кристаллы - лепестки тоньше бумаги и кристаллы - пласты в несколько метров толщиной. В музее Горного Института в Санкт-Петербурге хранится кристалл горного хрусталя высотой около метра и весом больше тонны, который много лет служил тумбой у ворот одного из домов в Свердловске. [6]
Практическая часть.
Я попробовала вырастить некоторые кристаллы. Так, например, я вырастила кристаллы медного купороса, алюмокалиевых квасцов, поваренной соли, хромокалиевых квасцов, а также кристаллы меди.
1. Выращивание кристаллов медного купороса.
Для начала, мне потребовалось приобрести медный купорос (CuSO4).
Во-первых, растворимость медного купороса при 20°С составляет 35.6 г в 100 г воды. Например, если взять 200 мл воды, значит необходимо 35.6·200/100=71.2 г CuSO4 · 5H2O. [7] А как быть при других температурах? С ростом температуры растворимость сульфата меди сначала увеличивается, потом почти перестает зависеть от температуры. Поэтому, чтобы исключить влияние колебаний температуры в лаборатории, точности взвешивания и других факторов мы взяли количество медного купороса, раза в полтора большее расчетного. Например, в нашем случае это 71.2·1.5=107 г. Во-вторых, залили соль водой и оставили примерно на сутки, время от времени перемешивая. Когда растворение медного купороса прекратилось, и наступило равновесие, мы профильтровали раствор через неплотную фильтровальную бумагу. Избыток соли остался на фильтре. Затем я налила полученный раствор в стакан. Далее выбрала крупный и хорошо сформированный кристаллик и привязали его к нитке. Кристаллик послужил затравкой. Привязали второй конец нитки к карандашу и опустили затравку в раствор, накрыли стакан марлей - для защиты от пыли. Все, что оставалось - ждать. Через несколько дней рост кристалла был виден визуально, за неделю мы вырастили кристалл длиной в 1 см, за три-пять недель – 5 см. В стакане постоянно образовывался осадок мелких кристалликов, для этого я переливала раствор в чистый стакан и переносила в него наш кристалл. В ходе нашего эксперимента такую процедуру пришлось проделать несколько раз. Со временем на нитке тоже образуются мелкие кристаллики, которые начинают расти. [4] Избежать этого сложно, можно разве что поднять кристалл повыше, чтобы меньший отрезок нитки контактировал с раствором. Во время эксперимента возникла идея использовать вместо хлопчатобумажной нитки тонкую медную проволочку или капроновую нитку, однако на них затравка росла значительно хуже. Эксперимент длился около месяца.
Кристаллы разной формы можно получить, меняя температуру, величину кристаллов – зародышей, размеры сосуда, создавая тем самым оптимальные для роста условия. [2]
Внешний вид кристалла определяется формой тех частичек, из которых он построен, а также силами взаимодействия, связывающими структурные единицы кристалла в единое целое. Форму можно изменить, если ввести небольшое количество примесей. [5]
2. Выращивание кристаллов хромокалиевых квасцов.
Процесс выращивания кристаллов хромокалиевых квасцов мало отличается от процесса выращивания медного купороса, но сростки кристаллов квасцов легко рассыпаются, поэтому, как ни странно, вырастить монокристалл хромокалиевых квасцов проще, чем вырастить сросток.
Порошок хромокалиевых квасцов имеет черно-фиолетовый цвет, форма их кристаллизации – октаэдр. Раствор окрашен в темный сине-зеленый цвет, но в стакане он выглядит черным. Ни нитку, ни кристалл в нем не видно. Кристалл также можно легко обработать обычной пилкой для ногтей, что говорит о сравнительно небольшой его твердости.
Итак, у нас есть стакан, вещество, нитка и немного воды. Казалось бы, этого достаточно, чтобы вырастить кристалл – но нужна еще одна важная вещь – затравка. Затравка – это небольшой кристаллик вещества, опускаемый в раствор для роста монокристалла. Можно попытаться использовать вместо затравки кусочек проволоки или еще что-то, но обычно это не дает желаемого результата и вместо одного кристалла вырастает много маленьких по всей площади затравки, а этого нам не надо.
Итак, как же получить затравку? В некоторых описаниях рекомендуется найти в исходном веществе кристаллик с длиной ребра хотя бы 1 миллиметр, но даже высыпав все вещество на стол и просидев над ним час, мы не нашли ни одного подходящего кристалла. Затравку, на самом деле, получить очень просто. Получаем пересыщенный и оставляем на пару дней. Далее сливаем раствор в другой сосуд (он еще понадобится). На дне должен получится осадок, который легко ломается ложкой.
Из него выбираем наиболее правильный кристаллик и привязываем к нитке. Далее готовим пересыщенный раствор на основе старого, нагревая его и добавляя еще вещество (можно использовать и имеющийся осадок) и даем ему остыть. После этого опускаем затравку в раствор и оставляем в месте, не подверженном перепаду температур.
В случае хромокалиевых квасцов, где-то через неделю затравка должна превратиться в кристаллик с длиной ребра около 0,5 см. Монокристаллы этого вещества растут сравнительно быстро, даже если площадь кристаллизации большая. За два с половиной месяца у нас вырос монокристалл хромокалиевых квасцов с длиной ребра в 4 сантиметра.
Время от времени на монокристалле образуются маленькие кристаллики – их называют кристаллами-паразитами. Они легко удаляются пилкой для ногтей – достаточно спилить кристаллик до основания и опустить основной кристалл в раствор – грань будет продолжать расти безо всяких видимых дефектов.
Стоит отметить одну интересную особенность монокристаллов – они «самоизлечиваются», то есть, если придать кристаллу какую-нибудь искусственную форму, и поместить обратно в раствор, он восстановится. К примеру, когда от одного из кристаллов при падении отломился кусок, мы поместили кристалл обратно в раствор и за полторы недели этот кусок восстановился безо всяких видимых дефектов. Это происходит из-за природной способности кристаллов к самоогранке, которая, в свою очередь, зависит от кристаллической решетки.
Если вы не хотите изменять структуру и состав кристалла проволочкой, то для этого же эксперимента подойдут алюмокалиевые квасцы (K2SO4 · Al2(SO4)3*24H2O). Порошок этого вещества белый, раствор и кристаллы – бесцветные и прозрачные, но на воздухе мутнеют и разрушаются. Алюмокалиевые квасцы интересны тем, что имеют такую же форму кристаллизации, как и хромокалиевые, это явление называется изоморфизмом.
Возьмем кристалл хромокалиевых квасцов и опустим в пересыщенный раствор алюмокалиевых. Кристалл начал немного растворяться – это прекратилось где-то через 5 минут, когда кристалл приспособился к новой среде. Через некоторое время кристалл вынули из раствора – получили «кристалл в кристалле» - черный кристалл хромокалиевых квасцов, заключенный в оболочку из кристалла алюмокалиевых квасцов.
Смесь же растворов алюмокалиевых и хромокалиевых квасцов может дать поразительное количество оттенков, в которые будет окрашен кристалл – от аметистово-сиреневого до рубинового и от светло-розового до темно-фиолетового.
Если вам покажется, что монокристаллы растут слишком медленно, подумайте о том, что если ребро кубического кристалла поваренной соли равно 1 см, то оно состоит примерно из 3*107 ионов. Ведь для того, чтобы такое большое количество частиц встало на свое место нужно некоторое время, не так ли?
3. Выращивание кристаллов хлорида натрия.
Описание натрия хлорид
Что такое хлорид натрия? Это менее распространенное название обычной поваренной (столовой) соли. Ее кристаллы имеют безупречно ровную форму в виде куба и их сложно вырастить. Как правило, они растут хаотически, а если случается вырастить хоть один кристалл, то и он вскоре распадется. Поэтому при выращивании кристалла хлорида Вам придется задействовать очень чистую соль. Натрия хлорид, описание которого Вы сможете узнать из многих источников, при получении имеет немало трудностей. Именно их мы и рассмотрим.
Натрия хлорид. Описание его получения.
При приготовлении натрия хлорида, раствор необходимо готовить в воде при комнатной температуре или немного теплее (минус 28—30 градусов), что связано с активным поглощением солью тепла. Раствор оставляют на 3—4 дня до момента выпадения первых раздельных кристаллов.
Если заметите хаотическое выпадение кристаллов и в большом количестве, добавьте в раствор немного воды и переставьте емкость в прохладное место. И еще: в случае, если Вы увидите кроме основного кристалла выпавшие, то удалите их и изредка фильтруйте жидкость.
В природе натрий хлорид встречается в виде минерала галита (каменная соль), а также в воде океанов и морей, рапе соляных озер и подземных рассолах.
4. Выращивание кристаллов меди.
Затем я вырастила красные кристаллы меди. Я использовала следующие компоненты: медный купорос, поваренная соль, стальная пластинка по форме сечения ёмкости (немного меньшего периметра), где росли кристаллы меди и кружок из промокательной бумаги в форме сечения. Итак, я положила немного медного купороса на дно пузырька (равномерно по площади). Сверху насыпала поваренной соли и закрыла всё это вырезанным кружком бумаги. На неё положили железную пластинку. Всё это вместе залила насыщенным раствором поваренной соли (такой раствор я готовила из поваренной соли). Оставила ёмкость приблизительно на неделю. За это время выросли иглоугольные красные кристаллы меди. Когда идёт процесс роста мы старались не переносить ёмкость, а также не изымали кристаллики из раствора.
Можно вырастить кристалл разноцветным и многослойным. Их получают путём приготовления растворов квасцов (двойные соли серной кислоты) и переносят поочерёдно выращиваемый кристаллик из одного раствора в другой. Если смешать горячие концентрированные растворы сульфатов алюминия Al2(SO4)3 и калия K2(SO4), а полученный раствор охладить, то из него начнут кристаллизоваться квасцы — двойной сульфат калия и алюминия 2KAl(SO4)2•12Н2О. Квасцы растворяются в воде так: 5,9 г на 100 г воды при 20°С, но уже 109 г — при 90°С в пересчёте на безводную соль. При хранении на воздухе квасцы выветриваются. При температуре 92,5°С они плавятся в своей кристаллизационной воде, а при нагревании до 120°С обезвоживаются, переходя в жжёные квасцы, которые разлагаются лишь при температуре выше 700°С. Молекулы воды, входящие в состав квасцов, связаны химической связью с ионами калия и алюминия, поэтому соли квасцов имеют формулу, которую правильнее записывать в виде комплексной соли [K(H2O)6][Al(H2O)6](SO4)2.
В результате выращивания различных кристаллов я выявила зависимость, что размер кристалла зависит от времени выращивания, а также от температурного режима, эти данные мы записали в таблицу:
Таблица 1
Зависимость между временем выращивания кристалла и температурного режима
|
Время выращивания |
Размер кристаллов |
Температурный режим |
|
1—2 часа |
Мелкие |
Быстрое охлаждение |
|
20—22 часов |
Средние |
Среднее охлаждение |
|
40—60 часов |
Большие |
Медленное охлаждение |
В ходе моей исследовательской работы я вырастила следующие кристаллы:
Таблица 2
Выращенные кристаллы
|
Компоненты (формула) |
Размер кристалла |
Форма и вид |
|
K2SO4*Al2(SO4)3*24H2О Хлорокалиевые квасцы |
50 мм |
Чёрные октаэдрические формы кристаллов |
|
CuSO4*7H2O Медный купорос |
30 мм |
Неправильный слоистый многоугольник |
|
AlK(SO4)2*12H2 O Алюмокалиевые квасцы |
70 мм |
Овальные октаэдрические кристаллы |
|
NaCl Поваренная соль |
1—2 мм |
Мелкая слоистая форма |
|
Медь |
20 мм |
Иглоугольные красные кристаллы |
Рисунок 2. Зависимость размеров выращиваемых кристаллов от времени охлаждения раствора
Наконец, я составила алгоритм выращивания кристаллов:
Этап 1: Растворить соль, из которой будет расти кристалл, в подогретой воде. Подогреть необходимо для того, чтобы соли растворилось немного больше, чем может раствориться при комнатной температуре. Для этого стакан поставить в кастрюлю с теплой водой. Растворять соль до тех пор, пока соль уже больше не растворяется.
Этап 2: Насыщенный раствор перелить в другую ёмкость, где можно производить выращивание кристаллов (с учётом того, что он будет увеличиваться).
Этап 3: Привязать на нитку кристаллик. Нитку можно привязать, например, к спичке (можно также сделать перемычку из стержня шариковой ручки) и положить спичку на края стакана (ёмкости), где находится насыщенный раствор. Кристаллик опустить в насыщенный раствор.
Этап 4: Перенести ёмкость с насыщенным раствором и кристалликом в место, где нет сквозняков, вибрации и сильного света. Соблюдение этих условий при выращивании кристаллов является обязательным.
Этап 5: Накрыть сверху ёмкость с кристалликом (например бумагой) от попадания пыли и мусора. Оставить раствор на несколько дней
В ходе выполнения работы мне стали интересны мнения других людей, знают ли они, как вырастить какие-либо кристаллы в домашних условиях. Выращивали ли они когда-нибудь какие-либо кристаллы? Для этого я составила анкету и проанкетировала студентов 1 курса нашего колледжа. Полученные результаты я переработала, в результате выявились следующие данные, что большинство студентов колледжа понятие не имеют о выращивании кристаллов, но были и такие кто выращивал кристаллы в школьных лабораториях ради своего интереса.
Анкета:
1) Знаете ли вы, что такое кристаллы?
2) Выращивали ли вы кристаллы, если да то какие?
3) Какие виды кристаллов вы знаете?
4) Хотели вы бы попробовать вырастить кристалл?
5) Какие кристаллы вы видели?
6) Какой кристалл вам понравился больше всего?
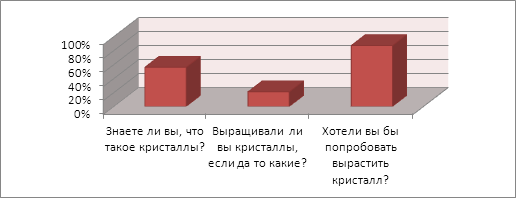
Рисунок 3. Результаты социологического опроса
Обычно на вопрос «Какие виды кристаллов вы знаете?», студенты отвечали: алмаз, рубин, малахит и пр., а на вопрос «Какой кристалл вам понравился больше всего?», студентки дружно отвечали: алмаз!
Заключение.
После проведенной работы я пришла к выводам, что:
· вещество не должно быть токсичным;
· вещество должно быть стабильным;
· доступность и приемлемая цена реактивов;
· вещество должно быть достаточно химически чистым;
· способность вещества растворяться в доступном растворителе;
· должен быть известен характер растворения вещества;
· образующиеся кристаллы должны быть стабильны.
И в заключении, должны сказать, повествование о живом и не умирающем не может быть завершено, его можно лишь оборвать. Именно это я и вынуждена сделать, рассказав о «живом жидком кристалле» лишь малую долю из того, что о нём известно. Я попыталась рассказать о том, что такое кристаллы, каковы их свойства, возможные применения. Жидкие кристаллы, ещё далеко, далеко не распознаны. Нет пока теории, которая бы смогла учить и объяснять все макроскопические свойства. Ещё не все аналоги твердых кристаллических эффектов в жидких кристаллах обнаружены. Биологи только нащупывают подходы к изучению жидкокристаллического состояния биологических объектов. Словом «белых пятен» на кристаллической копии пока больше, чем исследованных. Эти «белые пятна» ждут своих первооткрывателей. В развитии каждой отрасли науки, если периоды открытий, забвений, взлета не является исключением наука о кристаллах. И если период забвения закончился, то взлёта кристаллы, видимо, не достигли. Если вначале взлёта присутствовали элементы восторга, бума, то теперь пришло время оглянуться и поразмыслить.
Список литературы:
1.Алексинский В. Н. Занимательные опыты по химии: уч. попсобие, М.: Просвещение, 1995. - 215 с.
2.Здорик Т. Б. Камень, рождающий металл: справоч. пособие М.: Просвещение, 1984. – 350 с.
3.Кантор Б. З. Минерал рассказывает о себе: справочник, М.: Недра, 1985. – 300 с.
4.Ольгин О. М. Опыты без взрывов: науч. пособие, М.: Химия, 1995. – 250 с.
5.Полосин В. С. Школьный эксперимент по неорганической химии: справочник, М.: УЧПЕДГИЗ, 1959. - 150 с.
6.Стёпин Б. Д., Аликберова Л. Ю. Книга по химии для домашнего чтения: справочник, М.: Химия, 1994. – 190 с.
7.Шаскольская М. П. Кристаллы: справочник, М.: Наука, 1985. – 315 с.
дипломов

Оставить комментарий