Статья опубликована в рамках: VII Международной научно-практической конференции «Научные достижения биологии, химии, физики» (Россия, г. Новосибирск, 07 мая 2012 г.)
Наука: Биология
Секция: Ботаника
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
ОСОБЕННОСТИ СТРУКТУРНОЙ ОРГАНИЗАЦИИ ХВОИ ГИБРИДОВ МЕЖДУ КЕДРОМ СИБИРСКИМ (PINUS SIBIRICA DU TOUR) И КЕДРОВЫМ СТЛАНИКОМ (PINUS PUMILA (PALL.) REGEL)
Васильева Галина Валерьевна
канд. биол. наук, мл. науч. сотр.,
ФГБУН ИМКЭС СО РАН, г. Томск
;
Гирсова Светлана Леонидовна
канд. физ.-мат. наук., мл. науч. сотр.,
ФГБУН ИФПМ СО РАН, г. Томск
E-mail: girs@ispms.ru
Пшеничников Антон Павлович
канд. физ.-мат. наук., мл. науч. сотр.,
ФГБУН ИФПМ СО РАН, г. Томск
Введение
Гибриды разных видов растений обычно являются промежуточными относительно своих родительских видов по морфологическим признакам [12]. Кедр сибирский и кедровый стланик – виды, существенно отличающиеся жизненными формами. Кедр сибирский – дерево первой величины, формирующее полог леса [4], у кедрового стланика жизненная форма стланца, способного к зимнему полеганию [5]. Гибриды этой пары видов, сочетая признаки обеих жизненных форм, формируют промежуточный габитус, который не относится ни к прямостоячим, ни к стелющимся деревьям [2, 3]. С другой стороны, в некоторых случаях гибриды имеют признаки, характерные только для одного из родительских видов. Для гибридов кедра сибирского и кедрового стланика такими признаками являются цвет созревающих шишек (такой же фиолетовый как у кедра сибирского) и способность формировать адвентивные корни из проксимальных спящих почек, как у стланика [3].
Очень часто для идентификации видов используют анатомические признаки хвои [6]. Кедр сибирский и кедровый стланик отличаются по ряду таких признаков. К отличительным признакам хвои кедра сибирского относятся: округлая форма клеток мезофилла, наличие трех смоляных каналов, погруженных в мезофилл, т. е. паренхиматических. Кедровый стланик отличается складчатыми клетками мезофилла, двумя смоляными каналами, которые контактируют с покровными тканями [6, 7]. Цель данной работы – исследование структурной организации хвои гибридов между кедром сибирским и кедровым стлаником в сравнении с родительскими видами.
Материалы и методы
Исследование проводили в 2011 г. на научном стационаре «Кедр» Института мониторинга климатических и экологических систем СО РАН, который расположен в 30 км к югу от г. Томска, (56°13' с.ш., 84°51' в.д., 78 м над ур. м.). Исследуемые деревья были представлены прививками, черенки видов и гибридов были привиты на местный экотип кедра сибирского в 1997 г. Всего было исследовано по 5 клонов видов и 3 клона гибридов. Фиксацию материала и измерения интенсивности фотосинтеза проводили 18 июля с 10.30 до 11.30. Для анализа структуры хвои по 10 брахибластов фиксировали 70 % раствором этанола. Поперечные срезы толщиной 30 мкм делали в средней части хвои на замораживающем микротоме и помещали в глицерин. Все измерения анатомических показателей проводили на временных препаратах при помощи аппаратно-программного комплекса SIAMS MesoPlant. Анализировали следующие признаки: длина хвои, ее ширина и толщина, число смоляных каналов и их расположение, площадь поперечного сечения хвои, диаметр центрального цилиндра и смоляных каналов (с помощью которых затем рассчитывали соответствующие площади). Кроме того, высчитывали площадь мезофилла на срезе и площадь поверхности хвоинки.
Ультратонкие срезы для исследования ультраструктуры хвои готовили по следующей методике. Высечки из хвои, по 1 шт. с 5 хвоинок (с разных брахибластов) фиксировали в забуференном 0,1М какодилатным буфером (pH 7,4) 2,5 % растворе глютарового альдегида в течение 2 часов при температуре 40С. Далее дважды промывали 0,2 М какодилатным буфером (pH 7,4) по 10—15 минут, после чего постфиксировали в 1 % растворе четырехокиси осмия (на 0,1 М какодилатном буфере) в течение 2 часов с последующим двукратным отмыванием 0,2 М какодилатным буфером (по 10—15 минут). Затем материал дегидратировали в этиловых спиртах восходящей концентрации: в 30 % и 50 % этаноле – по 15—20 мин, в 70 % – оставляли на ночь, затем в 80 %, 90 %, 96 % – по 15—20 минут в каждом, в абсолютном спирте или ацетоне — по 20—30 минут дважды.
Дегидратированные препараты заключали в смесь смол эпон и аралдит [11]. Для этого готовили смесь смол в следующих пропорциях: эпон 812 – 4 г, аралдит 502 – 2 г, эпон DDSA – 9 г, катализатор DMP-30 – 120 мкл.
Пропитку препаратов проводили по следующей схеме:
смесь смол : абсолютный ацетон 1:3 — 4 – 8 часов;
смесь смол : абсолютный ацетон 1:1 — 4 – 8 часов;
смесь смол : абсолютный ацетон 3:1 — 4 – 8 часов;
смесь смол — от 12 до 24 часов;
новая смесь смол в другой посуде — от 12 до 24 часов;
Затем препараты переносили в свежую смесь смол для полимеризации. Полимеризацию проводили в течение 1,5 – 2 суток при 60 0С.
Ультратонкие срезы толщиной 60—100 нм готовили на ультратоме “UC7” (“Leica”, Австрия). Полученные срезы наносили на медные сеточки и контрастировали 2 % раствором уранилацетата на 50 % этаноле (10—20 минут при 370С) и цитратом свинца (от 3 до 10 минут при комнатной температуре) по методу, описанному в [13]. Структуру хлоропластов в клетках мезофилла изучали при помощи просвечивающего электронного микроскопа “Э-125К” при ускоряющем напряжении 75 кВ.
Кроме того, исследовали интенсивность фотосинтеза и содержание пигментов. Интенсивность фотосинтеза у всех объектов измеряли с помощью прибора Li-Cor 6400 при одинаковых температуре, освещенности и влажности. Содержание пигментов определяли по стандартной методике [8] с помощью спектрофотометра UV-1601PC (Shimadzu, Япония).
Данные обрабатывали с помощью программы Statistica 6.0. В таблице приведены средние значения и стандартное отклонение. Выборки сравнивали T-тестом, критический уровень значимости приняли равным 0,05. Наличие отличий показывали разными буквами, если отличия отсутствовали, буквы ставили одинаковые.
Результаты и обсуждение
Рассмотрим структуру хвои гибридов между кедром сибирским и кедровым стлаником, сравнивая сначала виды между собой, а затем – гибриды с видами. Хвоя кедра сибирского имела 3 паренхиматических смоляных канала, а клетки мезофилла имели округлую форму без складок. Исследованная хвоя кедрового стланика отличалась сильно складчатыми клетками мезофилла и наличием 2 смоляных каналов, которые контактировали с покровными тканями. Гибриды отличались большим разнообразием, чем их родительские виды. Некоторые гибриды имели 3 смоляных канала, некоторые – 2, даже у одной гибридной особи встречались хвоинки с 2 и 3 смоляными каналами. Расположение смоляных каналов могло быть как паренхиматическим, так и контактным. Форма клеток мезофилла варьировала от округлых без складок, как у кедра сибирского, до сильно складчатых, как у кедрового стланика, при этом часто наблюдались клетки, имеющие слабоскладчатую форму. Таким образом, хвоя гибридов по качественным признакам, различающим виды, характеризовалась промежуточным и мозаичным строением.
Количественные признаки хвои для видов также различны. Хвоя кедра крупная и значения всех измеренных признаков были больше, чем таковые кедрового стланика; статистически значимых различий не было лишь по отношению ширины хвоинки к ее толщине и по общей площади смоляных каналов (табл. 1). Количественные признаки у гибридов были промежуточными относительно родительских видов, однако статистически значимые различия наблюдались только при их сравнении с кедром сибирским. В целом, полученные нами данные хорошо согласуются с данными, полученными ранее на примере гибридов, обнаруженных в дельте р. Верхняя Ангара [1].
Таблица 1
Структурные признаки хвои кедра сибирского, кедрового стланика и их гибридов
Признак |
Кедр сибирский |
Гибриды |
Кедровый стланик |
Длина, мм |
93±6 a |
72±14 b |
67±10 b |
Ширина, мкм |
1119±85 a |
906±105 b |
803±109 b |
Толщина, мкм |
929±70 a |
747±112 b |
698±56 b |
Отношение ширины к толщине |
1,21±0,12 a |
1,22±0,08 a |
1,15±0,08 a |
Площадь: |
|
|
|
поперечного сечения, мкм2´103 |
621,48±74,16 a |
421,94±110,83 b |
344,75±61,55 b |
мезофилла, мкм2´103 |
463,55±49,59 a |
322,56±91,81 b |
256,76±46,03 b |
центрального цилиндра, мкм2´103 |
124,7±18,20 a |
74,08±17,10 b |
65,44±10,07 b |
смоляных каналов, мкм2´103 |
33,86±8,59 a |
25,30±4,43 a |
22,55±9,63 a |
поверхности хвоинки, мм2 |
322,3±14,4 a |
205,4±62,1 b |
177,3±26,0 b |
|
а |
|
|
б |
в |
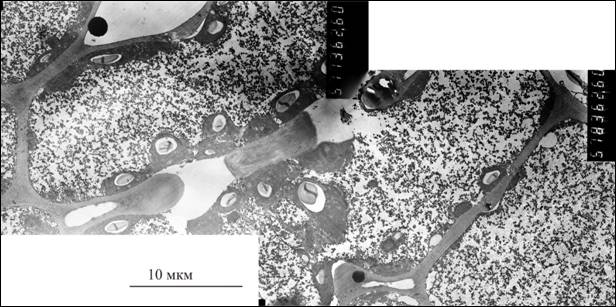
Рисунок 1. а - ультраструктура клеток мезофилла на примере стланика;
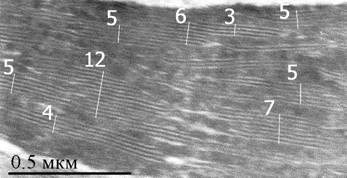
б – фрагмент хлоропласта гибрида, цифрами указано количество тилакоидов в гране;
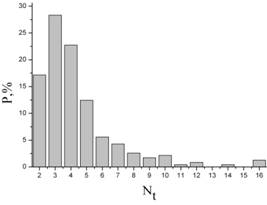
в – распределение гран по числу тилакоидов у видов и гибридов.
Наблюдения тонкого строения клеток мезофилла как у видов, так и у гибридов показало единообразие их организации, типичное строение клетки приведено на рис 1а.
Был проведен анализ 90 хлоропластов и более 235-ти гран. Различий между гибридами и родительскими видами не выявлено. Хлоропласты содержали большое количество одиночных тилакоидов. Граны в основном узкие (рис. 2б), 80 % из которых состояли из 2—5 тилакоидов, 15 % имели 6—9 тилакоидов и очень редко попадались граны с числом тилакоидов более 10 (рис. 1в). Площадь среза хлоропласта составляла в среднем 25 ± 10 мкм2.
Хлоропласты видов и гибридов не имеют принципиальных отличий в строении и относятся преимущественно к «световому» типу [9]. Сходство в строении хлоропластов у видов и гибридов говорит о том, что интенсивность фотосинтеза у них должна быть примерно одинаковой. Кроме того, это подтверждается тем, что хлоропласты содержали довольно крупные крахмальные зерна. Площадь среза крахмального включения составляла 8 ± 4 мкм2. Объёмная доля крахмальных зёрен у видов и гибридов различалась незначительно и составляла в среднем около 30 % объёма хлоропласта.
Для измерения средней площади среза митохондрий было использовано в общей сложности 90 митохондрий. Площадь среза митохондрий у видов существенно отличается: для кедра сибирского она составляла 0,25 ± 0,05 мкм2, а для кедрового стланика – 0,6±0,1 мкм2. Гибриды по данному признаку проявили большую вариабельность, один из них был близок к кедровому стланику, а два других к кедру сибирскому. Известно, что у сосен митохондриальная ДНК наследуется по материнской линии [10], что дает нам основание предположить реципрокный характер исследуемых гибридов. Однако для подтверждения этого, в дальнейшем, необходимо провести соответствующий генетический анализ.
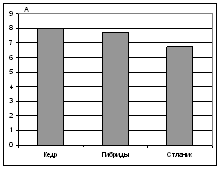
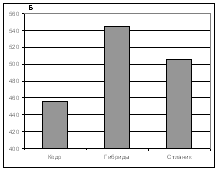
Физиологическое состояние исследуемых деревьев оценивали, определяя интенсивность фотосинтеза и транспирации, а также содержание пигментов. Интенсивность фотосинтеза кедра сибирского была незначительно выше, чем у кедрового стланика и примерно такой же, как у гибридов (рис. 2). Однако интенсивность транспирации у кедра была минимальной, т. е. данный вид характеризовался наиболее эффективным использованием воды. Чтобы подтвердить это, необходимо провести дальнейшие исследования, т. к. из-за высокой вариабельности данного признака, отличия были незначимы.
|
|
|
Рисунок 2. а – интенсивность фотосинтеза, мг СО2/ г сухой хвои ´ час;
б – интенсивность транспирации, мг H2O/ г сухой хвои ´ час.
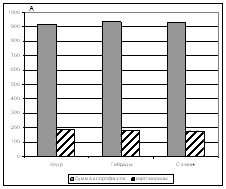
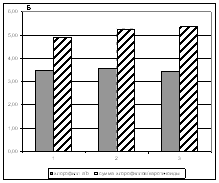
Пигментный фонд хвои является важным для характеристики фотосинтеза, т. к. именно он выполняет функции поглощения и трансформации солнечной энергии. Исследуемые виды и гибриды характеризовались близкими значениями концентрации зеленых и желтых пигментов, а также почти одинаковым отношением хлорофилла а к хлорофиллу b (рис. 3). У кедра сибирского наблюдалось незначительное снижение отношения суммы хлорофиллов к каротиноидам по сравнению с кедровым стлаником и гибридами. Схожие характеристика пигментного пула хвои связаны с тем, что исследуемые деревья находились в одинаковых экологических условиях и были одного возраста. Именно эти два параметра в значительной степени определяют различия в содержании пигментов.
|
|
|
Рисунок 3. а – Содержание пигментов (мкг/г сырой массы) в хвое видов и гибридов.
б – отношение хлорофилла а к хлорофиллу b и отношение суммы хлорофиллов к каротиноидам.
Заключение
В данной работе впервые получена характеристика ультраструктуры клеток гибридов между кедром сибирским и кедровым стлаником. В тонком строении клетки у видов и гибридов проявляется большее сходство, чем на уровне строения хвои и общего габитуса дерева.
Благодарности
Работа выполнена при частичной поддержке гранта на молодёжные интеграционные проекты среди институтов ТНЦ СО РАН. Авторы выражают благодарность Миллеру А. А. за помощь при подготовке образцов для просвечивающей электронной микроскопии.
Список литературы
1. Бендер О. Г., Горошкевич С. Н. Анатомическая и морфологическая изменчивость хвои гибридов Pinus sibirica и P. pumila (дельта Верхней Ангары) // Труды Томского государственного университета. Серия биологическая. – 2010. – Т. 274. – С. 89—91.
2. Горошкевич С. Н. О возможности естественной гибридизации Pinus sibirica и Pinus pumila (Pinaceae) в Прибайкалье // Бот. журн. – 1999. – Т. 84, № 9. – С. 48–57.
3. Горошкевич С. Н., Васильева Г. В., Попов А. Г. О гибридизации кедра сибирского и кедрового стланика в западной части Станового нагорья // Лесное хозяйство. – 2008. – № 6. – С. 25–27.
4. Гроссет Г. Э. Кедровый стланик. Материалы к изучению и хозяйственному использованию. – М.: Б.м.и., 1959. – 143 с.
5. Крылов Г. В., Таланцев Н. К., Козакова Н. Ф. Кедр. – М.: Лесн. Пром-сть, 1983, – 216 с.
6. Малышев Л. И. Применение анатомического метода для целей определения сосен и выявления их филогении // Тр. вост.—сиб. фил. АН СССР. Сер. биол. Вып. 7. Ботаника. – Благовещенск, 1958. – С. 107–127.
7. Нестерович Н. Д., Дерюгина Т. Ф., Лучков А. И. Структурные особенности листьев хвойных. – Минск: Наука и техника, 1986 – 95 с.
8. Шлык А. А. О спектрофотометрическом определении хлорофиллов a и b // Биохимия. 1968. Т. 33. С. 275—285.
9. Lichtenhaler H. K., Wellburn A. R. Determination of Total Carotenoids and Chlorophylls a and b of Leaf Extracts in Different Solvents // Biochem. Soc. Trans. 1983. V 11. P. 591—592
10. Neale D., Sederoff R. Paternal inheritance of chloroplast DNA and maternal inheritance of mitochondrial DNA in loblolly pine // Theor. Appl. Genet. – 1989. – V. 77. – P. 212–216.
11. Reynolds E. S., The use of lead citrate at high pH as an electronopaque stain in electron microscopy // J. Cell Biology. – 1963. – № 17. – P. 208—212.
12. Rieseberg L. H. Hybrid origins of plant species // Ann. rev. ecol. syst. – 1997. – V. 28. –P. 359–389.
13. Undeen A. H., Vavra J. I. 1997. Research methods for entomopathogenic Protozoa. In: Lacey LA ed. Manual of techniques in insect pathology. San Diego, Academic Press, 117—151.
дипломов

Оставить комментарий