Статья опубликована в рамках: V Международной научно-практической конференции «Научные достижения биологии, химии, физики» (Россия, г. Новосибирск, 06 марта 2012 г.)
Наука: Биология
Секция: Микробиология и вирусология
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
ЛИПОГЕНЕЗ НЕФТЬ ДЕГРАДИРУЮЩЕГО МИКРОСКОПИЧЕСКОГО ГРИБА CEPHALOSPORIUMHUMICOLA
Ямен Юсиф кызы Атакишиева
канд. биол. наук, доцент, Институт Микробиологии НАНА, г. Баку, Азербайджан
Мехти Байрамоглы Касеми
диссертант, Институт Микробиологии НАНА, г. Баку, Азербайджан
Липиды занимают очень важное место в обмене грибов, это можно видеть из данных по их общему количеству, которое, с одной стороны, может достигать больших величин от сухой массы, а с другой — может сильно колебаться в зависимости от внешних условий и возраста культуры [4, 5]. Особенно большие количества липидов находили у ряда мукоровых грибов, дерматофитов и некоторых рас дрожжей. Значительное изменение количества липидов в микроорганизмах указывает на активное участие липидов в обмене веществ, сопровождающееся либо их синтезом, либо распадом.
Микроскопические грибы пока не получили большого распространения в получении липидов, хотя по своему составу близки к растительному жиру. На сдвиг биосинтеза в сторону образования липидов или белка влияет соотношение углерода и азота в среде. Так, повышение концентрации азота вызывает снижение липидообразования, а недостаток азота при обеспеченности углеродом ведет к понижению выхода белковых веществ и высокому процентному содержанию жира. Нефтепродукты как среда обитания грибов характеризуются рядом особенностей: содержат большое количество сравнительно доступного углерода и минимальное – азота при почти недоступном пространственном расположении его в молекуле.
Ранее нами был проведен скрининг углеводород деградирующих грибов, синтезирующих значительное количество липидов [1]. Цель настоящей работы − дать характеристику липидным соединениям штамма CephalosporiumhumicolaIEдеградирующего нефть, изучить качественный и количественный состав нейтральных и полярных липидов.
Материалы и методы исследования
Объектом исследования служил штамм микроскопического гриба C. humicola IE. Выращивание культур проводили методом глубинного культивирования на качалке со скоростью вращения 220 об/мин, при температуре 27—28°С, используя жидкие питательные среды. Липиды из влажного мицелия экстрагировали методом Фолча в модификации Блайя и Дайэра [2, 3]. Отделение полярных липидов от нейтральных осуществляли методом осаждения холодным ацетоном. Разделение нейтральных липидов на отдельные составляющие компоненты проводилось методом тонкослойной хроматографии, которую осуществляли на пластинах "Силуфол" в системе гексан : диэтиловых эфир : этанол=70:30:1.
Качественный и количественный состав жирных кислот изучали методом газожидкостной хроматографии на хроматографе «Хром-5» c пламенно-ионизационным детектором, используя колонку длиной 2,8 м, заполненную хроматином N-AW-HMDS (0,16—0,20 мм) с 15 % полиэтиленгликольсукцинатом в качестве жидкой фазы, температура колонки - 180°С, испарителя - 210°С. В качестве газа носителя использовали гелий (30 мл/мин).
Результаты и обсуждение
Показатели роста и липогенеза исследованного гриба на среде с глюкозой и сырой нефтью представлены рис. 1.Полученные результаты показывают, что нефть значительно влияет как на выход биомассы, так и на содержание в ней липидов. Из рисунка видно, чтоC. humicolaIEна сырой нефти растетмедленнееив процессе роста биомасса гриба не достигает уровня, отмеченного при росте на глюкозе. При этом максимальное значение биомассы на сырой нефти составляло около 54,0 % по сравнению с контролем на глюкозе. На средах с нефтью культуры развивались, накапливая биомассу в количестве 8,0 г/л, а липидов до 68,0 % от сухой биомассы. Из полученных данных по динамике накопления биомассы и липидов во времени видно, что кривая накопления биомассы на глюкозе имеет типичный для периодической культуры характер. Наибольшее количество липидов (18,0 %) исследуемая культура C. humicolaIEнакапливает в фазе линейного роста. В дальнейшем, во время фазы стационарного роста, суммарное содержание липидов практически не изменяется и начинает плавно снижаться на четвертые сутки.
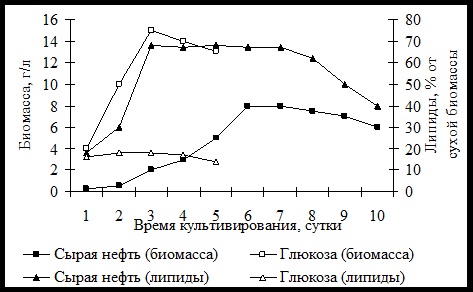
Рис. 1. Рост и образование липидов в культурах гриба C. humicolaIE
Мицелий гриба в первую половину фазы активного роста характеризуется низким содержанием липидов. Далее происходит переключение метаболизма на интенсивное образование липидов, и к началу стационарной фазы, количество липидов в мицелии достигает максимального в этих условиях значения. Соотношение между процессами роста и образования липидов на углеводородном субстрате носит иной характер. Накопление липидов в мицелии начинается в начале активного роста и ускоряется в процессе дальнейшего развития культур. Максимальное количество липидов отмечается на пятые-шестые сутки, после чего наступает медленный автолиз биомассы. Таким образом, максимальное количество липидов в мицелии грибов при росте на глюкозе значительно ниже, чем на нефти. При разделении общих липидов на фракции полярных и нейтральных методом осаждения холодным ацетоном у глюкозных вариантов количественно преобладала фракция нейтральных липидов (78,0 %) (табл. 1). В биомассе, выросшей на среде с нефтью отмечено повышенное содержание полярных липидов. На среде с глюкозой основную фракцию липидов составляют триацилглицерины (52,0 %). На среде, где в качестве источника углерода была сырая нефть, интенсивность синтеза триацилглицеринов была низкой и уровень их содержания составлял всего лишь 15,0 % от суммы липидов. Использование нефти приводило к уменьшению содержания диацилглицеринов и увеличению эфиров стеринов+углеводородов в липидах.
Таблица 1.
Влияние источника углерода на состав липидовC. humicolaIE
|
Фракции |
Субстрат |
|
|
Глюкоза |
Сырая нефть |
|
|
Полярные липиды Стерины Свободные жирные кислоты Триацилглицерины Диацилглицерины Моноацилглицерины Углеводороды и эфиры стеринов Неидентифицированная фракция |
22,0±0,85 0,5±0,02 2,0±0,1 52,0±2,6 4,0±0,2 1,5±0,07 5,0±0,25 13,0±0,5 |
57,0±2,3 1,0±0,04 0,6±0,03 15,0±0,52 2,0±0,08 0,3±0,01 15,0±0,7 9,1±0,4 |
В последующих экспериментах нами проведено сравнительное исследование жирнокислотного состава общих липидов C. humicolaIE(рис. 2). Нами установлено, что жирнокислотные радикалы, в частности радикалы эйкозаполиеновых кислот, неравномерно распределены среди индивидуальных классов липидов изученного гриба, что свидетельствует об избирательности включения жирных кислот в разные классы липидов (данные не представлены).
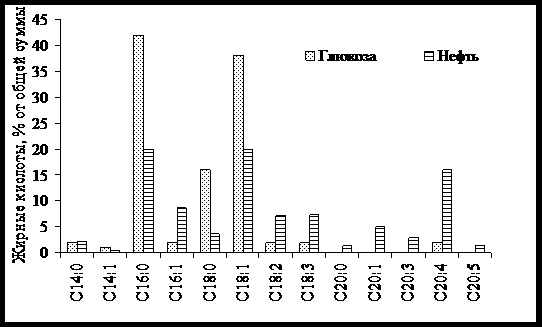
Рис. 2.Жирнокислотный состав липидов C. humicolaIE, культивируемого на средах с глюкозой и сырой нефтью.
Результаты, представленные на рис. 2, показывают, что жирнокислотный состав липидов мицелия, культивируемого на сырой нефти значительно отличается от такового, синтезируемого на среде с глюкозой. В липидах обнаруживается большое число кислот, которые отсутствовали при выращивании гриба на глюкозе. Эйкозаполиеновые кислоты (С20) в значительных количествах обнаружены при росте на сырой нефти.
На среде с нефтью в составе липидов значительно уменьшаются пальмитиновая (С16:0, в 2 раза), стеариновая (С18:0, в 4,5 раза) и олеиновая (С18:1, в 1,9 раза), кислоты, увеличиваются пальмитолеиновая (С16:1, в 4,3 раза), линолевая (С18:2, в 3,6 раза) и γ-линоленовая (С18:3, в 3,6 раза) кислоты, по сравнению с контролем.
Следует отметить, что возрастание общего уровня суммарных липидов у C. humicolaIEпри росте на сырой нефти происходит за счет накопления ненасыщенных жирных кислот и уменьшения доли насыщенных.
Список литературы:
- Атакишиева Я. Ю. Изучение липидообразованиягрибов разлагающих углеводороды //Сумгаитский Государственный Университет, Научные Известия. – 2006. - № 1. - С. 53—57.
- Bligh E. G. and Dyer W. J. A rapid method of total lipid extraction and purification // Can. J. Biochem. Physiol. - 1959. - № 37. – P. 911—917.
- Folch J., Lees M., Sloane-Stanley G. H. A simple method for the isolation and purification of total lipids from animal tissues // J. Biol. Chem. - 1957. - V. 226. - P. 497—590.
- Laoteng K., M. Certíkand S. Cheevadhanark. Mechanisms controlling lipid accumulation and polyunsaturated fatty acid synthesis in oleaginous fungi// Chemistry and Materials Science. - 2011. - V. 65. - P. 97—103.
- Ratledge C. Regulation of lipid accumulation in oleaginous microorganisms// Biochem. Soc. Trans. - 2002. – Pt 6. - P. 1047—1050.
дипломов

Оставить комментарий