Статья опубликована в рамках: IX Международной научно-практической конференции «Научные достижения биологии, химии, физики» (Россия, г. Новосибирск, 04 июля 2012 г.)
Наука: Химия
Секция: Неорганическая химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
АПРИОРНОЕ ПРОГНОЗИРОВАНИЕ И ФАЗОВЫЙ КОМПЛЕКС ЧЕТЫРЕХКОМПОНЕНТНОЙ СИСТЕМЫ LiNO3-NaNO3-NaCI-KNO3
Расулов Абутдин Исамутдинович
канд. хим. наук, доцент кафедры химии ДГПУ, г. Махачкала.
Е-mail: abutdin.rasulov@mail.ru
Мамедова Аида Кафлановна
канд. хим. наук, ассистент, ДГПУ, г. Махачкала
Настоящая работа является продолжением цикла исследований солевых систем являющихся стабильными комплексами пятерной взаимной системы Li,K,Na,Sr//CI,NO3, по выявлению теплоаккумулирующих материалов [1—4].
Для прогнозирования нонвариантных точек и построения древа кристаллизации системы LiNO3-NaNO3-NaCl-КNO3 нами также был применен метод априорного прогноза [5].
Обзор и анализ ограняющих элементов исследуемой системы показывает, что физико-химические взаимодействия и диаграммы состояния данной системы характеризуются наличием эвтектических и перитектических фазовых равновесий, обусловленных образованием инконгруэнтно плавящихся бинарных соединений: LiNO3-NaCl; NaCl-КNO3; LiNO3-КNO3. Диаграмма составов четырехкомпонентной системы LiNO3-NaNO3-NaCl-КNO3 показывает (рис. 1), что ее ликвидус состоит из семи политермических объемов первичной кристаллизации, из которых четыре принадлежать исходным компонентам: LiNO3→р1Р2Р3р2Е5Р6е8Е9Е10; NaNO3→е7Е9е8Р6н.р.т.р(min)Е8; NaCl→е7Е8Р7р3Р4Е2Р3Р2е2Е10Е9; КNO3→е5Р4 Е2е4Е5Р6н.р.т.р(min)Р7; и три бинарным соединениям LiNO3-NaCl→е2Р2р1Е10; NaCl-КNO3→р3Р4е5Р7; LiNO3-КNO3→ р2Е5е4Е2Р3
Физико-химические взаимодействия в данной системе привели к образованию следующих поверхностей совместной кристаллизации двух фаз: н.р.т.р(min)Р6Е8 (КNO3+NaNO3), е8Е9Р6 (LiNO3+NaNO3), е4Е2Е5 (LiNO3∙КNO3+КNO3), е5Р4Р7 (NaCl∙КNO3+КNO3), е7Е8Е9 (NaCl+NaNO3), е2Р2Е10 (NaCl∙LiNO3+NaCl).
Из данного метода вытекает, что эти объемы должны замыкаться четырьмя четверными нонвариантными точками. После качественного определения фазового комплекса, образующие нонвариантные точки построено схема древо фаз (рис. 2), которое позволяет предположить, что в системе реализуется четыре НВТ, две из которых эвтектического характера плавления.
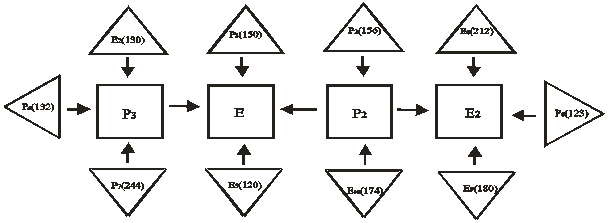
Рис. 2. Схема древо фаз четырехкомпонентной системы
LiNO3-NaNO3-NaCl-КNO3
Для подтверждения априорного прогноза и построения топологической модели фазовой диаграммы проведен ее термический анализ. В соответствии с правилами проекционно-термографического метода (ПТГМ) в тетраэдрической диаграмме (рис.1), изображающей ее состав, первоначально выбрано двухмерное политермическое сечение АВС, вершинам которого соответствуют составы: А-40 % NaCl+60 %KNO3; В-40 % NaCl+60 %NaNO3; С-40 % NaCl+60 % LiNO3. Плоскость сечения АВС расположена в объеме кристаллизации хлорида натрия, занимающего наибольший объем кристаллизации. Из вершины хлорида натрия на стороны сечения АВС нанесены точки Е10, Е9, Е8, Е2, Р2, Р3, Р4, и Р7 являющиеся центральными проекциями соответствующих точек тройных эвтектических и перетектических равновесий.
Данное сечение рассматривалось как псевдотрехкомпонентная система и в ней для экспериментального исследования был выбран одномерный политермический разрез ЕD (E-40 % NaCl+32 % NaNO3+28 % КNO3; D-40 % NaCl+32 % NaNO3+28 % LiNO3). Последовательно изучая методом ДТА составы, расположенные на этом разрезе, была найдена точка ε2═ (рис. 3) являющаяся вторичной проекцией НВТ системы.
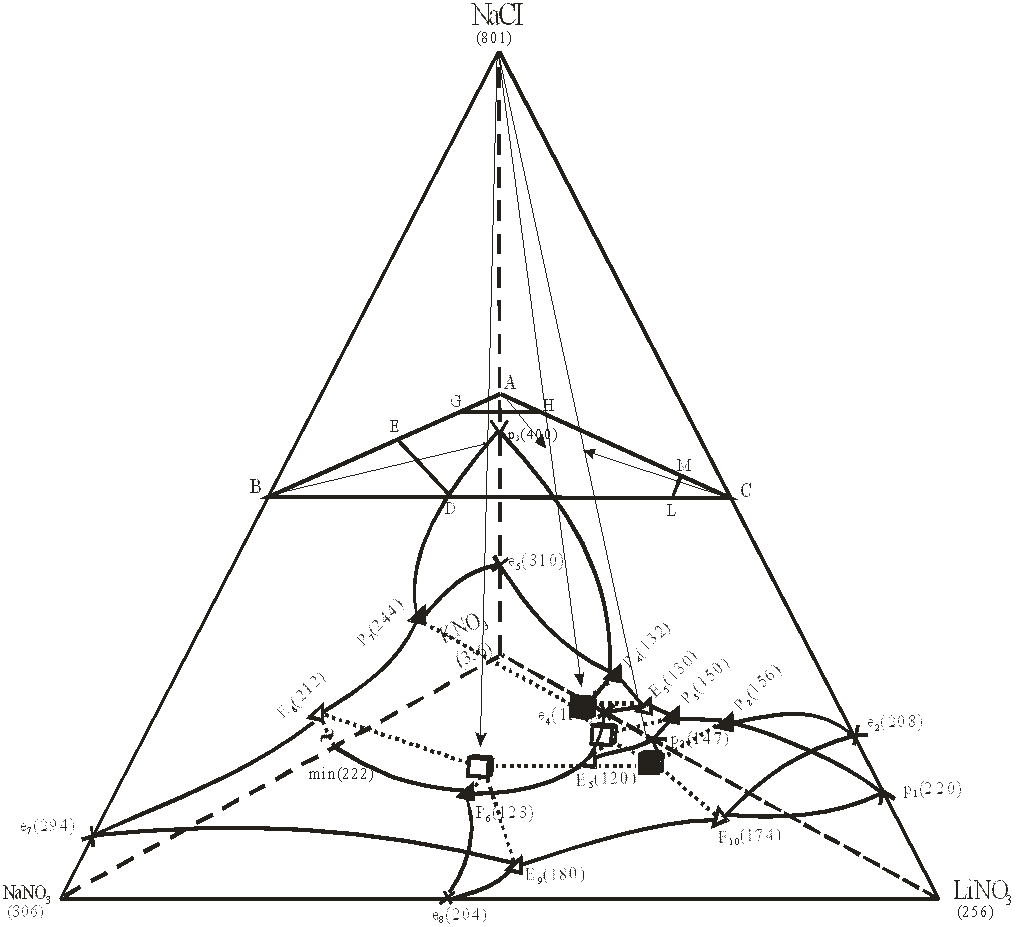
Рис. 1. Диаграмма составов четырехкомпонентной системы LiNO3-NaNO3-NaCl-КNO3 и расположение в ней политермического сечения АВС.
Первоначально из жидкой фазы кристаллизуется хлорид натрия, в объеме которого расположено сечение ED, вторично хлорид натрия и нитрат натрия. Ветви третичной кристаллизации пересекаются в точке ε2═ на горизонтальной линии, проходящей при температуре четырехкомпонентной эвтектики. Изучением ДТА лучевого разреза В→ε2═→ε2‾‾выявлена точка ε‾‾, которая является первичной проекцией четверной эвтектики. Для состава ε‾‾, на диаграммах состояния лучевых разрезов В→ε2═→ε2‾‾ вслед за первичной кристаллизацией хлорида натрия наступает нонвариантный процесс, показывающий соотношение KNO3, LiNO3 и NaNO3 в эвтектике.
Определение составов четырехкомпонентной эвтектики сводилось к постепенному уменьшению концентрации хлорида натрия, без изменения соотношения остальных компонентов, по лучевым разрезам NaCl→ε2‾‾→ε2, опущенного из вершины NaCl через точку ε‾‾ до наступления нонвариантного процесса. Характеристики НВТ приведены в таблице 1.

Рис. 3. Диаграмма состояния политермического разреза ED системы
LiNO3-NaNO3-NaCl-KNO3
Выявленная солевая композиция эвтектического характера плавления, является перспективным материалом для среднетемпературного аккумулирования тепла [6].
Таблица 1.
Характеристики НВТ системы LiNO3-NaNO3-NaCl-КNO3
|
Обозначение |
t,0C |
Состав, мол.% |
|||
|
LiNO3 |
NaNO3 |
NaCl |
KNO3 |
||
|
ε2 |
112 |
32 |
23 |
2 |
43 |
Список литературы:
1.Гасаналиев А.М., Гаматаева Б.Ю., Расулов А.И., Умарова Ю.А., Мамедова А.К. Фазовый комплекс четырехкомпонентной системы LiCl–NaCl–SrCl2–Sr(NO3)2 и физико-химические свойства эвтектической смеси// ЖНХ., 2009. Т. 54. С. 1565—1572.
2.Гаматаева Б.Ю., Расулов А.И., Умарова Ю.А., Гасаналиев Э.А., Гасаналиев А.М.. Фазовый комплекс системы LiNO3–KCI–Sr(NO3)2 и физико-химические свойства ее эвтектической смеси.- Расплавы, 2006. № 6. С. 61—69.
3.Гасаналиев А.М., Гаматаева Б.Ю., Расулов А.И., Мамедова А.К. Фазовый комплекс четырехкомпонентной системы LiCl–NaCl–KCl-SrCl2 и физико-химические свойства эвтектической смеси// Журнал химия и химическая технология. 2010. Т. 53. вып. 9. С. 32—36.
4.Гасаналиев А.М., Гаматаева Б.Ю., Умарова Ю.А.. Диаграмма состояния системы LiNO3-NaCI-KCI-Sr(NO3)2.- Расплавы, 2003. № 6. С. 75—95.
5.Кочкаров Ж.А. Топология многокомпонентных гетерофазных систем из молибдатов, вольфраматов и других солей щелочных металлов. Дисс... д.х.н. Нальчик: КБГУ. 2001. -305 с.
6.Мамедова А.К. Фазовый комплекс и физико-химические свойства системы LiNO3-NaNO3-NaCl-KNO3-Sr(NO3)2. Дисс… канд. хим. наук. Махачкала. ДГПУ. 2012. 152 с.
дипломов

Оставить комментарий