Статья опубликована в рамках: IV Международной научно-практической конференции «Научные достижения биологии, химии, физики» (Россия, г. Новосибирск, 01 февраля 2012 г.)
Наука: Химия
Секция: Органическая химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
ОДНОРЕАКТОРНАЯ КОНДЕНСАЦИЯ ПИНАКОЛИНА С ДИАЛКИЛОКСАЛАТАМИ И ЦИАНАЦЕТАМИДОМ
Виноградов Алексей Николаевич
аспирант, ОГУ, г. Оренбург
E-mail: asd10xcv12@yandex.ru
Ахременкова Ольга Евгеньевна
студент, ОГУ, г. Оренбург
Козьминых Владислав Олегович
д-р хим. наук, профессор ОГУ, г. Оренбург
В литературе имеются сведения о реакционной способности ацилпируватов в отношении N-, O-, и отчасти, S-нуклеофильных реагентов [1, с. 1039—1058; 3, с. 1-55; 4, с. 1—9;]. Публикации, в которых С-мононуклеофилы рассматриваются как партнеры по реакции с ацилпировиноградными кислотами и их производными, единичны [2, с. 6244—6249; 3, с. 1—55]. Оксалильные конденсации метилкетонов в присутствии С-мононуклеофильных партнеров по реакции – однореакторные и тандемные превращения – до наших исследований не изучались.
В результате трехкомпонентной однореакторной конденсации пинаколина с диалкилоксалатами и цианацетамидом получены эфиры 6-трет-бутил-3-циано-2-пиридон-4-карбоновой кислоты (1а-е).
Схема 1. Синтез эфиров 6-трет-бутил-3-циано-2-пиридон-4-карбоновой кислоты

Полученные соединения представляют собой белые, или светло-желтые кристаллические вещества, хорошо растворимые в большинстве органических растворителей и практически не растворимые в воде.
Таблица 1. Физико-химические свойства эфиров 6-трет-бутил-3-циано-2-пиридон-4-карбоновой кислоты
|
Шифр |
Alk |
Т. пл., °С |
Брутто-формула (М) |
Выход, % |
|
||||
1а |
Me |
115-117 |
С12Н14N2O3 (234,25) |
62 |
1b |
Et |
108-110 |
С13Н16N2O3 (248,28) |
65 |
1c |
n-Pr |
105-106 |
С14Н18N2O3 (262,30) |
58 |
1d |
i-Pr |
112-114 |
С14Н18N2O3 (262,30) |
63 |
1е |
n-Bu |
102-104 |
С15Н20N2O3 (276,33) |
55 |
Строение полученных соединений установлено на основании данных ИК, ЯМР 1Н спектроскопии и масс-спектрометрии. Анализ спектральных данных свидетельствует в пользу предложенной структуры, а также наличия в растворе прототропной таутомерии типа гидроксипиридин – пиридон.
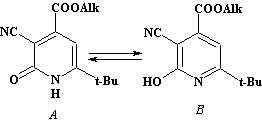
В ИК спектрах соединений 1а-е присутствуют широкая полоса поглощения в области 3250—3253 см-1, относящаяся к валентным колебаниям связи N-H. Интенсивная полоса поглощения валентных колебаний карбонильной группы при 1661 см-1 (полоса «Амид I» для вторичных амидов) свидетельствует о наличии пиридоновой формы (форма А). В спектрах присутствуют полосы поглощения, относящиеся к валентным колебаниям карбонильной группы в составе сложноэфирного фрагмента в области 1725—1730 см-1 и колебаниям нитрильной группы в области 2223—2224 см-1. Смещение обеих полос в более низкочастотную область свидетельствует о сопряжении с гетероциклической системой.
В ЯМР 1Н спектрах соединений 1а-е, записанных в растворе дейтерохлороформа, наряду с сигналами основных протоносодержащих групп присутствуют сигналы гидроксильной группы минорной оксипиридиновой формы (форма В) при 5,15-5,16 м.д. и протона группы NH пиридоновой формы (форма А) при 12,92-13,02 м.д.
Основным направлением масс-фрагментации ионизированной молекулы изо-пропилового эфира 6-трет-бутил-3-циано-2-пиридон-4-карбоновой кислоты (1d) является элиминирование СН2=СН–СН3 в результате перегруппировки Мак-Лафферти, о чем свидетельствует присутствие в масс-спектре интенсивного пика [М – 42]+.
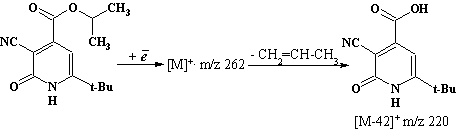
Синтез эфиров 6-трет-бутил-3-циано-2-пиридон-4-карбоновой кислоты (1a-е). Смесь 2,50 г (3,13 мл) пинаколина (25 ммоль), соответствующего диалкилоксалата (25 ммоль) и 0,58 г натрия (25 ммоль) в 50 мл абсолютного толуола выдерживают на холоду в течении 3—4 часов. Избыток растворителя отгоняют, к остатку прибавляют 2,10 г цианацетамида (25 ммоль) и нагревают 15—20 мин в 50 мл этанола. К охлажденному раствору прибавляют 5 мл 15 % соляной кислоты, осадок отфильтровывают и сушат на воздухе. Перекристаллизованные из 50 % этанола вещества представляют собой белые или светло-желтые кристаллы.
Метиловый эфир 6-трет-бутил-3-циано-2-пиридон-4-карбоновой кислоты (1а). Выход: 3,63 г (62 %), т. пл. 115—117°C. ИК спектр, n, см-1: 3252 (νNH), 2223 (νC≡N), 1727 (νС=О, сл. эф.), 1661 (νC=О, «Амид I»), 1640, 1590 (νC=C), 1542, 1380, 1311 (δN-H + δC-N), 1237, 1202, 1180 (νС-О-С, «эфирная полоса»), 1096, 1034, 1016 (δСH плоск), 962, 934, 913, 889 (δСH неплоск). Спектр ЯМР 1H, d, м.д., CDCl3: 1.02 (c, 9H, t-Bu, форма А), 1.20 (c, 9H, t-Bu, В), 3.90 (c, 3H, OCH3, А), 4.01 (c, 3H, OCH3, В), 5.15 (уш. с, 1H, ОH, В), 6.07 (c, 1H, СН, А, 80 %), 6.76 (c, 1H, СН, В, 20 %), 12.92 (уш. с, 1H, NH, А).
Этиловый эфир 6-трет-бутил-3-циано-2-пиридон-4-карбоновой кислоты (1b). Выход: 4,03 г (65 %), т. пл. 108—110°C. ИК спектр, n, см-1: 3253 (νNH), 2224 (νC≡N), 1729 (νС=О, сл. эф.), 1661 (νC=О, «Амид I»), 1640, 1590 (νC=C), 1542, 1380, 1311 (δN-H + δC-N), 1238, 1202, 1179 (νС-О-С, «эфирная полоса»), 1096, 1034, 1016 (δСH плоск), 962, 934, 913, 889 (δСH неплоск). Спектр ЯМР 1H, d, м.д., J, Гц, CDCl3: 1.02 (c, 9H, t-Bu, А), 1.20 (c, 9H, t-Bu, В), 1.23 (т, 3H, OCH2CH3, J=7.2, А), 1.34 (т, 3H, OCH2CH3, J=7.2, В), 4.13 (к, 2H, OCH2CH3, J=7.2, А), 4.32 (к, 2H, OCH2CH3, J=7.2, В), 5.15 (уш. с, 1H, ОH, В), 6.07 (c, 1H, СН, А, 75 %), 6.76 (c, 1H, СН, В, 25 %), 12.92 (уш. с, 1H, NH, А).
н-Пропиловый эфир 6-трет-бутил-3-циано-2-пиридон-4-карбоновой кислоты (1c). Выход: 3,80 г (58 %), т. пл. 105—106°C. ИК спектр, n, см-1: 3250 (νNH), 2223 (νC≡N), 1730 (νС=О, сл. эф.), 1661 (νC=О, «Амид I»), 1640, 1590 (νC=C), 1542, 1380, 1311 (δN-H + δC-N), 1238, 1200, 1181 (νС-О-С, «эфирная полоса»), 1096, 1034, 1016 (δСH плоск), 962, 934, 913, 889 (δСH неплоск). Спектр ЯМР 1H, d, м.д., J, Гц, CDCl3: 0.89 (т, 3H, OCH2CH2CH3, J=7.2, А), 0.93 (т, 3H, OCH2CH2CH3, J=7.2, В), 1.02 (c, 9H, t-Bu, А), 1.18 (c, 9H, t-Bu, В), 1.58-1.77 (м, 2H, OCH2CH2CH3, А+В), 4.21 (т, 2H, OCH2CH2CH3, J=7.2, А), 4.24 (т, 2H, OCH2CH2CH3, J=7.2, В), 5.16 (уш. с, 1H, ОH, В), 6.08 (c, 1H, СН, А, 77 %), 6.71 (c, 1H, СН, В, 23 %), 12.96 (уш. с, 1H, NH, А).
изо-Пропиловый эфир 6-трет-бутил-3-циано-2-пиридон-4-карбоновой кислоты (1d). Выход: 4,13 г (63 %), т. пл. 112—114°C. ИК спектр, n, см-1: 3252 (νNH), 2224 (νC≡N), 1725 (νС=О, сл. эф.), 1661 (νC=О, «Амид I»), 1640, 1590 (νC=C), 1542, 1380, 1311 (δN-H + δC-N), 1239, 1201, 1180 (νС-О-С, «эфирная полоса»), 1096, 1034, 1016 (δСH плоск), 962, 934, 913, 889 (δСH неплоск). Спектр ЯМР 1H, d, м.д., J, Гц, CDCl3: 1.02 (c, 9H, t-Bu, А), 1.23 (c, 9H, t-Bu, В), 1.25 (д, 6H, OCH(CH3)2, J=6.3, А), 1.29 (д, 6H, OCH(CH3)2, J=6.3, В), 5.23-5.36 (м, 1H, OCH(CH3)2, А), 5.40-5.52 (м, 1H, OCH(CH3)2, В), 5.16 (уш. с, 1H, ОH, В), 6.08 (c, 1H, СН, А, 78 %), 6.71 (c, 1H, СН, В, 22 %), 12.98 (уш. с, 1H, NH, А).
н-Бутиловый эфир 6-трет-бутил-3-циано-2-пиридон-4-карбоновой кислоты (1e). Выход: 3,80 г (55 %), т. пл. 102—104°C. ИК спектр, n, см-1: 3251 (νNH), 2223 (νC≡N), 1730 (νС=О, сл. эф.), 1661 (νC=О, «Амид I»), 1640, 1590 (νC=C), 1542, 1380, 1311 (δN-H + δC-N), 1238, 1202, 1179 (νС-О-С, «эфирная полоса»), 1096, 1034, 1016 (δСH плоск), 962, 934, 913, 889 (δСH неплоск). Спектр ЯМР 1H, d, м.д., J, Гц, CDCl3: 0.90 (т, 3H, O(CH2)3CH3, J=7.2, А), 0.97 (т, 3H, OCH2CH2CH3, J=7.2, В), 1.01 (c, 9H, t-Bu, А), 1.16 (c, 9H, t-Bu, В), 1.10-1.36 (м, 2H, OCH2CH2CH2CH3, А+В), 1.54-1.78 (м, 2H, OCH2CH2CH2CH3, А+В), 4.03 (т, 2H, OCH2(CH2)2CH3, J=7.2, А), 4.23 (т, 2H, OCH2(CH2)2CH3, J=7.2, В), 5.15 (уш. с, 1H, ОH, В), 6.09 (c, 1H, СН, А, 81 %), 6.77 (c, 1H, СН, В, 19 %), 13.02 (уш. с, 1H, NH, А).
Список литературы:
1. Перевалов С. Г., Бургарт Я. В., Салоутин В. И., Чупахин О. Н. (Гет)ароилпировиноградные кислоты и их производные как перспективные «строительные блоки» для органического синтеза // Успехи химии. — 2001. — Т. 70.-Вып. 11. — С. 1039—1058.
2. Blackwood R. K., Hess G. B., Larrabee C. E., Pilgrim F. J. Hydride reductions of pyridinedicarboxylic acids // Heterocycles. — 1958. — Vol. 80. — P. 6244—6249.
3. Dawood K. M., Abdel-Gawad H., Mohamed H. A., Abdel-Wahab B. F. Utility of 2,4-dioxoesters in the synthesis of new heterocycles // Heterocycles. — 2010. — Vol. 81. — No. 1. — P. 1—55.
4. Nolsöe J. M. J., Weigelt D. Benzoylpyruvates in Heterocyclic Chemistry // Journal of Heterocyclic Chemistry. — 2009. — Vol. 46. — P. 1—9.
дипломов

Оставить комментарий