Статья опубликована в рамках: III Международной научно-практической конференции «Научные достижения биологии, химии, физики» (Россия, г. Новосибирск, 27 декабря 2011 г.)
Наука: Химия
Секция: Физическая химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
НАУКА О ВЕШЕСТВЕ: ВЫХОД ИЗ КРИЗИСА
Потапов Алексей Алексеевич
д-р хим. наук., профессор, г. н. с., ИДСТУ СО РАН, г. Иркутск
E-mail: aleksey.potapov.icc@gmail.com
История становления науки и техники может служить демонстрацией того факта, что развитие цивилизации в конечном итоге определяется уровнем знаний о строении вещества и законов его структурообразования. По сути, вещество выступает в качестве движущего потенциала цивилизации [7].
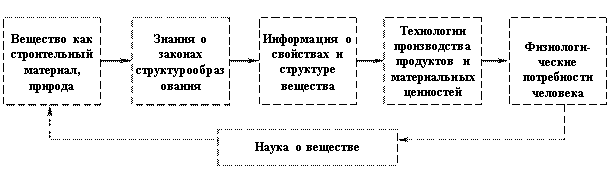
Приведенная выше схема дает наглядное представление о причинах возникновения науки о веществе как инструмента технологического постижения вещества с целью удовлетворения все увеличивающихся потребностей человека.
Наука о веществе возникла приблизительно в середине XVII века, когда точность весовых измерений была доведена до уровня, при котором стало возможным экспериментирование с относительно небольшими количествами вещества. Благодаря весовым измерениям удалось идентифицировать атомы как структурные единицы более сложных образований (молекул) и тем самым доказать атомистическое строение вещества. За относительно небольшой отрезок времени были открыты несколько десятков элементов. Начаты экспериментальные исследования свойств химических элементов на основании весовых, объемных, температурных, а затем и оптических измерений. На данном этапе работы велись преимущественно под влиянием идей Х. Лорентца и Д. Максвелла об электромагнитной природе вещества. Становление науки о веществе во многом связано с именем Д. И. Менделеева [9, 11].
Ключевым событием в истории науки о веществе стало открытие электрон-протон-нейтронного строения атомов (конец XIX века). Возникла необходимость в установлении электронного строения атомов. Было предложено ряд моделей, из которых наиболее значимой остается и по настоящее время планетарная модель Резерфорда-Бора (1913 г.). К сожалению, она не получила должного развития на своей начальной стадии становления и была отвергнута, уступив возникшему в 20-ых годах прошлого столетия квантово-волновому учению о веществе. Главным «достижением» данного учения стало утверждение о том, что наука подошла к той границе, за которой человеческое познание становится невозможным в принципе. В результате исследования вещества, направленные на понимание природы и механизмов его структурообразования, фактически были остановлены, а классическая наука о веществе, основанная на законах механики и электродинамики, фактически была законсервирована (и тем самым сохранена) в отдельных разделах физики и химии, которые по большей части стали выполнять функцию важных практических приложений для различных отраслей промышленности [10, 11].
Прошло почти 90 лет с момента провозглашения квантово-волновой парадигмы. Пришло осознание ограниченных возможностей квантовомеханического описания вещества. Назрела необходимость возврата к классической методологии. Признаки кризисного состояния учения о веществе стали очевидными. С одной стороны, старая доктрина продемонстрировала свою полнейшую несостоятельность, а с другой, – все в большей мере стали ощущаться непрерывно растущие потребности практики в создании действенной теории вещества. В этой связи появилась необходимость еще раз вернуться к анализу основ учения о веществе.
Ключевым вопросом здесь остается вопрос о статусе уравнения Шредингера для атома водорода, которое выступает фундаментом всего здания квантовой механики. Уравнение Шредингера описывает движение электрона е в центральном поле ядра, имеющего заряд еZ,
![]() , (1)
, (1)
где ![]() – масса электрона,
– масса электрона, ![]() – потенциальная энергия, определяемая законом Кулона
– потенциальная энергия, определяемая законом Кулона ![]() , где r – расстояние е электрона от ядра,
, где r – расстояние е электрона от ядра, ![]() – оператор Лапласа,
– оператор Лапласа, ![]() – волновая функция,
– волновая функция, ![]() – полная энергия системы,
– полная энергия системы, ![]() ,
, ![]() – постоянная Планка [10, 11].
– постоянная Планка [10, 11].
1. Специфическая особенность уравнения Шредингера проявляется в том, что движение электрона выражено не в координатах, как это обычно принято в классической механике, а в изменениях полной и потенциальной энергий. Фактически в его основание заложены несовместимые понятия частицы и волны [10, 11].
2. Решением уравнения Шредингера, является волновая функция ![]() . Но волновая функция не является физической величиной. Это хорошо понимал и сам Шредингер, который считал, что «волновая функция сама по себе не должна и не может быть непосредственно интерпретирована в трехмерном пространстве, поскольку в общем случае она является функцией в конфигурационном, а не в реальном пространстве» [11]. Поэтому получаемые на ее основе выводы имеют умозрительный и субъективный характер.
. Но волновая функция не является физической величиной. Это хорошо понимал и сам Шредингер, который считал, что «волновая функция сама по себе не должна и не может быть непосредственно интерпретирована в трехмерном пространстве, поскольку в общем случае она является функцией в конфигурационном, а не в реальном пространстве» [11]. Поэтому получаемые на ее основе выводы имеют умозрительный и субъективный характер.
Согласно квантовой модели атома, точное положение электрона в атоме в каждый момент времени установить нельзя в силу принципа неопределенности Гейзенберга. Вся информация о строении атома содержится в волновой функции ![]() . Величина
. Величина ![]() представляет собой плотность вероятности нахождения электрона в данной точке пространства. Состояние электрона в атоме задается распределением его заряда с распределением электронной плотности
представляет собой плотность вероятности нахождения электрона в данной точке пространства. Состояние электрона в атоме задается распределением его заряда с распределением электронной плотности ![]() . При этом электрон теряет четкое очертание и образует электронное облако. Принятая в квантовой механике вероятностная интерпретация квадрата волновой функции не имеет под собой ни логического, ни методологического обоснования. Нет и экспериментального подтверждения принятой в атомной физике вероятностной гипотезы [10, 11].
. При этом электрон теряет четкое очертание и образует электронное облако. Принятая в квантовой механике вероятностная интерпретация квадрата волновой функции не имеет под собой ни логического, ни методологического обоснования. Нет и экспериментального подтверждения принятой в атомной физике вероятностной гипотезы [10, 11].
3. Входящая в (1) потенциальная энергия представляет собой энергию взаимодействия между точечными зарядами по закону Кулона. Согласно квантово-волновой механике электрон в атоме не является точечным, а представляет собой бесформенное облако [5, 10, 11, 14]; но закон взаимодействия его с ядром не установлен.
4. «¼ уравнение Шредингера не имеет строгого вывода. Оно не выводится, но устанавливается и правильность его подтверждается согласием с опытом ¼» [16, с. 487]. Согласие с опытом строится на сравнении рассчитываемой по (1) энергии связи ![]() с измеряемой величиной – потенциалом ионизации
с измеряемой величиной – потенциалом ионизации ![]() атома. Для атома водорода достигнуто согласие между численными значениями этих величин, так что
атома. Для атома водорода достигнуто согласие между численными значениями этих величин, так что ![]() =
=![]() . Именно данное обстоятельство в свое время послужило «обоснованием» для утверждения уравнения Шредингера для атома водорода в качестве основополагающего уравнения квантово-волновой механики [10, 11].
. Именно данное обстоятельство в свое время послужило «обоснованием» для утверждения уравнения Шредингера для атома водорода в качестве основополагающего уравнения квантово-волновой механики [10, 11].
При решении уравнения Шредингера его разделяют на 3 части. Радиальная часть ![]() описывает, как волновая функция
описывает, как волновая функция ![]() изменяется с расстоянием от центра атома [5, 14]. При решении радиальной части уравнения Шредингера была применена подстановка двух взаимно сопряженных величин [14]
изменяется с расстоянием от центра атома [5, 14]. При решении радиальной части уравнения Шредингера была применена подстановка двух взаимно сопряженных величин [14]
![]() и
и ![]() , (2)
, (2)
где ![]() .
.
Во-первых, это заведомо известные величины, полученные ранее в теории Бора и получившие на тот момент требуемое согласие с экспериментом. Фактически получилось так, что сначала подбирается «нужное» уравнение, а затем констатируется согласие рассчитываемых с его помощью величин с данными эксперимента. Во-вторых, в стремлении к формальному согласию рассчитываемых и измеряемых величин в процессе решения уравнения была допущена непростительная ошибка, повлекшая за собой цепь умозрительных и непоследовательных шагов, которые привели к тупиковому направлению исследования вещества.
Принятое для доказательства правомерности (1) и (2) сравнение величин ![]() и
и ![]() не корректно. Действительно, энергия
не корректно. Действительно, энергия ![]() является параметром модели и должна представлять энергию взаимодействия точечного ядра со сферообразным электронным облаком. Согласно квантово-волновым представлениям плотность его максимальна в центре атома (т. е. в месте нахождения ядра!) и экспоненциально спадает по мере удаления от ядра. (Трудно придумать более нефизичную модель атома!). Чтобы преодолеть неопределенность понятия энергии
является параметром модели и должна представлять энергию взаимодействия точечного ядра со сферообразным электронным облаком. Согласно квантово-волновым представлениям плотность его максимальна в центре атома (т. е. в месте нахождения ядра!) и экспоненциально спадает по мере удаления от ядра. (Трудно придумать более нефизичную модель атома!). Чтобы преодолеть неопределенность понятия энергии ![]() , обусловленную неопределенностью понятия электронного облака, в теорию была введена так называемая функция радиального распределения
, обусловленную неопределенностью понятия электронного облака, в теорию была введена так называемая функция радиального распределения ![]() =
=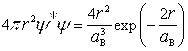 [10, 14], которая представляет искусственную конструкцию в виде произведения квадрата волновой функции
[10, 14], которая представляет искусственную конструкцию в виде произведения квадрата волновой функции ![]() и показательной функции
и показательной функции ![]() . Полученная таким образом функции
. Полученная таким образом функции ![]() имеет максимум при
имеет максимум при ![]() . Этому расстоянию
. Этому расстоянию ![]() преднамеренно, но совершенно безосновательно присвоено название боровского радиуса. Но радиус
преднамеренно, но совершенно безосновательно присвоено название боровского радиуса. Но радиус ![]() по Бору – это радиус окружности, соответствующий круговой орбите электрона атома водорода.
по Бору – это радиус окружности, соответствующий круговой орбите электрона атома водорода.
Расстояние ![]() не может быть возведено в ранг радиуса в общепринятом смысле. По определению [13], радиус атома это радиус сферы, в которой заключено (90-99)% электронной плотности. Если следовать данному определению, то радиус атома водорода в квантовой модели оказывается равным
не может быть возведено в ранг радиуса в общепринятом смысле. По определению [13], радиус атома это радиус сферы, в которой заключено (90-99)% электронной плотности. Если следовать данному определению, то радиус атома водорода в квантовой модели оказывается равным ![]() , т. е. много большим боровского радиуса. Величину
, т. е. много большим боровского радиуса. Величину ![]() нельзя измерить, т.к. положение максимума функции
нельзя измерить, т.к. положение максимума функции ![]() (соответствующее
(соответствующее ![]() ) находится внутри гипотетического электронного облака и оно недоступно для зондирующего внешнего поля в процессе измерения. Произошла элементарная подмена понятий, когда некоему виртуальному параметру теории
) находится внутри гипотетического электронного облака и оно недоступно для зондирующего внешнего поля в процессе измерения. Произошла элементарная подмена понятий, когда некоему виртуальному параметру теории ![]() придан статус реального радиуса атома. Причина, объясняющая данный подлог, вполне понятна: именно расстояние
придан статус реального радиуса атома. Причина, объясняющая данный подлог, вполне понятна: именно расстояние ![]() привлекается для расчета энергии
привлекается для расчета энергии ![]() , которая выступает в качестве критерия в процедуре установления соответствия с ее с потенциалом ионизации
, которая выступает в качестве критерия в процедуре установления соответствия с ее с потенциалом ионизации ![]() .
.
В отличие от энергии ![]() потенциал ионизации
потенциал ионизации ![]() связан с радиусом атома уравнением
связан с радиусом атома уравнением ![]() , которое является уравнением метода измерения [8]. В основе измерения потенциала
, которое является уравнением метода измерения [8]. В основе измерения потенциала ![]() лежит явление взаимодействия атома с внешним электрическим полем
лежит явление взаимодействия атома с внешним электрическим полем ![]() , так что
, так что ![]() , где
, где ![]() дипольный момент атома водорода;
дипольный момент атома водорода; ![]() , где
, где ![]() – это расстояние между зарядами ядра +e и электрона e. При этом потенциал ионизации выступает в качестве количественнй меры связи электрона с ядром. Точность измерения потенциала
– это расстояние между зарядами ядра +e и электрона e. При этом потенциал ионизации выступает в качестве количественнй меры связи электрона с ядром. Точность измерения потенциала ![]() достаточно высока (не хуже 0,1%). В силу того, что величины
достаточно высока (не хуже 0,1%). В силу того, что величины ![]() и
и ![]() взаимосвязаны и взаимообусловлены, точность определения радиуса атома водорода такая же как у потенциала ионизации.
взаимосвязаны и взаимообусловлены, точность определения радиуса атома водорода такая же как у потенциала ионизации.
Здесь ![]() выступает как действительный радиус, определяющий внешнюю границу электронной оболочки атома, поскольку «внешнее поле
выступает как действительный радиус, определяющий внешнюю границу электронной оболочки атома, поскольку «внешнее поле ![]() не может проникнуть во внутреннюю область атома. «Толщина» оболочки атома равна диаметру электрона, а положение электрона точно определено по отношению к ядру и характеризуется константой атома – его радиусом
не может проникнуть во внутреннюю область атома. «Толщина» оболочки атома равна диаметру электрона, а положение электрона точно определено по отношению к ядру и характеризуется константой атома – его радиусом ![]() .
.
Принципиальное различие величин ![]() и
и ![]() и соответственно величин
и соответственно величин ![]() и
и ![]() приводит к выводу о том, что выбор волновой функции в виде экспоненциальной функции в качестве решения уравнения Шредингера оказался ошибочным. Нет ни одного эксперимента, подтверждающего экспоненциальный характер волновой функции. А декларируемое «согласие» рассчитываемых величин
приводит к выводу о том, что выбор волновой функции в виде экспоненциальной функции в качестве решения уравнения Шредингера оказался ошибочным. Нет ни одного эксперимента, подтверждающего экспоненциальный характер волновой функции. А декларируемое «согласие» рассчитываемых величин ![]() и
и ![]() , с данными эксперимента
, с данными эксперимента ![]() и
и ![]() на поверку оказывается или непреднамеренной, допущенной второпях ошибкой или обычной фальсификацией. Это звучит диссонансом в отношении к широко распространяемому в учебной и монографической литературе утверждению о том, что выводы квантовой механики имеют «превосходное» экспериментальное подтверждение. Приведенный выше анализ ставит под сомнение данное утверждение и показывает, что достигнутое согласование представляется скорее подгонкой под известный результат, полученный ранее в рамках теории Бора (1913 г.).
на поверку оказывается или непреднамеренной, допущенной второпях ошибкой или обычной фальсификацией. Это звучит диссонансом в отношении к широко распространяемому в учебной и монографической литературе утверждению о том, что выводы квантовой механики имеют «превосходное» экспериментальное подтверждение. Приведенный выше анализ ставит под сомнение данное утверждение и показывает, что достигнутое согласование представляется скорее подгонкой под известный результат, полученный ранее в рамках теории Бора (1913 г.).
Приходит понимание бездоказательности еще одного утверждения, также имеющего широкое хождение. Смысл его сводится к тому, что квантовая механика стала необходимым условием для становления и развития ведущих областей знания – химии, электроники, оптики, материаловедения. Квантовая механика как метод теоретического описания вещества здесь не причем. Термин «квантовый» относится сугубо к объекту исследования, характерной особенностью которого выступает признак дискретности (атомная дискретность, дискретность энергетических состояний атомов). Что касается «квантовой» теории как способа описания вещества, то, как показывает анализ, она представляется сегодня не более чем «математика ради математики». Все, что приписывается квантовой механике со ссылкой на практические результаты и достижения – это не более чем иллюзорные достижения, когда желаемое выдается за действительное [10, 11].
Другие аспекты несостоятельности квантово-волнового описания вещества, вытекающие из предположения о фундаментальной роли уравнения Шредингера, анализируются и обсуждаются в работах [1 4, 10, 11, 15].
Таким образом, принятую в настоящее время в научной и учебной литературе модель атома водорода и опирающуюся на нее квантовомеханическую теорию нельзя считать корректной и презентабельной; она не отвечает требованиям, которые обычно предъявляются к научным теориям [6, 10]. Более того, принятые в настоящее время квантово-волновые представления фактически исключают саму возможность изучения атома.
Становление квантовой механики сопровождалось острой дискуссией между корифеями науки: Н. Бор, В. Гейзенберг, В. Паули, М. Борн и их сторонники, с одной стороны, и А. Эйнштейн, Э. Шредингер, Луи-де-Бройль, П. Планк и их последователи, с другой. Дискуссия проходила по линии обсуждения полноты квантовомеханического описания и концепции детерминизма и локальности процессов в микромире [10, 11]. Сегодня дискуссия о правомерности квантовомеханического описания явлений и процессов микромира возобновилась с новой силой, в первую очередь в связи с 1) затянувшимися ожиданиями результатов «чрезвычайной эффективности» квантовой механики, продекларированной на этапе революционного переворота, и ее «исторической неизбежности»; 2) появлением новых экспериментальных данных, таких как потенциалы ионизации и поляризуемости атомов и ионов; 3) возросшими потребностями практики, которые в значительной степени стимулированы быстрым развитием высоких технологий; 4) появлением новых атомных моделей и гипотез, нуждающихся в их обсуждении [10, 11].
Конечно же нельзя считать, что предшествующий 100-летний период исследований вещества был полностью потерян. Это период накопления и систематизации экспериментальных данных по физико-химическим свойствам веществ и материалов. В течение этого времени разработана совершенная аппаратура, позволившая получить уникальную, недоступную ранее информацию о свойствах и строении атомов, молекул, конденсированных веществ, которая отражена в соответствующих многочисленных справочных изданиях. В этом отношении данный этап исследований представляется совершенно необходимым и обязательным, предваряющим завершающий этап – этап создания прогностической теории вещества.
Проблема построения теории вещества заключается в установлении связи наблюдаемых свойств вещества с его структурными элементами. К сожалению, до настоящего времени не создана непротиворечивая теория вещества как основа понимания и единого описания организации вещества во всем его структурном многообразии. Хотя методология исследований вещества в целом достаточно очевидна и сводится к изучению свойств веществ в зависимости от составляющих данное вещество микрочастиц, а также в зависимости от внешних условий и способов воздействия на вещество различными физическими полями (тепловыми, механическими, электромагнитными). Количественным выражением свойства выступает обобщенная восприимчивость ![]() [8, 9]. При заданных условиях эксперимента свойства вещества являются функцией их компонентного состава, т. е.
[8, 9]. При заданных условиях эксперимента свойства вещества являются функцией их компонентного состава, т. е. ![]() , где
, где ![]() ,
, ![]() ,
, ![]() – концентрация соответствующего i-го,
– концентрация соответствующего i-го, ![]() ,
, ![]() компонентов микрочастиц, образующих вещество. В предельном случае простых веществ, образованных из одного типа x микрочастиц
компонентов микрочастиц, образующих вещество. В предельном случае простых веществ, образованных из одного типа x микрочастиц ![]() . В этом простейшем случае макроскопические свойства вещества однозначно определяются свойствами отдельных микрочастиц, так что в общем случае имеем
. В этом простейшем случае макроскопические свойства вещества однозначно определяются свойствами отдельных микрочастиц, так что в общем случае имеем ![]() , где
, где ![]() – плотность микрочастиц,
– плотность микрочастиц, ![]() – свойство отдельной микрочастицы, именуемой обобщенной поляризуемостью. Это соотношение справедливо в предельном случае невзаимодействующих микрочастиц. При рассмотрении реальных веществ взаимодействием между микрочастицами пренебрегать нельзя. Более того, эти взаимодействия могут быть достаточно сильными, чтобы создавать относительно устойчивые структурные образования. К ним применимо описание с помощью поляризуемости
– свойство отдельной микрочастицы, именуемой обобщенной поляризуемостью. Это соотношение справедливо в предельном случае невзаимодействующих микрочастиц. При рассмотрении реальных веществ взаимодействием между микрочастицами пренебрегать нельзя. Более того, эти взаимодействия могут быть достаточно сильными, чтобы создавать относительно устойчивые структурные образования. К ним применимо описание с помощью поляризуемости ![]() [8, 11].
[8, 11].
В общем случае вещество представляет сложную систему вложенных структур, из числа которых следует выделить надмолекулярный, молекулярный, атомный и внутриатомный (электронный) уровни. Относительную независимость каждого из иерархических уровней обеспечивает структурная устойчивость микрочастиц, представляющих соответствующий уровень. С другой стороны, все уровни вещества причинно обусловлены электронным строением атомов, так что искомую величину ![]() можно представить последовательностью зацепляющихся функций:
можно представить последовательностью зацепляющихся функций:

Здесь ![]() – функция, представляющая зависимость свойства
– функция, представляющая зависимость свойства ![]() вещества от числа
вещества от числа ![]() составляющих его молекулярных комплексов (ассоциатов), которые формируют надмолекулярную структуру
составляющих его молекулярных комплексов (ассоциатов), которые формируют надмолекулярную структуру ![]() и устойчивость которых характеризуется энергией взаимодействия
и устойчивость которых характеризуется энергией взаимодействия ![]() между ними. В свою очередь, надмолекулярная структура
между ними. В свою очередь, надмолекулярная структура ![]() является функцией числа
является функцией числа ![]() и структуры
и структуры ![]() молекул, устойчивость и стабильность которых определяется энергией межмолекулярных взаимодействий
молекул, устойчивость и стабильность которых определяется энергией межмолекулярных взаимодействий ![]() . Молекулярная структура
. Молекулярная структура ![]() зависит от числа
зависит от числа ![]() составляющих ее атомов и их структуры
составляющих ее атомов и их структуры ![]() , связанных между собой совокупностью межатомных (ковалентных) связей
, связанных между собой совокупностью межатомных (ковалентных) связей ![]() . И наконец, атомная структура
. И наконец, атомная структура ![]() является функцией числа электронов
является функцией числа электронов ![]() и внутриатомной структуры
и внутриатомной структуры ![]() , устойчивость которой характеризуется энергией связи
, устойчивость которой характеризуется энергией связи ![]() электронов с атомом. В конечном итоге свойства
электронов с атомом. В конечном итоге свойства ![]() молекулярных веществ обусловлены свойствами
молекулярных веществ обусловлены свойствами ![]() и строением
и строением ![]() атомов. Генетическая информация о структурообразовании вещества “записана” в электронной структуре атомов и реализуется путем их самоорганизации по механизму межчастичных взаимодействий [10, 11].
атомов. Генетическая информация о структурообразовании вещества “записана” в электронной структуре атомов и реализуется путем их самоорганизации по механизму межчастичных взаимодействий [10, 11].
Структурная организация других классов веществ (ионных, металлических, ковалентных, протонных) также причинно обусловлена электронным строением составляющих их атомов и ионов. Различия лишь в механизмах структурообразования вещества, которые определяются величиной и размерностью электрического момента исходных атомов и/или ионов и которые выступают первопричиной межатомных и межионных взаимодействий.
Основополагающая роль атомного уровня объясняется тем, что на этом уровне “состав” (число электронов в атоме) точно задан (порядковым номером атома в таблице Менделеева), а взаимодействие между внутриатомными зарядами (ядра и электронов) описывается фундаментальным законом Кулона. Данное обстоятельство открывает и обеспечивает принципиальную возможность установления электронной конфигурации атомов, и, соответственно, возможность определения пространственного распределения зарядов. В мультипольном представлении [9 11] заданному распределению зарядов в атоме отвечает электрический момент соответствующей пространственной размерности (монополь, диполь, квадруполь, октуполь и т. д.). Наличие у атома электрического момента делает его электрически активным, способным к взаимодействию с окружающими микрочастицами и, как следствие этого, способным к связыванию атомов и образованию молекул и химических соединений.
Таким образом, исходная информация об организации и структурообразовании вещества содержится в атомной структуре в виде электрического момента, размерность которого предопределяет характер и механизм межатомных взаимодействий, обеспечивающих атомам способность к образованию химической и физической связи. Тем самым электронное строение атомов предопределяет пространственную конфигурацию отдельных молекул и архитектуру вещества в целом. Для построения теории вещества вывод о том, что свойства вещества обусловлены электронным строением составляющих их атомов, представляется исключительно важным. Становятся понятными причины ограниченности известных теорий вещества, у которых это основополагающее звено отсутствует. С другой стороны, исследования в области создания прогностической теории вещества становятся более осознанными и целенаправленными [10, 11].
Молекулярные вещества относятся к классу веществ, строительными элементами которых выступают нейтральные (в электрическом отношении) структурные образования. Отличительной особенностью молекулярных (ван-дер-ваальсовых) является невалентный характер взаимодействия между микрочастицами. Межмолекулярные силы взаимодействия ван-дер-ваальсовых систем имеют чисто электрическую природу и заряд-дипольный механизм образования физических связей, обусловливающих образование молекулярных димеров, кластеров и в целом молекулярных веществ. Носителем межатомных и межмолекулярных взаимодействий являются атомы (молекулы) с их диполь-оболочечным строением. Принципиальные трудности расчета энергии межмолекулярных взаимодействий связаны с неаддитивным характером сложения парных потенциалов. Описание молекулярных веществ достигается с помощью потенциальных функций ![]() , отличающихся от парных потенциальных функций тем, что в них вводится координационное число
, отличающихся от парных потенциальных функций тем, что в них вводится координационное число ![]() , которым учитывается кооперативный характер взаимодействия между микрочастицами [10, 11].
, которым учитывается кооперативный характер взаимодействия между микрочастицами [10, 11].
Ковалентные кристаллы. Тетраэдрическая конфигурация электронов внешней оболочки атомов IV группы предопределяет пространственную структуру кристаллов типа алмаза. Благодаря тетраэдрической симметрии атомов связь между ними осуществляется точно вдоль направлений их электронных орбит. В результате образуется пространственная решетка, структура которой строго соответствует электронной конфигурации атомов в узлах этой решетки. Примером такой решетки может служить кристалл алмаза. У такого рода кристаллов атомы связаны между собой ковалентными связями, которые и определяют структуру и устойчивость кристалла. Энергия связи атома с кристаллом в этом случае сводится к определению энергии химической связи между атомами с учетом их окружения, определяемого координационным числом, равным 4 [10, 11].
Ионные системы образуются в результате взаимодействия разных атомов, преимущественно атомов, принадлежащих крайним группам таблицы Менделеева. У атомов металлов ![]() поляризуемости имеют высокие значения и низкие энергии связи
поляризуемости имеют высокие значения и низкие энергии связи ![]() ; у галогенов
; у галогенов ![]() , наоборот, низкие поляризуемости и достаточно большие энергии связи. При взаимодействии атомов
, наоборот, низкие поляризуемости и достаточно большие энергии связи. При взаимодействии атомов ![]() и
и ![]() валентные электроны
валентные электроны ![]() диссоциируют и присоединяются к
диссоциируют и присоединяются к ![]() , образуя в конечном итоге ионную решетку
, образуя в конечном итоге ионную решетку ![]() .Основой вклад в энергию межионных взаимодействий системы вносит энергия электростатического взаимодействия ионов. Примером может служить модель ионного кристалла типа
.Основой вклад в энергию межионных взаимодействий системы вносит энергия электростатического взаимодействия ионов. Примером может служить модель ионного кристалла типа ![]() как простой кубической решетки, в узлах которой размещены поочередно ионы
как простой кубической решетки, в узлах которой размещены поочередно ионы ![]() и
и ![]() , несущие эффективные заряды +q и q, соответственно. В равновесном состоянии кристалла силы притяжения разноименных зарядов уравновешены силами отталкивания одноименных зарядов. При этом каждый из ионов участвует в формировании как сил притяжения, так и сил отталкивания, формирующих притягивательную и отталкивательную ветви потенциальной функции
, несущие эффективные заряды +q и q, соответственно. В равновесном состоянии кристалла силы притяжения разноименных зарядов уравновешены силами отталкивания одноименных зарядов. При этом каждый из ионов участвует в формировании как сил притяжения, так и сил отталкивания, формирующих притягивательную и отталкивательную ветви потенциальной функции ![]() [10, 11].
[10, 11].
При построении теории электронного строения металлов обычно принимается модель свободных электронов, согласно которой валентные электроны атомов покидают свои внешние оболочки и образуют решетку из сферически симметричных катионов, которые погружены в среду из электронного газа. К модели свободных электронов близка модель энергетических зон, согласно которой валентные электроны делокализованы и в результате их взаимодействия образуют частично заполненную зону проводимости. Но модели свободных электронов не объясняют известный экспериментальный факт, что потенциал ионизации кластеров атомов I группы таблицы Менделеева слабо зависит от числа составляющих его элементов, вплоть до макроскопических объемов [12]. По сути, это означает, что валентные электроны атомов находятся в связанном молекулярном состоянии.
Модель свободных электронов не объясняет преимущественное образование у металлов ОЦК–решетки.
С учетом понимания механизма формирования гомоядерных молекул, в качестве рабочей гипотезы можно предложить модель ОЦК–решетки, образуемую димерами ![]() в узлах данной решетки. При этом наблюдаемую электропроводность металлов можно объяснить высокой направленностью межмолекулярных связей при относительно высокой плотности вещества и относительно небольшими потенциальными барьерами, разделяющими орбиты близлежащих димеров [11].
в узлах данной решетки. При этом наблюдаемую электропроводность металлов можно объяснить высокой направленностью межмолекулярных связей при относительно высокой плотности вещества и относительно небольшими потенциальными барьерами, разделяющими орбиты близлежащих димеров [11].
Сегодняшний этап исследований в области электронного строения вещества связан с надеждами на восстановление целостностного учения о веществе, исходя из присущего веществу единства свойств, состава, строения и структурной организации вещества. Руководствуясь этой идеей, автором разрабатывается теория электронного строения вещества, основанная на установлении причинно-следственных связей между микро- и макро уровнями вещества. С ее помощью достигается описание связи между микро- и макроскопическими уровнями вещества, а теория вещества принимает статус прогностической теории, т. е. теории, предсказывающей свойства вещества на основании исходных данных о строении атомов и молекул. Она логически и методически выверена и может служить концептуальным основанием для последующего уточнения и более детальных проработок ее отдельных положений. Разрабатываемая теория опирается на законы электростатики и электродинамики и по своей сути является классической. Она выстраивается исходя из логики обусловленности строения вещества электронным строением атомов и ионов и в этом отношении может быть отнесена к категории ab initio.
Можно надеяться, что начатые исследования по разработке прогностической теории электронного строения вещества стимулируют обсуждение одной из фундаментальных проблем современного естествознания и будут способствовать выводу учения о веществе из сегодняшнего кризисного состояния.
Список литературы:
1. Аккарди Л. Диалоги о квантовой механике. Гейзенберг, Фейнман, Академус, Кандидо и Хамелеон на ветке. – Москва–Ижевск: Институт компьютерных исследований; НЦЦ «Регулярная и хаотическая динамика», 2004. – 448 с.
2. Вильф Ф. Ж. Логическая структура квантовой механики. – М.: Эдиториал УРСС, 2003. – 256 с.
3. Ганкин В. Ю., Ганкин Ю. В. Как образуется химическая связь и протекают химические реакции. – М.: Изд-во Граница, 2007. – 320 с.
4. Гризинский М. Об атоме точно: Семь лекций по атомной физике. Ред. М. М. Лаврентьев. – Новосибирск: ИМ СО РАН, 2004, 94с..
5. Дикерсон Р., Грей Г., Хейт Дж. Основные законы химии. Т. 1. – М.: Мир, 1982. – 652 с.
6. Мостепаненко М. В. Философия и методы научного познания. Л.: Лениздат, 1972. – 264 с.
7. Потапов А. А. Вещество как движущий потенциал технологических инноваций. Сб. «Инновации и современная наука». – Новосибирск, 2011.
8. Потапов А. А. Деформационная поляризация: поиск оптимальных моделей. – Новосибирск: Наука, 2004. – 511 с.
9. Потапов А. А. Диэлектрический метод исследования вещества. – Иркутск, Изд-во Иркутского госуниверситета, 1986. – 256 с.
10. Потапов А. А. Наука о веществе: состояние и перспективы; электронное строение атома; перспективы построения прогностической теории. Бутлеровские сообщения. – 2011. Т. 24, № 1.С. 1-45.
11. Потапов А. А. Ренессанс классического атома. – М.: Издательский Дом «Наука», 2011. – 444 с.
12. Суздалев И. П. Нанотехнология: физико-химия нанокластеров, наноструктур и наноматериалов. – М.: КомКнига, 2006. – 592 с
13. Физическая энциклопедия / Гл.ред. А.М. Прохоров. М.: Сов. Энциклопедия, ̶ 1988. ̶ Т.1. ̶ 704 с.
14. Флайгер У. Строение и динамика молекул, Т. 1. – М.: Мир, 1982. – 408 с.
15. Хренников А. Ю. Введение в квантовую теорию информации. – М.: ФИЗМАТЛИТ, 2008. – 254 с.
16. Шпольский Э. В. Атомная физика. – М.: Физматгиз, 1963. – Т. 1. – 576 с.
дипломов
Оставить комментарий