Статья опубликована в рамках: III Международной научно-практической конференции «Научные достижения биологии, химии, физики» (Россия, г. Новосибирск, 27 декабря 2011 г.)
Наука: Химия
Секция: Органическая химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
НЕОБЫЧНАЯ СТАБИЛЬНОСТЬ 1-АЦИЛАМИНО-4,5-БИС(ДИМЕТИЛАМИНО)-8-НИТРОНАФТАЛИНОВ К ДЕЗАЦИЛИРОВАНИЮ
Власенко Марина Павловна
инженер ЮФУ, г. Ростов-на-Дону
Е-mail: mvlasen@mail.ru
Озерянский Валерий Анатольевич
д-р хим. наук, профессор ЮФУ, г. Ростов-на-Дону
Е-mail: vv_ozer2@sfedu.ru
С учетом умеренной (в сравнении с фенолами) NH-кислотности амидов и азотистых гетероциклов мы предположили возможность внутримолекулярной прототропии в ряду до сих пор неизвестных перимидинов 1, потенциально способных к существованию в цвиттер-ионной форме 2. В свою очередь, наиболее очевидными предшественниками оснований 1 представляются a-нафтиламиды типа 3, заместитель Rв которых может обладать различной подкисляющей способностью. В настоящей работе осуществлен синтез амидов 3 и исследована возможность их селективного нитрования, дезацилирования и восстановления комплексными гидридами.
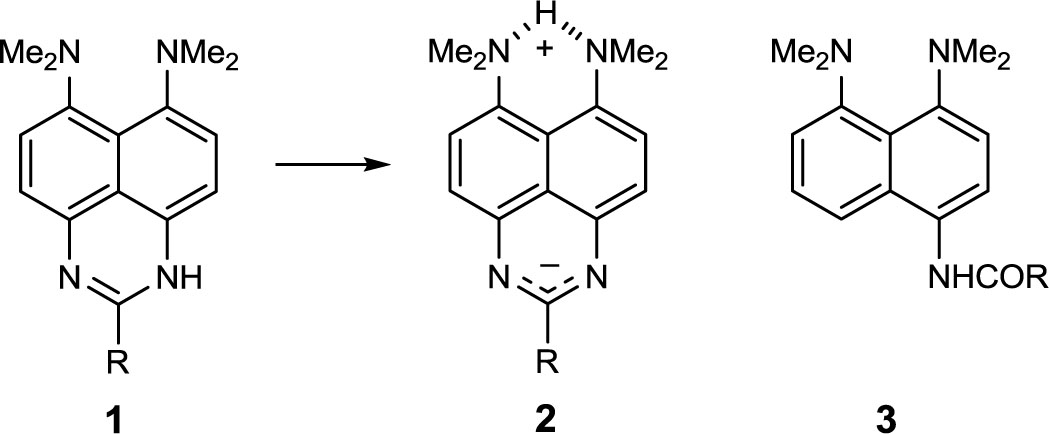
Прямым ацилированием амина 4 нами были получены бензамиды 5, 6 и трифторацетильное производное 7 с выходом 50–65%. Следует отметить, что введение в реакционную массу вспомогательных оснований (K2CO3, Et3N, пиридин) мало способствует повышению выхода амидов из-за связывания части исходного амина 4, обладающего высокоосновными свойствами [1], выделяющейся в реакции кислотой.
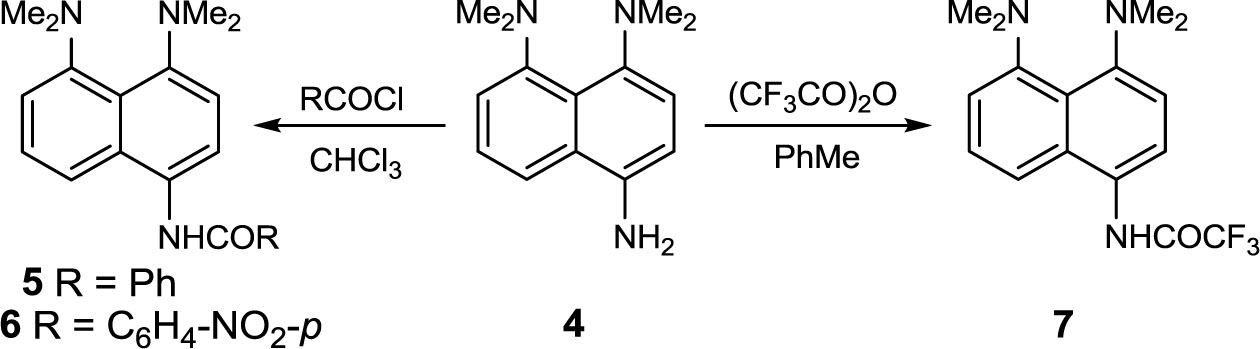
Протон группы NHCORв синтезированных амидах, как и сама карбонильная группа имеют обычные для ариламидов характеристики [nNH 3233–3304, nCO 1645–1712 см–1 (ваз. масло), dNH 7.23–8.06 м. д. (CDCl3)]. В то же время, хелатированный протон NHв катионах 1,8-бис(диметиламино)-нафталина и его производных проявляется в спектрах ЯМР 1Н при dH18–20 м. д. [5]. Полученные данные, таким образом, свидетельствует об отсутствии биполярных форм типа 8 и, следовательно, внутримолекулярного протонного переноса в амидах 5–7.

Обработка нафтиламидов 5–7 нитрующей смесью (1 экв., –15 oC) с выходом 66–70% дает продукты селективного пери-нитрования 9–11. Лишь в случае трифторацетамида 7 удается выделить не более 4–6% изомерного нитропроизводного 12.
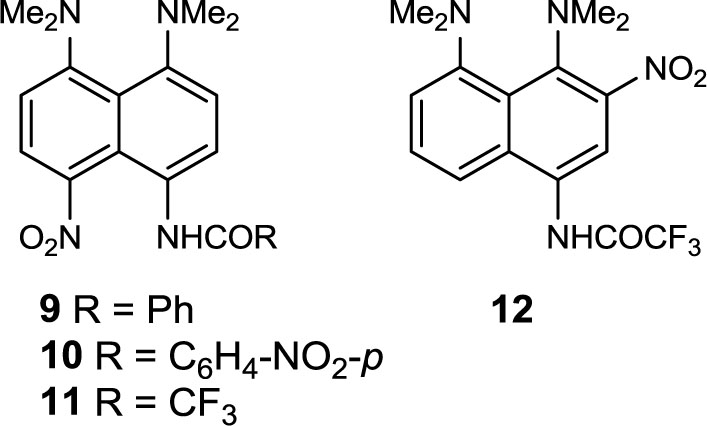
Введение пери-нитрогруппы, как показывает спектроскопия ИК и ЯМР 1Н, почти не меняет геометрические и электронные параметры a-нафтиламидного фрагмента, немного повышая частоты соответствующих валентных колебаний и дезэкранируя пери-NH-протон [nNH 3269–3400, nCO 1657–1716 см–1 (ваз. масло), dNH 7.93–8.87 м. д CDCl3)].
Для сравнения мы провели нитрование бензамида 9 в смеси HNO3/AcOH. В этом случае наблюдалось сильное осмоление реакционной массы и снижение региоселективности реакции в сравнении с действием смеси HNO3/H2SO4; в результате были выделены моно-нитропроизводные 9 (9%), 13 (9%) и 14 (12%).

В ходе дальнейших исследований выяснилось, что такая простая реакция, как гидролиз нитроамидов 9–11 (любой из них мог бы привести к до сих пор неизвестному нитроамину 15) в обычных условиях не протекает. Если исходные амиды 5–7 количественно дезацилируются при кипячении с 10% HClдо амина 4, то введение пери-нитрогруппы удивительным образом ингибирует процесс снятия ацильного заместителя. Представление об этом дают данные таблицы 1, где собраны условия и результаты гидролиза амида 10.
Таблица 1.
Попытки дезацилирования нитроамида 10
|
Опыт № |
Условия |
Результат |
|
1 |
конц. H2SO4/1 д/20 oС |
осмоление* |
|
2 |
конц. H2SO4/5 мин/0 oС |
осмоление* |
|
3 |
конц. HCl/2 д/20 oС |
исходное |
|
4 |
10% H2SO4/1 ч/кипячение |
исходное |
|
5 |
30% H2SO4/1 ч/кипячение |
исходное+соединение 16 |
|
6 |
20% HCl/3 ч/кипячение |
соединение 16 |
|
7 |
4% HCl/1 ч/кипячение |
исходное |
|
8 |
AcOH/2 д/20 oС |
исходное |
|
9 |
NH2NH2/EtOH/1 ч/кипячение |
осмоление* |
|
10 |
HOCH2CH2NH2/5 мин/кипячение (170 oС) |
осмоление |
|
11 |
Et3N/1 ч/кипячение |
исходное |
|
12 |
пиперидин/2 д/20 oС |
исходное |
|
13 |
пиперидин/PhMe/27 ч/кипячение |
исходное |
|
14 |
10% KOH/1 ч/кипячение |
исходное |
|
15 |
MeONa/MeOH/1 д/20 oС |
исходное |
|
16 |
LiOH/H2O–MeOH–ТГФ(1:1:1)/2 д/20 oС |
исходное |
|
17 |
LiOH/H2O–MeOH–ТГФ (1:1:1)/2 ч/кипячение |
исходное+осмоление |
* Обнаруживается п-нитробензойная кислота.
Как видно из таблицы, в большинстве случаев исходный нитроамид 10 остается неизменным; в более жестких условиях наблюдается постепенное осмоление вещества. В этой ситуации трудно сказать, являются ли причиной осмоления агрессивные условия и реагенты, либо неустойчивость нитроамина 15. Присутствие в продуктах деструкции п-нитробензойной кислоты (опыты 1, 2, 9) указывает на то, что гидролиз все же протекает, однако в кислой среде получающийся амин 15 подвергается дальнейшим превращениям. Так, в условиях опытов 5 и 6 удается собрать около 12% вещества, совокупность физических свойств и спектральных характеристик которого позволяют приписать ему структуру перимидин-6-она 16a, находящегося в подвижном равновесии с имино-формой 16b.

Компактная и сопряженная система 16 растворяется в кислотах и основаниях, с чем связаны проблемы с ее выделением, дает пик молекулярного иона с интенсивностью 100% и главными направлениями фрагментации вида [M–OH]+ и [M–CO]+ (незамещенный 6Н-перимидин-6-он из-за отсутствия таутомеризации дает только осколочный пик [M–CO]+ [2]). В ЯМР 1Н-спектре этого вещества, помимо четырех однопротонных дублетов в ароматической области с характерными для хиноидных систем константами J=9.8 Гц и синглета протона Н-2 при 9.35 м. д., проявляются слабопольный (dH11.7 м. д.) уширенный синглет «кислого» протона, исчезающий при дейтерировании, и сигнал N-метильной группы, в виде дублета с константой 3JNH,NMe=5.4 Гц.
В литературе [4] имеется похожий пример, когда в амиде 17 ни в кислой, ни в щелочной среде не удается осуществить гидролиз N‑ацетильных групп. Таким образом, невозможность гидролиза пери-нитроамидов нафталинового ряда не связана с наличием фрагмента протонной губки в таких соединениях или стерическими препятствиями. Скорее всего, ингибирование происходит только тогда, когда пери-NO2-заместитель сопряжен с +M-группой. В таком случае может возрасти вклад структуры типа 18, в которой атака нуклеофила на карбонильный атом углерода окажется затруднена. В пользу этого свидетельствует факт успешного гидролиза несопряженных нитроамидов 19 и 20 при действии, соответственно, 10% HCl [3] и гидразина [6].
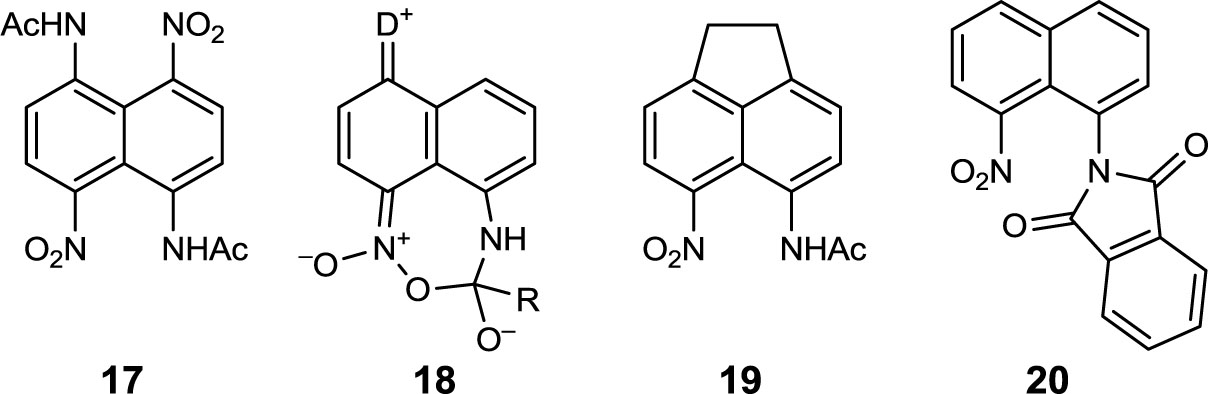
Интересно, что результат превращения не зависит от N-ацильного заместителя в амиде (так, амид 9 тоже дает перимидин 16). Возможно, нитроамин 15 образуется, однако подвергается дальнейшим трансформациям.
Список литературы:
1.Озерянский В. А., Пожарский А. Ф. Синтез 1,4,5-трис(диметиламино)нафталина и других 4-аминопроизводных «протонной губки» // Изв. АН Сер. хим.— 1997. — С. 1501‑1504.
2.Cameron D. W., Samuel E. L. Synthesis of the Perimidin-4- and -6-one systems // Aust. J. Chem. —1976. —№29. —P. 2499–2509.
3.Cheeseman G. W. H. Synthesis of pirrolo[1,2-a]naphtha[1,8-ef][1,4]diazepines // J. Het. Chem.—1986.—Vol. 23.—P. 65–67.
4.Nielsen A. T., DeFusco A. A., Browne T. E. Nitration of Bis(amido)naphthalenes // J. Org. Chem.—1985.—Vol. 50.—P. 4211–4218.
5.Pozharskii A. F., Ozeryanskii V. A., Proton sponges, in The Chemistry of Anilines, Ed. Z. Rappoport, J. Wiley & Sons, Chichester, 2007, Part 2, Ch. 17, P. 931–1026.
6.Richter, H. J. 5-Amino-6-nitroacenaphthene // J. Org. Chem.—1956.—Vol. 21.—P. 619–620.
дипломов
Оставить комментарий