Статья опубликована в рамках: III Международной научно-практической конференции «Научные достижения биологии, химии, физики» (Россия, г. Новосибирск, 27 декабря 2011 г.)
Наука: Химия
Секция: Биоорганическая химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
НОВЫЕ АКТИНОПОРИНЫ ИЗ АКТИНИИ HETERACTIS CRISPA: ВЫДЕЛЕНИЕ И ЧАСТИЧНАЯ ХАРАКТЕРИСТИКА
Меньшов Александр Сергеевич
магистрант 1 года обучения, Дальневосточный Федеральный Университет, Школа естественных наук, г. Владивосток
E-mail:
Ткачева Екатерина Сергеевна
м. н. с., Тихоокеанский институт биоорганической химии ДВО РАН, г. Владивосток
Монастырная Маргарита Михайловна
д-р хим. наук., доцент, Тихоокеанский институт биоорганической химии ДВО РАН, г. Владивосток
Работа поддержана грантом РФФИ № 10-08-00316-а.
Из тропической актинии Heteractiscrispaметодами ацетонового осаждения, ионообменной хроматографии, гель-фильтрации и обращенно-фазовой ВЭЖХ получен суммарный препарат полипептидов, представляющих собой, согласно данным электрофореза и МАЛДИ ТОФ масс-спектрометрии, изоформы актинопоринов — пороформирующих токсинов.
Ключевые слова: актиния, актинопорины, полипептиды, гемолитическая активность, хроматография, электрофорез, масс-спектрометрия.
Актинопорины являются одной из наиболее широко исследуемых групп мембраноактивных полипептидов, продуцируемых актиниями, ядовитыми морскими кишечнополостными. В настоящее время эти полипептиды относят к семейству α-пороформирующих токсинов (α-ПФТ), их действие связано с образованием в мембранах пор (диаметром 1-2 нм), проницаемых для катионов и небольших молекул [2, 4, 7, 9]. Пространственная структура актинопоринов позволяет им находиться как в водорастворимом состоянии, так и в мембраносвязанном (рис. 1, а), причем переход в последнее обусловлен конформационными перестройками молекулы при ее включении в мембрану [5, 7]. В настоящее время ПФТ используют в качестве инструментов исследования структурной организации и механизмов функционирования биологических и модельных мембран [9]. Разнообразие проявляемых актинопоринами видов биологической активности (кардиостимулирующая, антиопухолевая, антипаразитарная [2, 4, 8]) дает возможность конструировать на основе их структуры высокоспецифичные фармакологические препараты направленного действия.
Ранее сотрудниками лаборатории химии пептидов ТИБОХ ДВО РАН из тропической актинииHeteractiscrispaбыло выделено в индивидуальном состоянии и охарактеризовано четыре нативных актинопорина [2, 8, 9], а методами молекулярной биологии установлено 19 структур геновH. crispa, кодирующих 18 высоко гомологичных аминокислотных последовательностей, которые образуют комбинаторную библиотеку актинопоринов [1]. Для трех ее представителей получены рекомбинантные формы, степень идентичности аминокислотных последовательностей которых с известными актинопоринами из тропических актиний Actiniaequinaи Stichodactyla helianthus, эквинатоксином II и стихолизином II [4], составляет 84–91% соответственно.
а)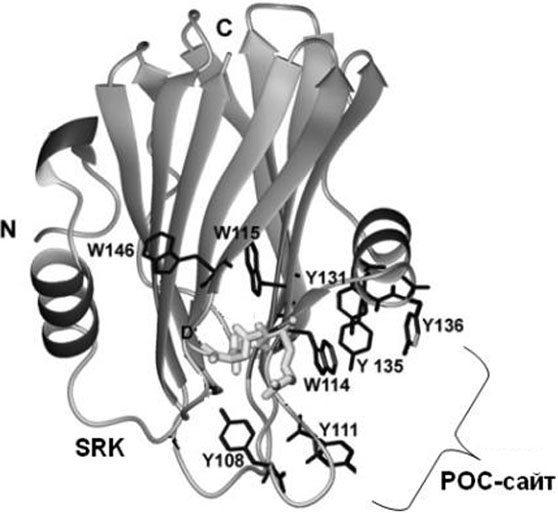 б)
б)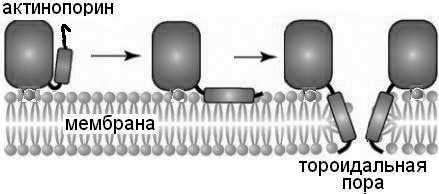
Рисунок 1. 3D-модель актинопорина Hct-S6 (а) [1]; схематичная модель порообразования [4] (б).
Исследование механизма действия актинопоринов позволило установить, что на первом этапе порообразования происходит взаимодействие ароматических аминокислотных остатков так называемого РОС-сайта связывания актинопорина с фосфорилхолиновыми головками мембранного сфингомиелина и/или фосфатидилхолина (в результате образования между молекулами полипептида и фосфолипида прочных гидрофобных контактов, водородных и ионных связей). Конформационные изменения молекулы актинопорина, происходящие при этом, затрагивают высоко заряженную петлю SRK и N-концевой фрагмент, который разворачивается и попадает в водно-липидный интерфейс мембраны. Этот процесс, сопровождаемый удлинением амфифильной α-спирали N-концевого фрагмента на несколько аминокислотных остатков, завершается ее включением в мембрану (рис. 1, б) [5]. Установлено, что в состав функциональной поры входят N-концевые фрагменты четырех молекул актинопорина, которые, чередуясь с молекулами фосфолипидов, формируют в мембране тороидальную пору [7].
Целью данной работы являлся поиск и идентификация новых нативных актинопоринов из H. crispaс целью дальнейшего проведения сравнительного структурно-функционального исследования представителей комбинаторной библиотеки, которые предполагается получить методам молекулярного клонирования.
Для выделения полипептидов использовали актинии H. crispa, собранные на литорали Южно-Китайского моря в 2010 году в ходе 38‑й научно-исследовательской экспедиции НИС «Академик Опарин». Из водного экстракта актиний методом осаждения 63%-ным ацетоном выделяли суммарный белковый препарат, дальнейшее разделение которого на активные фракции проводили методом катионообменной хроматографии на карбоксиметилцеллюлозе-32 (рис. 2, а) в градиенте концентрации NaCl (0–0,5 М) в 0,01 М аммоний-ацетатном буферном растворе, рН 6,0.
Белковые фракции (границы объединения показаны жирными линиями), собранные под пиком 2, обладали высокой гемолитической активностью, а под пиками 1 и 3 имели более низкую активность. Полипептиды, содержащиеся в объединенных белковых фракциях пика 2 (рис. 2, а), рехроматографировали в тех же условиях (рис. 2, б) и последующую очистку актинопоринов проводили методом гель-фильтрации (рис. 3, а—г).
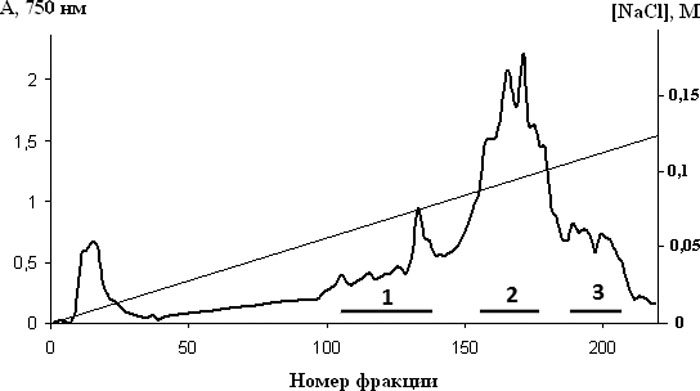
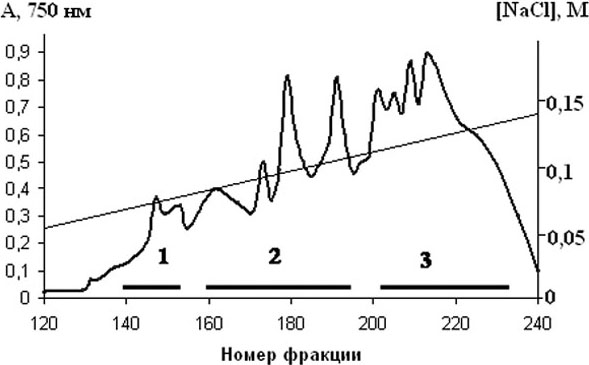
Рисунок 2. Катионообменная хроматография полипептидов H. crispa, осажденных ацетоном, на колонке с КМ-32 целлюлозой (а); рехроматография полипептидов, содержащихся в белковых фракциях пика 2 (рис. 2, а) (б).
В результате были получены гемолитически активные белковые фракции (пики 1–3), содержащие от 50 до 800 мкг белка. Согласно данным электрофоретического анализа (рис. 4, а) эти фракции содержали полипептиды с молекулярной массой около 19–20 кДа (актинопорины), во фракциях пика 1 (рис. 3, б и рис. 3, в) были идентифицированы примесные полипептиды с молекулярной массой 9 кДа. Полипептиды гемолитически активных белковых фракций, соответствующих пикам 3 (рис. 3, б и рис. 3, в) и 1 (рис. 3, г), объединяли и подвергали обращенно-фазовой ВЭЖХ на колонке NucleosilC18(рис. 3, е и рис. 3, д соответственно).
Масс-спектрометрический анализ полипептидов пика 1 (рис. 3, д) показал, что их молекулярная масса составляет 18996 и 19121 Да (рис. 4, б) и близка таковой ранее выделенных из H. crispaнативных актинопоринов RTX-SII(19275 Да) и RTX-A [3, 6]. Уширенные пики на профиле элюции полипептидов (рис. 3, д и рис. 3, е) указывают на то, что в белковом препарате содержится несколько изоформ актинопорина. Это согласуется с данными молекулярно-биологического исследования актинопоринов H. Crispa [1]. Наличие примесных полипептидов с молекулярной массой более 9 кДа не противоречит ранее обнаруженному факту, что различные виды актиний продуцируют, помимо высокомолекулярных цитолизинов (актинопоринов), также низкомолекулярные цитолизины (6‑10 кДа) [2, 4].

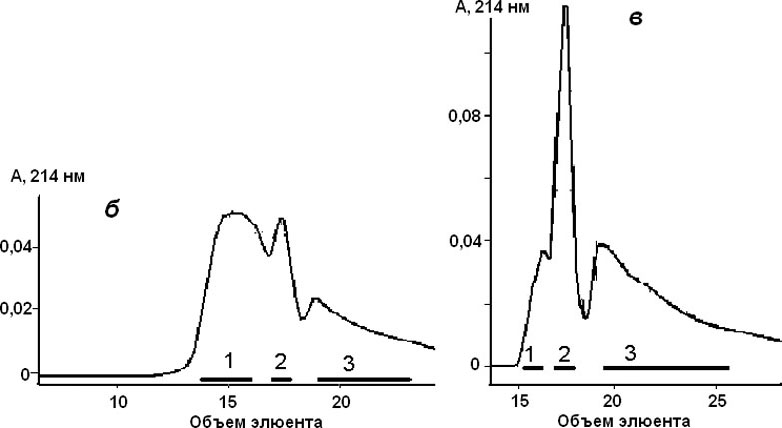
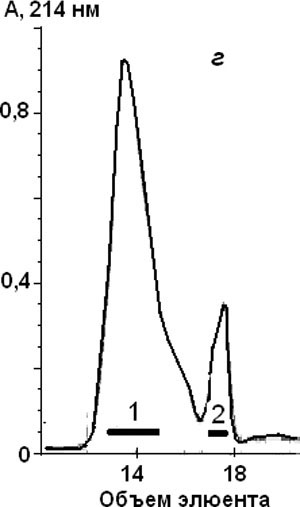

Рисунок 3. Гель-фильтрация полипептидов белковых фракций пиков 1, 2, 3 (рис. 2, б) (а, б, в и г соответственно); ВЭЖХ полипептидов (д) белковых фракций пика 1 (рис. 3, г); ВЭЖХ полипептидов (е) объединенных белковых фракций пиков 3 (рис. 3, б и в). Жирной линией отмечены границы объединения фракций, проявивших гемолитическую активность.
Наличие нескольких сигналов меньшей интенсивности (в области 38543 и 57950 m/z) показывает, что в полученном белковом препарате актинопорины существуют в форме димеров и тримеров, что согласуется с данными для стихолизина II [4].
а)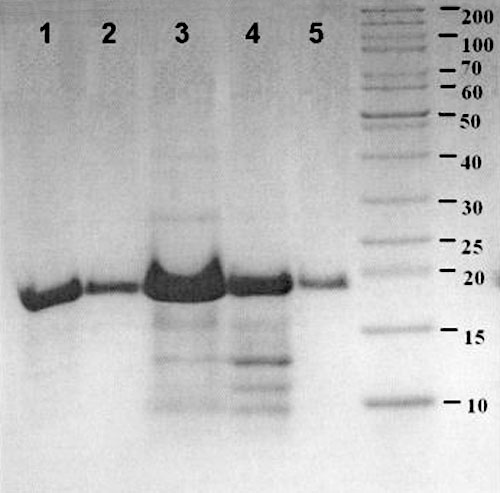 б)
б)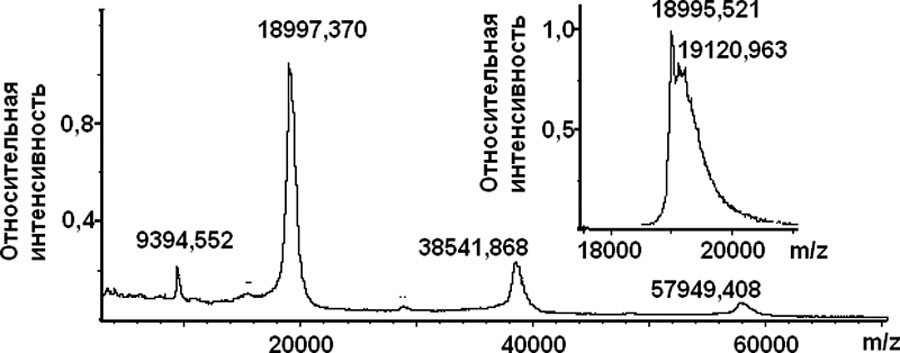
Рисунок 4. (а) электрофореграмма полипептидов пиков 1, 2 (рис. 3, в), 3 (рис. 3, б), 1, 3 (рис. 3, г) (цифры на электрофореграмме 1, 2, 3, 4, 5 соответственно); (б) масс-спектр полипептидов пика 1 (рис. 3, д).
Таким образом, ввиду большого количества изоформ актинопоринов и чрезвычайно малого их содержания в исходном сырье проведение структурно-функциональных исследований этой чрезвычайно интересной группы ПФТ, представляющих собой мультигенное семейство актинииH. crispa, представляет собой очень непростую задачу. Поэтому с этой целью в дальнейшей работе будут использованы как методы молекулярной биологии, так и молекулярного моделирования.
Список литературы:
1.Новые актинопорины актинии Heteractis crispa: клонирование и функциональная экспрессия / Ткачева Е. С., Лейченко Е. В., Монастырная М. М., Исаева М. П., Зелепуга Е. А., Анастюк С. Д., Дмитренок П. С., Козловская Э. П. // Биохимия. 2011. Т. 76. С. 1387–1397.
2.Actinoporins from the sea anemones, tropical Radianthus macrodactylus and northern Oulactis orientalis: comparative analysis of structure-function relationships / Monastyrnaya M., Leychenko E., Issaeva M., Likhatskaya G., Zelepuga E., Kostina E., Trifonov E., Nurminski E., Kozlovskaya E. // Toxicon. 2010. V. 56. P. 1299–1314.
3.Amino acid sequence of RTX-A’s isoform actinoporin from the sea anemone Radianthus macrodactylus / Il’ina A., Lipkin A., Barsova E., Issaeva M., Leychenko E., Guzev K., Monastyrnaya M., Lukyanov S., Kozlovskaya E. // Toxicon. 2006. V. 47, P. 517–520.
4.Anderluh G., Maček P. Cytolytic peptide and protein toxins from sea anemones (Anthozoa: Actiniaria) // Toxicon. 2002. V. 40. P. 111–124.
5.Crystal and electron microscopy structures of sticholysin II actinoporin reveal insights into the mechanism of membrane pore formation / Mancheno J. M., Martin-Benito J., Martinez-Ripol M., Gavilanes J. G., Hermoso J. A. // Structure. 2003. V. 11. P. 1–20.
6.Isolation, properties and partial amino acid sequence of a new actinoporin from the sea anemone Radianthus macrodactylus / Klyshko E. V., Issaeva M. P., Monastyrnaya M. M., Il’ina A. P., Guzev K. V., Vakorina T. I., Dmitrenok P. S., Zykova T. A., Kozlovskaya E. P. // Toxicon. 2004. V. 44, P. 315–324.
7.Pore Formation by Equinatoxin, a Eukaryotic Pore-forming Toxin, Requires a Flexible N-terminal Region and a Stable β-Sandwich / Kristan K., Podlesek Z., Hojnik V., Gutierrez-Aguirre I., Gunear G., Turk D., Gonzalez-Manas J. M, Lakey J. H., Macek P., Anderluh G. J. // Biol. Chem. 2004. V. 279. P. 46509–46517.
8.The anticancer effects of actinoporins from the sea anemone Heteractis crispa(=Radianthusmacrodactylus) / Fedorov S., Monastyrnaya M., Dyshlovoy S., Shubina L., Leychenko E., Kozlovskaya E., Jin J.-O, Kwak J.-Young, Bode A. M., Dong Z., Stonik V. // Toxicon. 2010. V. 55. P. 811–817.
9.The interaction of toxin from Radianthus macrodactylus with bilayer phospholipid membranes / Chanturiya A. N., Shatursky O. Ja., Lishko V. K., Monastyrnaya M. M., Kozlovskaya E. P. // Biol. Membr. 1990. V. 7. P. 763–769.
дипломов
Оставить комментарий