Статья опубликована в рамках: III Международной научно-практической конференции «Научные достижения биологии, химии, физики» (Россия, г. Новосибирск, 27 декабря 2011 г.)
Наука: Биология
Секция: Молекулярная биология
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
ФУНКЦИОНАЛЬНАЯ ЭКСПРЕССИЯ ИНГИБИТОРА СЕРИНОВЫХ ПРОТЕИНАЗ КУНИТЦ-ТИПА INHVJ ИЗ ТРОПИЧЕСКОЙ АКТИНИИ HETERACTIS CRISPA
Чаусова Виктория Евгеньевна
м. н. с. ТИБОХ ДВО РАН, г. Владивосток
E-mail: v.chausova@gmail.com
Табакмахер Валентин Михайлович
аспирант ТИБОХ ДВО РАН, г. Владивосток
E-mail: tabval@yandex.ru
Работа была выполнена в рамках госконтракта №16.512.11.2271 и поддержена грантом РФФИ №11-04-01179.
Выполнено клонирование и проведена функциональная экспрессия гена, кодирующего ингибитор сериновых протеиназ Кунитц-типа InhVJ, в клетках E. coli. Получен рекомбинантный ингибитор rInhVJ идентичный по своим физико-химическим характеристикам природному аналогу.
Ключевые слова: актиния, ингибитор протеиназ Кунитц-типа, функциональная экспрессия, рекомбинантный белок.
Исследование структурно-функциональных взаимосвязей полипептидов, структурно гомологичных ингибиторам протеиназ Кунитц-типа, является бурно развивающимся направлением современной биоорганической химии и ряда смежных наук. Это связано с уникальной ролью ингибиторов протеиназ в белковом обмене живых организмов, осуществляемой на уровне регуляции протеолитической активности протеиназ [3].
Около двадцати лет назад было установлено, что наряду с ингибированием активности сериновых протеиназ некоторые представители полипептидов семейства Кунитца, выделенные из ядовитых секретов пресмыкающихся, насекомых, моллюсков, а также кишечнополостных, обладают уникальной способностью модифицировать потенциал-зависимые калиевые Kv1.1, Kv1.2, и кальциевые Ca2+, участвующие во многих важных физиологических процессах организма [2].
Изучение природы полифункциональности полипептидов Кунитц-типа является актуальной задачей, поскольку с их функциями связан огромный потенциал полипептидов и как инструментов исследования биологических мишеней, и как селективных фармакологических препаратов направленного действия. Настоящая работа является частью исследований, проводимых в Тихоокеанском институте биоорганической химии ДВО РАН по изучению структуры и функции биологически активных полипептидов актиний.
Ранее из тропической актинии H. crispa (=Radianthus macrodactylus) сотрудниками лаборатории химии пептидов ТИБОХ ДВО РАН был выделен и охарактеризован нативный ингибитор сериновых протеиназ InhVJ, являющийся представителем семейства ингибиторов протеиназ Кунитц-типа [6].
Цель настоящей работы — создать экспрессионную конструкцию для функциональной экспрессии и оптимизировать условия выделения рекомбинантного ингибитора сериновых протеиназ rInhVJ Кунитц-типа.
Природный ингибитор InhVJ не доступен в препаративных количествах, поэтому для дальнейшего исследования была создана экспрессионная конструкция для получения его рекомбинантного аналога. Для создания экспрессионного вектора предпочтение было отдано вектору pET-32b(+), который, как известно, позволяет обеспечить правильную укладку рекомбинантного белка [5]. В качестве белка-партнера был выбран хорошо растворимый тиоредоксин (Trx), который обеспечивает наиболее высокий выход слитного (химерного) белка в растворе и правильность замыкания дисульфидных связей у цистеин-богатых белков [4], поскольку нативный InhVJ содержит в своей структуре 3 дисульфидные связи.
Ранее методами молекулярной биологии с использованием ген-специфичных праймеров была установлена нуклеотидная последовательность, а на ее основе выведена аминокислотная последовательность, кодирующая зрелый полипептид HCGS_1.27., идентичный нативному ингибитору Inh VJ. Далее нуклеотидная последовательность полипептида HCGS_1.27. (rInh VJ), содержащая на N-конце сайт для EcoRI рестриктазы, кодон метионина (Met) для последующего расщепления бромцианом (BrCN), а на C-конце - сайт для XhoI рестриктазы и стоп кодон (TAA), была субклонирована по сайтам рестрикции EcoRI и XhoI в составе T7-контролируемого оперона в вектор pET32b(+) (рис. 1). В связи с тем, что аминокислотная последовательность природного Inh VJ не содержит остатков Met, по которому происходит расщепление BrCN конечного слитного белка (метод химического расщепления пептидной связи бромцианом [1]), этот остаток был добавлен перед
последовательностью зрелого rInh VJ.
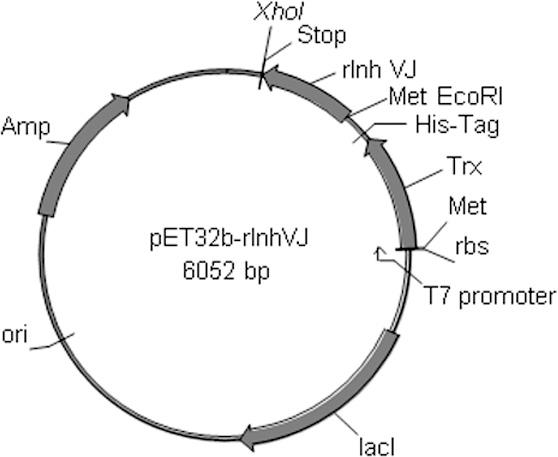
Рисунок 1. Физическая карта плазмиды pET-32b(+) –rInh VJ.
Функциональную экспрессию rInhVJ проводили в клетках E. coli штамма BL21(DE3) в составе слитного (гибридного) белка, содержащего последовательность Trxи полигистидиновый участок, аффинно связывающийся с Ni2+-содержащей смолой, для прокариотической экспрессии в виде растворимого химерного белка. Экспрессию химерного (гибридного, слитного) Trx-rInh VJ белка индуцировали добавлением изопропил–β-D-1-тиогалактопиранозида (ИПТГ).
В результате серии экспериментов были подобраны оптимальные условия для экспрессии слитного белка Trx-rInhVJ в растворимом виде и с высоким выходом: концентрация индуктора составила 0.2 мМ, температура инкубации культуры — 25°С, время инкубации — 12-14 часов. Электрофоретическое разделение в ДСН-ПААГ показало, что молекулярная масса продуцировавшегося гибридного белка Trx-rInhVJ cоставила 26512.6 Да, которая соответствовала расчетным данным (26512.6 Да) (рис. 2). Уровень экспрессии системы pET32b-rInhVJ в BL21(DE3) (общий выход) составил 16 мг гибридного белка с 1 литра клеточной культуры, что соответствует средней продуктивности pET-системы.
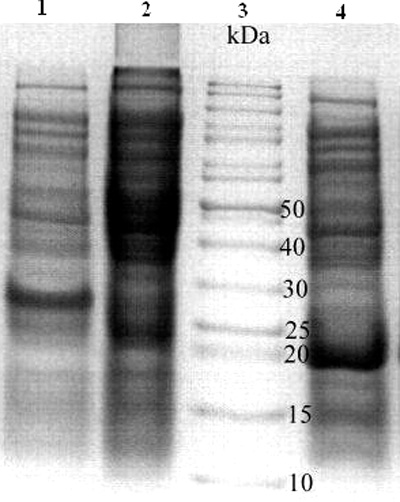
Рисунок 2. Электрофореграмма результатов экспрессии гибридного белка Trx-rInhVJ. Дорожка 1 — pET32b-rInhVJ; 2 — контроль (pET32b-rInh VJ без добавления ИПТГ); 3 — белки-стандарты молекулярной массы; 4 — контроль pET32b(+)-Trx.
Гибридный белок Trx-rInh VJ выделяли из растворимой фракции клеточного лизата на Ni2+-сорбенте в нативных условиях. Расщепление слитного белка на белок-носитель (Trx) и целевой полипептид (rInhVJ) по Metпроводили бромцианом в 0.5 М HClпо стандартной методике [1]. Целевой полипептид rInhVJ выделяли из гидролизата при помощи обращенно-фазовой ВЭЖХ чистоту и молекулярную массу определяли с помощью MALDI-TOF MSмасс-спектрометрии. Было установлено, что нативный и рекомбинантный полипептид имеет одинаковую хроматографическую подвижность и значение молекулярной массы (6112.6 Да). Выход целевого rInhVJ, согласно экспериментальным данным, составил 8 мг с 1 литра клеточной культуры. В настоящее время проводиться наработка рекомбинантного полипептида InhVJ с целью дальнейшего выяснения его биологической (в частности, ингибиторной и канал-модулирующей) активностей.
Таким образом, была получена экспрессионная конструкция гена ингибитора сериновых протеиназ Кунитц-типа, доказана способность системы BL21(DE3) — pET32b-rInh VJ продуцировать гибридный белок Trx-rInh VJ в растворимом виде, подобраны оптимальные условия для его экспрессии и выделен рекомбинантный ингибитор rInh VJ, идентичный по своим физико-химическим характеристикам нативному полипептиду.
Список литературы:
1.Andreev Y. A., Kozlov S. A., Vassilevski A. A., Grishin E. V. Cyanogen bromide cleavage of proteins in salt and buffer solutions // Anal. Biochem. 2010. V. 407. P. 144‑146.
2.Fry B. G., Roelants K., Champagne D. E., Scheib H., Tyndall J. D., King G. F., Nevalainen T. J., Norman J. A., Lewis R. J., Norton R. S., Renjifo C., de la Vega R. C. The toxicogenomic multiverse: convergent recruitment of proteins into animal venoms // Annu. Rev. Genomics Hum. Genet. 2009. V. 10. P. 483–511.
3.Joanitti G. A., Freitas S. M., Silva L. P. Proteinaceous Protease Inhibitors: Structural Features and Multiple Functional Faces. Current Enzyme Inhibition 2006. V. 2. P. 199-217.
4.McCoy J., Lavallie E. Expression and purification of thioredoxin fusion proteins // Curr. Protoc. Mol. Biol. 2001 Chapter 16: Unit16.8.
5.pET System Manual, Novagen. 10th Edition Rev. 2003.
6.Sokotun I. N., Leichenko E. V., Vakorina T. I., Es’kov A. A., Il’ina A. P., Monastyrnaia M. M., Kozlovskaia E. P. A serine protease inhibitor from the anemone Radianthus macrodactylus: isolation and physicochemical characteristics // Bioorg. Khim. 2007. V. 33. P. 448–455.
дипломов
Оставить комментарий