Статья опубликована в рамках: III Международной научно-практической конференции «Научные достижения биологии, химии, физики» (Россия, г. Новосибирск, 27 декабря 2011 г.)
Наука: Биология
Секция: Биохимия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
ГЕТЕРОЛОГИЧНАЯ ЭКСПРЕССИЯ, ВЫДЕЛЕНИЕ И ОЧИСТКА РЕКОМБИНАНТНОГО БЕЛКА HCT-A3 АКТИНИИ HETERACTIS CRISPA
Ткачева Екатерина Сергеевна
м. н. с. ТИБОХ ДВО РАН, г. Владивосток
E-mail: estkacheva@gmail.com
Работа выполнена при финансовой поддержке гранта РФФИ № 10-08-00316-а.
Актинопорины — пороформирующие токсины (~20 кДа), продуцируемые ядовитыми морскими кишечнополостными актиниями, являются уникальными белковыми молекулами, способными существовать как в водорастворимом, так и в мембраносвязанном состоянии, в котором они осуществляют свое мембранолитическое действие [3]. Каждая актиния синтезирует множество изоформ актинопоринов, обладающих различными видами биологической активности (токсической, антиопухолевой, кардиостимулирующей, дерматонекротической, антипаразитарной). В настоящее время уже описаны высоко гомологичные актинопорины, присутствующие совместно в одном виде-продуценте: например, стихолизины I, II из актинии Stichodactyla helianthus [6], эквинатоксины I, II, IV и V из актинии Actinia equina [4], множество изоформ магнификализинов из Heteractis magnifica [12]. Было показано, что каждый из токсинов кодируется своим собственным геном, и изоформы одного токсина формируют мультигенное семейство. Генетический аппарат актиний специально создан для выработки уникальных по природе и функциям полипептидов (фосфолипаз, ингибиторов семейства Кунитца, нейротоксинов) для защиты от внешних врагов и нападения на жертв. Предполагают, что роль такого биоразнообразия связана с эволюционной адаптацией вида.
Ранее из тропической актинии H. crispa(Radianthus macrodactylus) сотрудниками лаборатории химии пептидов ТИБОХ ДВО РАН было выделено в гомогенном состоянии и охарактеризовано четыре гомологичных актинопорина RTX-A, RTX-S, RTX-SII и RTX-G [5, 8, 11], которые обладают высокой гемолитической активностью. Недавно было обнаружено, что актиния H. crispaпродуцирует целое семейство актинопоринов Hct-S (18 членов) [2]. Для трех представителей этого семейства были получены функционально активные рекомбинантные формы белков [1, 2].
Цель настоящей работы — создать экспрессионную конструкцию для функциональной экспрессии нового представителя актинопоринов Hct-A3, получить рекомбинантный белок rHct-A3 и исследовать его свойства.
Для создания экспрессионной конструкции был выбран вектор на основе плазмиды рЕТ-41а(+). Выбор был обусловлен несколькими причинами. С одной стороны, этот вектор позволяет экспрессировать клонированный продукт в виде гибридного белка, содержащего GST-белок на N-конце, что необходимо для увеличения выхода растворимой формы белка. С другой стороны, гибридный белок содержит N-концевой 6*His-tag(для очистки гибридного белка с помощью аффинной хроматографии) и сайт рестрикции для энтеропептидазы (для отделения рекомбинантного актинопорина). Благодаря наличию lac-ингибитора создается возможность для экспрессии в клетках E. coli(Rosetta) токсичных для клетки актинопоринов.
Фрагмент ДНК, кодирующий зрелый белок актинопорина Hct-A3, получен в результате ПЦР с использованием генспецифичных праймеров Hct-Af5'-GGCTTTAGCTGGTACAATTATCGCGGGTGCA-3’ и Hct-Ar(5’- GGGGAAGCTTAGCGTGAGATCTTAATTTGCAGTAT-3’), фланкирующих последовательность актинопорина. В качестве матрицы использована кДНК H. crispa. К 5’-концу прямого праймера дополнительно присоединили нуклеотид G, чтобы сохранить сайт рестрикции для энтерокиназы. К обратному праймеру добавлена последовательность AAGCTT (сайт рестрикции для рестриктазы HindIII) и нуклеотиды CCCC.
ПЦР-фрагменты выделяли из агарозного геля (препаративный электрофорез), очищали, обработатывали рестриктазой HindIII, и после этого лигировали в экспрессионный вектор pET-41a(+) по сайтам рестрикции PShAIи HindIII(рис. 1).
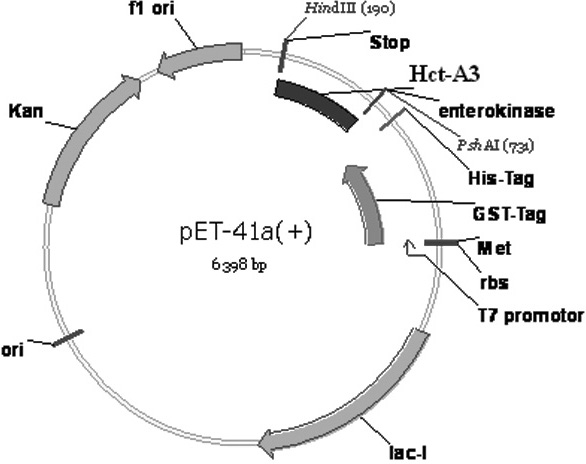
Рисунок 1. Физическая карта плазмиды pET-41a(+) – Hct-A3.
В результате проведения гетерологичной экспрессии получен предшественник рекомбинантного белка — гибридный белок (GST-rHct-A3), имеющий 6´His-tagна N-конце. Экспрессию гибридного белка (с молекулярной массой 52 кДа) индуцировали ИПТГ (изопропил-β-D-1-тиогалактопиранозидом). Клеточную массу наращивали в течение 3 часов при температуре 30ºС. Гибридный GST-rRTX-A3 был обнаружен как в клеточной массе, так и YT-среде, но в очень малом количестве (данные не представлены). Присутствие гибридных белков в клеточном лизате подтверждали ДСН-ПААГ электрофорезом (рис. 2, а.).
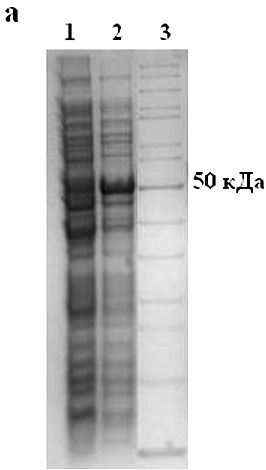
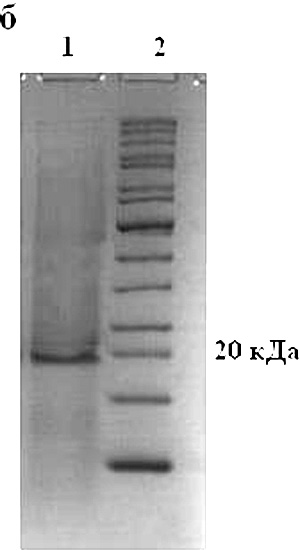
Рисунок 2. а — Электрофореграмма белков клеточного лизата после экспрессии: 1 -контроль (экспрессия pET41a(+)-hct-a3 без добавления ИПТГ); 2 – pET41a(+)-hct-a3; 3 — маркеры молекулярной массы. б — Электрофореграмма рекомбинантного актинопорина: 1 — rHct-А3; 2 — маркеры молекулярной массы.
Рекомбинантный актинопорин (rHct-A3) выделяли с помощью аффинной хроматографии на Ni-CAMагарозе с последующей обработкой белка энтеропептидазой (рис. 2, б). Общий выход rHct-A3 составил в среднем 4 мг с 1 литра клеточной культуры.
Расчетная молекулярная масса rHct-A3 составила 19,2 кДа, что соответствует значениям молекулярных масс нативных актинопоринов. Расчетное значение изоэлектрической точки составило 9,55, что характерно для рIактинопоринов RTX-A, RTX-S, RTX-SII, а также для большинства известных нативных представителей актинопоринов из других видов актиний (табл. 1).
Проверку гемолитической активности rHct-A3 осуществляли на человеческих эритроцитах. Было обнаружено, что активность rHct-A3 в полтора раза ниже активности нативных белков (табл. 1).
Таблица 1.
Физико-химические характеристики и биологическая активность актинопорина rHct-A3 и нативных актинопоринов RTX-A [5], RTX-SII [8], EqtII [10], StnII [9], HMgIи HMgII [7].
|
Актинопорин |
Молекулярная масса, кДа |
Изоэл. точка |
Гемолитическая активность, ГЕ/мг |
|
RTX-A |
~20000 |
~9.8 |
35000 |
|
rHct-A3 |
19,20* |
9.55* |
20000** |
|
RTX-S II |
19,28 |
10 |
36000 |
|
EqtII |
19,0 |
10,5 |
36000 |
|
StnII |
17,6 |
9,8 |
31000 |
|
HMgI |
19,0 |
9,4 |
36000 |
|
HMgII |
19,0 |
10,0 |
33000 |
* Расчетные значения по аминокислотной последовательности.
** Среднее значение трех независимых экспериментов.
Таким образом, в результате гетерологичной экспрессии в клетках E. coliбыл получен новый рекомбинантный актинопорин rHct-А3, физико-химические характеристики которого сравнимы с таковыми нативных актинопоринов.
Список литературы:
1.Ткачева Е. С. Функциональная экспрессия актинопорина RTX-S3, нового цитолитического токсина актинии Heteractiscrispa.// Вестник ДВО РАН. 2010. Т. 4. С. 134‑137.
2.Ткачева Е. С., Лейченко Е. В., Монастырная М. М., Исаева М. П., Зелепуга Е. А., Анастюк С. Д., Дмитренок П. С., Козловская Э. П. Новые актинопорины актинии Heteractiscrispa: клонирование и функциональная экспрессия. // Биохимия. 2011. Т. 10, С. 1387‑1397.
3.Anderluh G., Maček P. Cytolyticpeptideandproteintoxinsfromseaanemones(Anthozoa: Actiniaria) // Toxicon. 2002. V. 40. P. 111‑124.
4.Anderluh G., Križaj I., Štrukelj B., Gubenšek F., Maček P., Pungerčar J. Equinatoxins, pore-forming proteins from sea anemone Actinia equina, belong to a multigene family // Toxicon. 1999. V. 37, № 10. P. 1391–1401.
5.Il’ina A., Lipkin A., Barsova E., Issaeva M., Leychenko E., Gusev K., Monastyrnaya M., Lukyanov S., Kozlovskaya E. Amino acid sequence of RTX-A’s isoform actinoporin from the sea anemone, Radianthus macrodactylus // Toxicon. 2006. V. 47, № 5. P. 517–520.
6.Kem W. R., Dunn B. M. Separation and characterization of four different amino acid sequence variants of a sea anemone (Stichodactyla helianthus) protein cytolysin // Toxicon. 1988. V. 26, № 11. P. 997–1008.
7.Khoo K. S., Kam W. K., Khoo H. E., Gopalakrishnakone P., Chung M. C. M. Purification and partial characterization of two cytolysins from a tropical sea anemone, Heteractis magnifica // Toxicon. 1993. V. 31, № 12. P. 1567–1579.
8.Klyshko E. V., Issaeva M. P., Monastyrnaya M. M., Il’ina A. P., Guzev K. V., Vakorina T. I., Dmitrenok P. S., Zykova T. A., Kozlovskaya E. P. isolation, properties and partial amino acid sequence of a new actiniporins from the sea anemone Radianthus macrodactilus // Toxicon. 2004. V. 44, № 3. P. 315–324.
9.Lanio, M.E., Morera, V., Alvarez, C., Tejuca, M., Gómez, T., Pazos, F., Besada, V., Martínez, D., Huerta, V., Padrón, G., and Chávez, M. Purifcation and characterization of two hemolysins from Stichodactyla helianthus // Toxicon. 2001. V. 39, 187–194.
10.Maček P., Lebez D. Kinetics of hemolysis induced by equinatoxin, a cytolytic toxin from the sea anemone Actinia equina. Effect of some ions and pH // Toxicon. 1981. V. 19, № 2. P. 233–240.
11.Monastyrnaya M. M., Zykova T. A., Apalikova O. V., Shwets T. V., Kozlovskaya E. P. Biologically active polypeptides from the tropical sea anemone Radianthus macrodactylus // Toxicon. 2002. V. 40, № 8. P. 1197–1217.
12.Wang Y., Yap L. L., Chua K. L., Khoo H. E. A multigene family of Heteractis magnificalysins (HMgs) // Toxicon. 2008. V. 51. P. 1374–1382.
дипломов
Оставить комментарий