Статья опубликована в рамках: I Международной научно-практической конференции «Научные достижения биологии, химии, физики» (Россия, г. Новосибирск, 26 октября 2011 г.)
Наука: Химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
ВЛИЯНИЕ КАТИОНОВ ФОНОВОГО ЭЛЕКТРОЛИТА НА ПРОЦЕССЫ КОМПЛЕКСООБРАЗОВАНИЯ ИОНОВ ЖЕЛЕЗА В ВОДНЫХ РАСТВОРАХ ВАЛЕРИАНОВОЙ КИСЛОТЫ
Исмаилова Масуда Ахмедовна
к. х. н., доцент, Технологический университет Таджикистана, Республика Таджикистан, г. Душанбе
Сведения о состояния ионов железа в водных растворах, закономерностях его изменения в зависимости от различных факторов, необходимы при решении многих технических задач и при составлении моделей расчетов ионных равновесий в растворах. При изучении процессов, протекающих в растворах, за стандартное состояние принимаются растворы с высокой и постоянной ионной силой, поддерживаемой с помощью инертных солей. Однако, известно, что природа электролитов, применяемых в качестве фона, влияет на равновесия реакций образования комплексных соединений [1, с. 139–152]. Солевая среда может способствовать как увеличению, так и уменьшению закомплексованности центрального иона.
В ранней работе [2, с. 24–27], было исследовано влияние природы анионов фонового электролита на процессы комплексообразования в системе Fe(III) — Fe(II) — валериановая кислота — вода, в который показано что, замена анионов фона в ряду CIO4-, NO3-, CI-, SO42- приводит к уменьшению устойчивости комплексов, что особенно проявляется для трехядерного соединения.
Влияние анионов фонового электролита на процессы комплексообразования определяется их способностью к гидратации и образованию комплексных соединений.
Перхлорат-, нитрат-, хлорид-, и сульфат- ионы сами образуют ассоциаты с катионами трехвалентного железа, которые можно представить в виде:
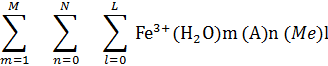
Замена анионов (А) солевой среды приводит к изменению состава ассоциатов. Увеличение склонности анионов фонового электролита к взаимодействую с металлом – комплексообразователем уменьшает закомплексованность железа (III) с ацидолигандами и ОН- группой в вышеприведенном ряду.
Исследование процессов комплексообразования Fe(III) и Fe(II) в водных растворах валериановой кислоты, содержащих различные анионы солевой среды, показали, что они оказывают конкурирующее влияние на области существования и константы устойчивости комплексов.
Настоящая работа посвящена изучению процессов комплексообразования Fe(III) и Fe(II) - в водных растворах валериановой кислоты методом окислительного потенциала [3, с. 129–218] и влияния природы катионов солевого фона на состав, области существования и константы устойчивости образующихся комплексов.
Исследования проводились в следующих системах:
Fe(III) - Fe(II) – НВал – Li(H)CI-H2O, (1)
Fe(III) - Fe(II) – НВал – Na(H)CI-H2O, (2)
Fe(III) - Fe(II) – НВал – K(H)CI-H2O, (3)
при температуре 298 К, ионная сила раствора 1,0 моль/л и концентрация валериановой кислоты 0,01 и 0,1 моль/л и при T = 298 K, CFe (Ш) - CFe(II) =1.10-4 моль/л.
При совместном анализе экспериментальных зависимостей окислительного потенциала от рН растворов, концентрации окисленной и восстановленной форм железа и концентрации кислоты установлено существование в водно-солевых растворах следующих комплексных соединений трех-и двухвалентного железа: Fe(OH)2+, FeL2+ , FeL2+ , FeLOH+ , Fe3L6(OH)2+ и FeL2+, а также в области малых значений рН и концентрации валериановой кислоты показано образование комплекса типа FeCI+2, который при возрастании рН разрушается.
Величина стандартного окислительного потенциала системы Fe(III) - Fe(II) HL+MeCI+H2O понижается при последовательной замене KCI на NaCI и LiCI.
Изменение природы фонового электролита не влияет на состав образующихся гидроксильных, карбоксильных и гидроксокарбоксильных комплексов железа. Однако, изменение катионов электролита сказывается на области существования однотипных по составу комплексов.
Значения констант устойчивости всех наиболее вероятных форм комплексных соединений рассчитаны с использованием окислительной функции Юсупова З. Н. [4, № TJ 295], которая применяется для расчета равновесий в растворах окислительно-восстановительных систем.
Для решения этой задачи по экспериментально измеренным значениям зависимостей окислительного потенциала от рН раствора по уравнению (1), было вычислены численные значения экспериментальной окислительной функции
![]() , (1)
, (1)
где: ![]() - экспериментальная окислительная функция; е – основание натурального логарифма; φ и φ0 – окислительный и стандартный окислительный потенциалы соответственно; υ – 2,303RT/F.
- экспериментальная окислительная функция; е – основание натурального логарифма; φ и φ0 – окислительный и стандартный окислительный потенциалы соответственно; υ – 2,303RT/F.
Используя общее уравнение окислительного потенциала:
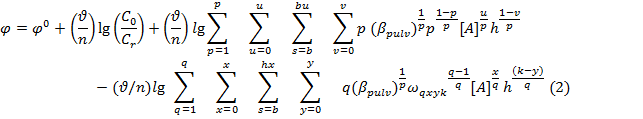
после преобразования получим уравнение теоретической окислительной функции:
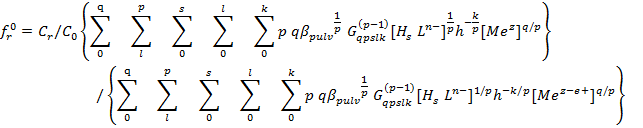
Для изученных систем (1), (2), (3), исходя из общей формулы [FeqFepHsLl(OH)k]z+, составляется стехиометрическая матрица ионного равновесия.
Таблица 1. Стехиометрическая матрица ионного равновесия системы
Fe (III) - Fe (II) – НВал-Н2О - МеCI
|
|
|
L |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
На основании уравнения (3) с учетом предполагаемых составов комплексов и сложением фрагментов уравнений получим для изучаемой системы уравнение теоретической окислительной функции.
Полученные результаты представляются в виде зависимости pfэ и pfт от рН. На основании предполагаемого состава соединений, приведенных в табл. 1, с помощью фрагментов уравнения для окислительной функции вычислены приближенные константы устойчивости комплексов.
Затем эти значения подставлялись в общее уравнение и по программе Excel методом итерации определялись константы устойчивости, которые обработаны статистически с помощью программы Sigma Plot-10. Приближение констант устойчивости проводилось до совпадения теоретической функции с экспериментальной в пределах погрешности измерений, то есть ±1-3 мв. Результаты вычислений приведены в табл. 2.
Из данных, приведенных в таблице, следует, что замена катионов фона в ряду Li+, Nа+, К+ приводит к уменьшению устойчивости валератных и гидроксовалератных комплексов.
Таблица 2. Значения логарифма констант устойчивости комплексных соединений
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Влияние катионов фонового электролита на процессы комплексообразования определяется их способностью к гидратации и разрушению ассоциатов металла-комплексообразователя с молекулами растворителя.
Следовательно, сравнение устойчивости одинаковых по составу комплексных соединений, определенных при постоянной ионной силе раствора, можно проводить только при использовании в качестве фонового электролита одной и той же соли.
Список литературы:
1.Антонович В. П., Назаренко В. А., Невская Е. М. Гидролиз ионов металлов в разбавленных растворах. М.: Атомиздат, 1979. - с. 139–152.
2.Исмоилова М. А. Влияние анионов фонового электролита на комплексообразования ионов железа в водных растворах валериановой кислоты. Вестник Технологического университета Таджикистана, № 4. Душанбе: Ирфон, 2011. – с. 24–27.
3.Пальчевский В. В., Якубов Оксредметрия Х. М. Л.: Химия, 1975. – с. 129–218.
4.Юсупов З. Н. Способ определения состава и констант образования координационных соединений. Патент РТ. TJ 295. бюлл. № 21. 2001. 6 с.
дипломов

Оставить комментарий