Статья опубликована в рамках: XXXIII Международной научно-практической конференции «Современная медицина: актуальные вопросы» (Россия, г. Новосибирск, 09 июля 2014 г.)
Наука: Медицина
Секция: Патологическая анатомия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
Статья опубликована в рамках:
Выходные данные сборника:
ВЛИЯНИЕ ГИПОТЕРМИИ НА РЕМОДЕЛИРОВАНИЕ ТРАБЕКУЛЯРНОЙ КОСТИ КРЫС
Пошелок Денис Михайлович
младший научный сотрудник лаборатории морфологии соединительной ткани, ДУ «Институт патологии позвоночника и суставов им. проф. М.И. Ситенко НАМН Украины», Украина, г. Харьков
Дедух Нинель Васильевна
д-р биол. наук, профессор, зав. лаборатории морфологии соединительной ткани, ДУ «Институт патологии позвоночника и суставов им. проф. М.И. Ситенко НАМН Украины», Украина, г. Харьков
E-mail:
Малышкина Светлана Владимировна
канд. биол. наук, зав. лаборатории экспериментального моделирования, ДУ «Институт патологии позвоночника и суставов им. проф. М. И. Ситенко НАМН Украины», Украина, г. Харьков
EFECT OF HYPOTHERMIA ON RAT TRABECULAR BONE REMODELING
Denis Poshelok
junior Researcher, Laboratory of connective tissue morphology, Sitenkо Institute of Spine and Joints Pathology National Academy of Medical Sciences of Ukraine, Ukraine, Kharkiv
Ninel Dedukh
doctor of biology Sciences, Professor, Head of Laboratory of connective tissue morphology, Sitenkо Institute of Spine and Joints Pathology National Academy of Medical Sciences of Ukraine, Ukraine, Kharkiv
Svetlana Malyshkina
candidate of biology Sciences, Head of Laboratory experimental modeling, Sitenkо Institute of Spine and Joints Pathology National Academy of Medical Sciences of Ukraine, Ukraine, Kharkiv
АННОТАЦИЯ
Влияние гипотермии на системы организма широко исследуется, но особенности ремоделирования кости не изучены. В работе использованы морфологические, электронномикроскопические и морфометрические методы исследования. Исследовали дистальные метафизы бедренных костей 28 белых лабораторных крыс с индуцированной гипотермией. Установлено, что гипотермия вызывает нарушение структурной организации костной ткани по типу остеопении и приводит к дисбалансу ремоделирования кости с преобладанием процесса резорбции. Состояние гипотермии можно рассматривать как фактор риска развития остеопении и остеопороза.
ABSTRACT
Effect of hypothermia on various systems of organism has been investigated, but the action of hypothermia on bone remodeling has not been studied. We used morphological, morphometric and electron microscopic methods. The distal femoral metaphyses of 28 white laboratory rats with induced hypothermia were investigated. The hypothermia causes a disturbance of the structural organization of bone tissue as osteopenia and causes an imbalance of bone remodeling with a predominance of processes resorption was founded. Hypothermic state can be regarded as a risk factor for osteopenia and osteoporosis.
Ключевые слова : гипотермия; ремоделирование костной ткани; эксперимент; крыса.
Keywords: hypothermia; remodeling of bone tissue; experiment; rat.
Введение. Одной из актуальных проблем биологии и медицины является изучение влияния гипотермии на организм. Индуцированную гипотермию используют в клинической практике для сохранения функционирования клеток и снижения риска развития патологического процесса [5, 11, 12, 14, 17, 18]. Кроме того, действие некоторых фармакологических препаратов также может привести к состоянию гипотермии, что требует детального исследования влияния этого фактора на системы организма [6, 15]. Гипотермия — состояние организма, при котором температура тела падает ниже, необходимой для поддержания нормального обмена веществ и функционирования. Для человека гипотермия — патологическое состояние, обусловленное снижением внутренней температуры тела до 35 оС и меньше. У животных снижение темепературы тела до 30 оС обуславливает, по классисфикации J.S. Tuli [24], легкую (mild) гипотермию. Если показатели температуры тела находятся в пределах от 22 оС до 30 оС, классифицируют умеренную (moderate) гипотермию, а ниже 22 оС — тяжелую (severe).
В основном массиве представленной научной литературы описаны физиологические изменения, которые происходят в условиях гипотермии. Однако практически отсутствуют данные об особенностях ремоделирования костной ткани в условиях гипотермии. Ремоделирование — это основной процесс перестройки костной ткани, происходящий за счет резорбции, осуществляемой остеокластами, и костеобразования с участием остеобластов. Эти два процесса синхронизированы во времени и в физиологических условиях обеспечивают как структурно-поддерживающую функцию скелета, репарацию микроповреждений, так и выполнение метаболической роли в минеральном гомеостазе. Ежегодно ремоделированию подвергается 2—10 % скелета, наиболее активно в этот процесс вовлечена губчатая кость [16], в связи с чем, она была выбрана нами в качестве объекта исследования после холодового воздействия на белых лабораторных крысах.
Цель исследования: изучить ремоделирование костной ткани в дистальных метафизах бедренной кости крыс в условиях гипотермии.
Материал и метод. В соответствии с правилами протокол исследования был одобрен Комитетом по биоэтике Государственного учреждения «Институт патологии позвоночника и суставов Национальной академии медицинских наук Украины» (протокол № 88 от 30 мая 2011 года) в соответствии с Европейской конвенцией о защите позвоночных животных... [3].
Материалом для исследования служили дистальные метафизы бедренных костей 28 белых лабораторных крыс 6-месячного возраста, которые были разделены на две группы. Животных первой группы (опыт) помещали в холодильную камеру (t = -20 ºС) на 5 часов ежедневно в течение 5 суток. Крысы находились в отсеках камеры в одиночку. Ректальную температуру измеряли ежедневно в начале и конце опыта. Средние значения ректальной температуры после 25 часового пребывания в холодильной камере составили 35,0—36,5 oС (в норме у крыс температура тела составляет 38,0—39,0о С [4]. После холодового воздействия крыс возвращали в экспериментально-биологическую клинику, где их содержали при температуре 18—20 оС.
Животных второй группы (контроль) содержали в течение 5 часов ежедневно (5 суток) в одиночных клетках в экспериментально-биологической клинике при температуре 18—20 оС, после чего возвращали к обычному групповому режиму в клетках.
Животных выводили из эксперимента через 3, 14 и 28 суток после последнего сеанса холодового воздействия путем передозировки тиопентала натрия.
Для гистологического исследования фрагменты бедренной кости крыс фиксировали в 10 % нейтральном формалине, декальцинировали в 4 %-ной азотной кислоте, обезвоживали в спиртах восходящей крепости и заливали в целлоидин [10]. Гистологические срезы окрашивали гематоксилином и эозином, анализ проводили под световым микроскопом «Axiostar Plus» (Carl Zeiss). Для электронной микроскопии кусочки костной ткани (1 мм3) префиксировали в 5 % фиксаторе Карновского, декальцинировали в ЭДТА. Образцы фиксировали в 1 % растворе четырехокиси осмия, обезвоживали в спиртах восходящей крепости и ацетоне заливали в эпон-аралдит. Полутонкие срезы окрашивали по методу Aparizio [13]. Ультратонкие срезы (50—60 мкм) контрастировали по методу Рейнольдс [23] и анализировали с помощью электронного микроскопа ЭМВ-100БР.
Морфометрические исследование проведены согласно рекомендациям Г.Г. Автандилова [1]. Для оценки ремоделирования костной ткани использовали следующие показатели [9]:
Объем (условные единицы) костной ткани (костные трабекулы и костный мозг) оценивали на площади 25 мм2 (ок. 10, об. 10) в пяти полях зрения микроскопа («Axiostar Plus») на трех препаратах (n=15);
·объем трабекулярной кости (%) (отношение объема костных трабекул к объему костной ткани умноженное на 100 %);
·количество лакун с остеоцитами и пустых лакун в поле зрения микроскопа («Axiostar Plus») (ок. 10, об. 40);
·количество пустых резорбционных полостей на костных трабекулах на площади 25 мм2 (ок. 10, об. 10);
·количество резорбционных полостей на костных трабекулах, содержащих остеокласты, на площади 25 мм2 (ок. 10, об. 10);
·количество резорбционных полостей на костных трабекулах, содержащих остеобласты и макрофаги на площади 25 мм2 (ок. 10, об. 10).
Полученные цифровые показатели обработаны методами вариационной статистики с использованием t-критерия Стьюдента. Статистически значимой считали разницу при Р<0,05.
Результаты. Микроскопический анализ гистологических препаратов дистальных метафизов бедренных костей контрольных животных показал, что губчатая кость, расположенная между зоной роста и областью диафиза, была представлена сетью костных трабекул с высокой плотностью остеобластов на краевой поверхности и остеоцитов в толще трабекул. В популяции остеоцитов обнаружены лишь единичные клетки с признаками деструкции. На наружной поверхности отдельных костных трабекулах располагались выстилающие клетки уплощенной формы, других — крупные остеобласты полигональной формы с гипохромным ядром и базофильной цитоплазмой, что свидетельствует об их метаболической активности, связанной с биосинтезом макромолекул, принимающих участие в формировании остеоида.
На краевой поверхности костных трабекул обнаружены базисные мультиклеточные единицы (basic multicellular units), структура которых зависела от стадии ремоделирования костной ткани. Так, на стадию активации указывало наличие в полостях резорбции остеокластов, имеющих 3 и более ядер (рис. 1). Обычно области остеокластической резорбции присутствуют в отделах кости с гибнущими остеоцитами, сигнал от которых служит начальным проявлением активации остеокластов.
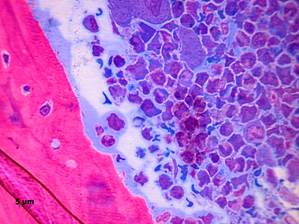
Рисунок 1. Очаг ремоделирования костной ткани. Пустые остеоцитарные лакуны. Остеокласт в области резорбции. Контроль. Полутонкий срез. Окраска по Aparizio, х1000
Местами располагались резорбционные полости, заполненные остеобластами, что свидетельствует о переходе процесса ремоделирования от стадии активации к стадии формирования.
У опытных животных на 3 сутки после холодового воздействия нередко в расширенных костных лакунах с неровными зазубренными краями располагались остеоциты с нарушенной структурой ядра и цитоплазмы (рис. 2). Отмечены пустые лакуны без остеоцитов.
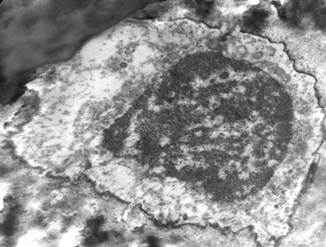
Рисунок 2. Деструкция остеоцита . Опыт. Контрастирование по Рейнольдсу, х6000
На краевой поверхности костных трабекул обнаружены остеобласты в состоянии различной метаболической активности. Большинство из них имело пикнотичные ядра и деструктурированную цитоплазму. Характерных для ремоделирования кости резорбционных полостей, заполненных остеокластами или остеобластами, не выявлено. Это может быть связано с гибелью части клеток вследствие действия гипотермии и замедлением их восстановления.
Матрикс костных трабекул имел неравномерную окраску — наряду с однородной фуксинофильной окраской, присутствовали выражено базофильные цементные линии.
В связи с тем, что предшественниками остеобластов являются стромальные клетки костного мозга, был исследован его состав после холодового воздействия. В межтрабекулярных пространствах располагались клетки красного костного мозга с признаками лизиса. У мегакариоцитов ядра либо отсутствуют, либо были представлены микроформами. Репаративные проявления были связаны с формированием полихроматофильных мегакариоцитов — крупных клеток с лопастным ядром и цитоплазмой, заполненной зернистым содержимым — мелкими гранулами (рис. 3). Часть лимфоцитов содержали лизированные ядра, однако большинство сохраняли характерную форму ядра и цитоплазмы, что свидетельствует о восстановительном процессе. В кровеносных сосудах красного костного мозга обнаруживали столбики склеенных эритроцитов — отмечался сладж-синдром. Нейтрофилы имели характерное строение — округлую форму и сегментированное ядро.

Рисунок 3. Полутонкий срез. Пустые лакуны без остеоцитов в костном матриксе кости. Очаги л изиса матрикса кости. Пустые полости резорбции. Полихроматофильные мегакариоциты, нейтрофилы в межтрабекулярных пространствах. Опыт. Окраска по Aparizio. х1000
В цитоплазме остеобластов, расположенных на поверхности неминерализованного остеоида, присутствовали признаки отека, проявляющиеся набуханием канальцев гранулярной эндоплазматической сети (гЭПС). Полости таких канальцев характеризовались низкой электронной плотностью, что указывает на заполнение их отечной жидкостью.
14 сутки после гипотермии. На данный срок исследования в губчатой кости метафизов бедренных костей опытных животных сохранялись деструктивные нарушения. На значительном протяжении поверхность костных трабекул была покрыта слоем уплощенных покоящихся остеобластов с небольшим гетерохроматизированным ядром и узким ободком слабо организованной цитоплазмы. Встречались обширные участки костной поверхности без остеобластов — «оголенная» кость — что, по-видимому, связано с их гибелью. На поверхности костных трабекул сохранялись пустые лакуны без остеоцитов или лакуны, заполненные детритом. Наряду с этим, в лакунах присутствовали остеоциты, характеризующиеся различной окраской ядер — от слабо базофильной до выраженно базофильной. Ультраструктурная организация остеоцитов нарушена. В них отмечено формирование расширенных перинуклеарных пространств, заполненных гранулярным содержимым (рис. 4), что может свидетельствовать о нарушении ядерно-цитоплазматического транспорта. На участках кариолемма разрушена. В цитоплазме таких остеоцитов обнаружены обширные очаги лизиса, как отражение деструкции мембранных и немембранных органелл. Кроме того, выявлены остеоциты с гетерохроматизацией ядра и нарушением целостности плазматической мембраны. В цитоплазме остеоцитов была отмечена низкая плотность мембранных органелл, очаги деструкции вариабельных размеров и участки гомогенизации цитоплазмы.
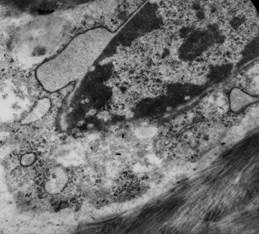
Рисунок 4. Остеоцит. Локальный лизис кариолеммы и плазматической мембраны. Область дилатации перинуклеарного пространства. Контрастировано по Рейнольдсу. х 15600
В костной ткани метафизов бедренных костей животных, подвергшихся холодовому воздействию, на данный срок исследования были выявлены и репаративные проявления. На поверхности костных трабекул, нередко покрытых слоем неминерализованного остеоида, располагались единичные остеобласты, в цитоплазме которых отмечена развитая гЭПС в виде параллельно ориентированных канальцев с рибосомами на поверхности. Однако у большинства остеобластов гЭПС была фрагментирована, содержала расширенные канальцы в виде полостей, переполненных продуктами биосинтеза, что свидетельствует о нарушении цитоплазматического транспорта. Встречались остеобласты с миелиновыми фигурами в цитоплазме, являющимися результатом деструкции фосфолипидов мембран, а также имеющие небольшие очаги деструкции цитоплазмы.
На поверхности костных трабекул были обнаружены также и остеокласты. Они находились в состоянии функциональной активности, о чем свидетельствует наличие в клетках нескольких ядер, в которых в центральных отделах преобладал эухроматин, а по периферии ядра располагался гетерохроматин. Остеокласты имели сформированную гофрированную каемку, псевдоподии которой непосредственно контактировали с резорбируемой минерализованной костью. В цитоплазме остеокластов выявлено большое количество округлых и овальных митохондрий, вакуолей, фагосом и вторичных лизосом.
Вблизи костных трабекул в красном костном мозге также встречались остеокласты, которые находились на стадии формирования. Такие клетки содержали множество вакуолей и фагосом в цитоплазме, однако они не имели непосредственного контакта с костной поверхностью.
28 сутки после гипотермии. При исследовании полутонких срезов фрагментов кости опытных животных на костных трабекулах обнаружено повышение плотности резорбционных полостей, в которых располагались остеокласты, содержащие 2—3 ядра (рис. 5). Отмечено также увеличение количества остеобластов удлиненной формы, содержащими ядра с рыхлым хроматином, на наружной поверхности костных трабекул (рис. 6). Однако и на этот срок в костных трабекулах сохранялись пустые лакуны без остеоцитов, трещины и щели, неравномерная окраска матрикса.
В красном костном мозге зафиксированы репаративные проявления. На этот срок исследования клетки костного мозга, в основном, сохраняли нормальную организацию. Мегакариоциты имели четкие ядра, были заполнены гранулами.
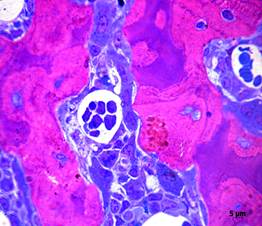
Рисунок 5. Полутонкий срез. Остеокласты на поверхности костных трабекул. Окраска по Aparizio, х1000
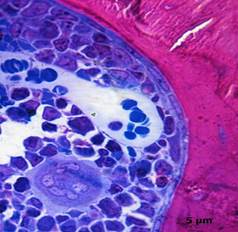
Рисунок 6. Полутонкий срез. Слой остеобластов на поверхности костной трабекулы. Гемокапилляр синусоидного типа и мегакариоцит в красном костном мозге. Окраска по Aparizio, х1000
В гемокапиллярах костного мозга сохранялось нарушение микроциркуляции – в сосудах отмечено прилипание эритроцитов друг к другу, что приводит к повышению вязкости крови и затрудняет ее перфузию через микрососуды.
Для оценки характера ремоделирования кости были проведены морфометрические исследования (табл. 1).
Таблица 1.
Показатели ремоделирования губчатой кости у крыс (28 сутки после холодового воздействия)
|
Показатели |
Контрольные животные |
Опытные животные |
Достоверность |
|
Объем костной ткани (костные трабекулы и костный мозг, ус. ед.), n=15 |
123,93±4,06 |
119,53±5,57 |
НД |
|
Объем трабекулярной кости (%), n=15 |
63,8±3,41 |
53,64±3,57 |
p<0,05 |
|
Количество лакун с остеоцитами в поле зрения микроскопа, n=15 |
53,31±3,37 |
44,32±2,15 |
p<0,05 |
|
Пустые лакуны остеоцитов в поле зрения микроскопа, n=15 |
2,23±0,36 |
16,68±0,73 |
p<0,001 |
|
Количество пустых резорбционных полостей |
6,94±0,59 |
15,38±1,71 |
p<0,01 |
|
Количество резорбционных полостей с остеокластами |
3,43±0,41 |
10,25±0,96
|
p<0,01 |
|
Количество резорбционных полостей, заполненных макрофагами или остеобластами |
5,09±0,45
|
3,61±0,44
|
p<0,05
|
P — статистически достоверные отличия показателей опытных крыс от контроля
Как видно из таблицы, у животных на 28 сутки после холодового воздействия в дистальном метафизе бедренной кости объем костной ткани на исследованной площади статистически не отличался от показателей контроля, однако объем трабекулярной кости был снижен на 6,6 %. У животных опытной серии количество остеоцитов на костных трабекулах было на 16,9 % ниже по сравнению с контрольными, а пустых лакун без остеоцитов, было больше на 33,4 %. Зафиксировано также повышение относительно показателей контроля пустых полостей резорбции (на 54,5 %), которые располагались по краевой поверхности костных трабекул, а также полостей резорбции, заполненных остеокластами (на 66,5 %), что свидетельствует об усилении остеокластической резорбции. Костеобразование было снижено, о чем свидетельствует низкая плотность полостей резорбции с макрофагами или остеобластами. Их количество было ниже, чем в контроле на 29,1 %.
Обсуждение. Холодовое воздействие на животных в течение 5 суток по 5 часов в день, приводит к выраженным структурным перестройкам губчатой кости на сроки исследования. Частичная гибель клеток красного костного мозга и низкий уровень репарации на ранние сроки отражается на формировании остеобластов и остеокластов из клеток-предшественников. На все сроки наблюдения отмечено уменьшение на поверхности костных трабекул метаболически активных остеобластов. В литературе также имеются данные о том, что гипотермия негативно влияет на остеобласты. Так, при исследовании культуры остеобластов, которую подвергали холодовому воздействию при температуре 35,5 оС и 34 оС в течение 14 суток культивирования, показано угнетение пролиферации и дифференциации клеток [21]. Количество остеобластов в культуре через 14 суток культивирования в условиях умеренной гипотермии (35,5о С) снизилось на 30 %, а формирование ими костных узелков уменьшилось на 75 %. В результате воздействия на культуру остеобластов низкой температуры (34 оС) количество костных узелков уменьшилось на 95%. В культивированных остеобластах наблюдали также снижение биосинтеза щелочной фосфатазы, остеокальцина и коллагена I типа.
В нашем исследовании in vivo была зафиксирована гибель остеоцитов на все сроки наблюдения, что, безусловно, отражается на метаболических показателях костной ткани. Известно, что остеоциты имеют рецепторы к паратгормону и принимают участие в остеолизе, выступая регуляторами минерального гомеостаза [15, 19, 20] Однако по сравнению с остеокластами их резорбтивная функция значительно ниже. Также известна и другая функция остеоцитов — остеопластическая, в которой участвует щелочная фосфатаза, остеокальцин, инсулиноподобный фактор роста-1, синтезируемые остеоцитами [20]. Однако в нашем исследовании эта функция остеоцитов не была выявлена. Кроме того, остеоциты являются механосенсорными клетками, снижение их количества и нарушение функционального состояния отражается на прочностных качествах кости, что может явиться предпосылкой перелома [21].
Установленное в нашем исследовании повышение на костных трабекулах опытных животных после холодового действия числа резорбционных полостей, заполненных остеобластами, согласуется с данными литературы. Так, установлено, что при культивировании мононуклеарных предшественников остеокластов на дисках из слоновой кости с добавлением M-CSF (колониестимулирующего фактора роста макрофагов) и RANKL (лиганда рецептора активатора ядерного фактора kВ) в течение 14 суток, количество остеокластов было значительно большим в культурах после воздействия как легкой (35 оС), так и умеренной (34оС) гипотермии [22]. Увеличенной была и площадь резорбции дисков, на которых культивировали мононуклеарные клетки-предшественники остеокластов. Это свидетельствует о дифференцировке и активации остеокластов. Более выраженные изменения в культурах наблюдали при воздействии температуры 34 оС. Количество остеокластов и лакун резорбции увеличилось в 1,5 и 2,0 раза.
После действия гипотермии зафиксирован сладж-синдром, который возникает при заболеваниях, сопровождающихся увеличением в крови фибриногена и глобулинов и снижением содержания альбуминов (сахарный диабет, миеломная болезнь, ишемическая болезнь сердца), а также при гипотермии и обморожениях [7, 8]. Прогрессирование таких нарушений приводит к запустению капилляров и нарушению питания костной ткани. В норме микроциркуляторное русло кости обеспечивает циркуляторно-метаболическое соответствие в костной ткани, в условиях которого отмечается равновесие процессов костеобразования и остеорезорбции [2]. Это способствует постепенному и постоянному восстановлению (физиологическое ремоделирование) костной ткани без изменения ее количества. Микроциркуляторное русло кости поддерживает парциальное давление кислорода в тканевой жидкости и выполняет функцию доставки питательных и регуляторных веществ в клетки. Известно, что костеобразование может происходить только при наличии кислорода, то есть деструктивные изменения в микроциркуляторном русле кости сопровождаются нарушением процесса дифференциации клеток-предшественников в остеогенном направлении, угнетением метаболизма клеток кости (остеоцитов и остеобластов), задержкой процессов регенерации кости и нарушением процессов ремоделирования.
Вывод. Под действием холодового воздействия, приводящего к гипотермии, зафиксировано снижение костеобразования, о чем свидетельствует уменьшение на поверхности костных трабекул метаболически активных остеобластов и повышение плотности «покоящихся» остеобластов. Отмечен высокий процент гибели остеоцитов. Выявлено также повышение пустых полостей резорбции на поверхности костных трабекул, а также полостей резорбции, заполненных остеокластами, что свидетельствует об усилении остеокластической резорбции. Проведенное исследование показало, что состояние гипотермии можно рассматривать как фактор риска развития остеопении и остеопороза.
Список литературы:
1.Автандилов Г.Г. Медицинская морфометрия: [руководство] / Г.Г. Автандилов. М.: Медицина, 1990. — 384 с.
2.Бруско А.Т., Гайко Г.В. Функциональная перестройка костей и ее клиническое значение. Луганск, 2005. — 212 с.
3.Европейская конвенция о защите позвоночных животных, используемых для экспериментов или в иных научных целях. Страсбург, 18 марта 1986 года. — [Электронный ресурс] — Режим доступа. — URL: http://conventions.coe.int/Treaty/rus/Treaties/Html/123.htm (дата обращения 07.06.2014).
4.Западнюк И.П., Западнюк В.И., Захария Е.А., Западнюк Б.В. Лабораторные животные. Киев: Вища школа, 1983. — 391 с.
5.Колінко Я.О. Стан провідникового апарату та мікроциркуляторного русла сідничного нерва щура на сьому добу після дії загальної глибокої гіпотермії // Український морфологічний альманах — 2010. — Том. 8, — № 2. — С. 91—94.
6.Мищук Н.Е. Холодовая болезнь (гипотермия) // Медицина неотложных состояний. — 2006. — Т. 4, — № 5. — С. 42—47.
7.Патология микроциркуляции. Сладж-синдром — [Электронный ресурс] — Режим доступа. — URL: http://www.medkurs.ru/lecture3k/ph/pp7/5630.html (дата обращения 10.06.2014).
8.Патологическая физиология: учебник по медицине / Патология микроциркуляции — [Электронный ресурс] — Режим доступа. — URL: http://www.medichelp.ru/posts/view/5260) (дата обращения 12.06.2014).
9.Ревелл П.А. Патология кости. М.: Медицина, 1993. — 367 с.
10.Саркисов Д.С. Микроскопическая техника. Руководство. М.: Медицина, 1996. — 544 с.
11.Усенко Л.В., Царев А.В. Искусственная гипотермия в современной реаниматологии // Общ. реаниматол. — 2009. — Т. 5, — № 1. — С. 21—23.
12.Шевелёв О.А., Бутров А.В. Технологии лечебной гипотермии в интенсивной терапии и реаниматологии // Неотложная медицина 2010. № 3 — [Электронный ресурс] — Режим доступа. — URL: http://www.critical.ru/emergency/page.php?what=article&chapter=2010_03&ref=07 (дата обращения 10.06.2014).
13.Aparizio S.R., Marsden P. Rapid metilen blue basic stain for semi-thin section of periferial nevral tissue // J. Microscopic. — 1969. — Vol. 89. — P. 139—141.
14.Connolly E., Worthley L.I.G. Induced and Accidental Hypothermia // Critical Care and Resuscitation. — 2000. — Vol. 2. — P. 22—29.
15.Cullinane D.M. The role of osteocytes in bone regulation: mineral homeostasis versus mechanoreception // J Musculoskel Neuron Interact. — 2002. — Vol. 2. — P. 242—244.
16.Faust G. Bone remodeling : A new Approach // University of Stuttgart, June. 2000. — P. 210.
17. Frink M., Flone S., van Griensven M. et al. Facts and fiction: the impact of hypothermia on molecular mechanism following major challenge // Mediators of inflammation. — 2012. — Vol. 2012. — P. 13.
18.Hudson K. Hypothermia in Trauma; Friend or Foe? — [Электронный ресурс] — Режим доступа. — URL: http://dynamicnursingeducation.com/class.php?class_id=141&pid=11 (дата обращения 13.06.2014).
19.Mason D.J., Hillman R.A., Skerry T.M. Constitutive in vivo mRNA expression by osteocytes of beta-actin, osteocalcin, connexin-43, IGF-I, c-fos and c-jun, but not TNF-alpha nor tartrate-resistant acid phosphatase // J. Bone Miner. Res. — 1996. — Vol. 11. — P. 350—357.
20.Noble B.S., Reeve J. Osteocyte function, osteocyte death and bone fracture resistance // Molecular and Cellular Endocrinology. 2000. — P. 7—13.
21.Patel J.J., Talbot D., Orriss I.R. et al. Osteoblast differentiation and bone formation are retarded in hypothermia // Bone. — 2010. — Vol. 47. — P. 129—130.
22. Patel J.J., Utting J.C., Key M.L. et al. Hypothermia inhibits osteoblast differentiation and bone formation but stimulates osteoclastogenesis // Exp Cell Res. — 2012. — Vol. 318. — № 17. — Р. 2237—2244.
23.Reynolds E.S. The use of lead citrate at high ph an electrono–paque stain in electron microscopy/ E.S. Reynolds // J. Cell Biol. — 1963. — Vol. 17. — P. 208—212.
24.Tuli J.S., Gilbert R.C. Hypothermia in animals — [Электронный ресурс] — Режим доступа. — URL: http://dynamicnursingeducation.com/class.php?class_id=141&pid=11http://www.hypothermia.org/animalhypo.htm (дата обращения 14.06.2014).
дипломов


Оставить комментарий