Статья опубликована в рамках: XXVIII Международной научно-практической конференции «Современная медицина: актуальные вопросы» (Россия, г. Новосибирск, 12 февраля 2014 г.)
Наука: Медицина
Секция: Клиническая лабораторная диагностика
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
МОДЕЛИРОВАНИЕ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ ПЕРЕКИСНОГО ОКИСЛЕНИЯ ЛИПИДОВ
Денисова Евгения Владимировна
канд. биол. наук, доцент СКФУ, РФ, г. Ставрополь
Андрусенко Светлана Федоровна
канд. биол. наук, доцент СКФУ, РФ, г. Ставрополь
MODELLING OF LABORATORY RESEARCHES OF LIPIDS PEROXIDATION
Evgeniya Denisova
candidate of Biological Science, associate professor of North-Caucasian federal University, Russia, Stavropol
Svetlana Andrusenko
candidate of Biological Science, associate professor of North-Caucasian federal University, Russia, Stavropol
АННОТАЦИЯ
Целью исследования является моделирование процесса стандартизации перекисного окисления липидов в различных условиях. Модельные системы комбинировались из растворов карбонильных соединений, эмульсии липидов и липосом. Концентрацию продуктов ПОЛ определяли спектрофотометрически. В результате определили зависимость между степенью окисления и временем процесса.
ABSTRACT
Research objective is modeling of process of standardization of lipids peroxidation in various conditions. Model systems were combined from solutions of carbonyl connections, an emulsion of lipids and liposomes. Concentration of products of oxidation defined spectrophotometry. As a result defined dependence between the oxidation level and process time.
Ключевые слова: перекисное окисление липидов; модельные системы, липосомы.
Keywords: lipids peroxidation; model systems, liposomes.
Функциональная активность живых организмов напрямую зависит от процессов свободно-радикального окисления (СРО) и интенсивности продукции активных форм кислорода (АФК). Предотвратить окислительное повреждение или нормализовать развившийся дисбаланс можно применением природных или синтетических антиоксидантов (АО).
Оценка взаимосвязи химической структуры АО с его эффективностью позволит создавать лекарственные препараты с заранее заданными свойствами, нейтрализующими свободные радикалы различной природы, либо включающиеся в СРО на определенных стадиях.
Разработка модельных систем перекисного окисления липидов (ПОЛ), с помощью которых можно не только выявить наличие антиоксидантных свойств у химических соединений, но и изучить механизм и действие веществ в различных условиях протекания процессов ПОЛ, является актуальным.
Целью нашего исследования являлась разработка комплексной системы моделирования процесса и унифицированной методики проведения стандартизации ПОЛ в различных условиях.
В соответствии с поставленной целью решались следующие задачи:
1. Сравнительное изучение методов оценки интенсивности ПОЛ;
2. Отработка существующих методик in vitro;
3. Выбор идеальной модельной системы для анализа;
4. Стандартизация выбранных методик.
Модельные системы включают:
· Растворы карбонильных соединений в растворителях или в гомогенных водно-органических фазах.
· Суспензии или эмульсии липидов в водной фазе.
· Препараты природных мембран.
· Липосомы, приготовленные инжекционным способом.
Гидрофильные исследуемые вещества добавляли до нужной концентрации к водной фазе, липофильные — к этанольному раствору фосфолипидов (ФЛ) перед приготовлением липосом.
Концентрацию карбонильных соединений определяли по реакции с 2,4-динитрофенилгидразином (ДНФГ), реагирующим с карбонильными соединениями с образованием соответствующих гидразинов, которые в щелочной среде превращаются в интенсивно окрашенные аци-соли с максимумом поглощения в водной среде в диапазоне 410—500 нм [3, с. 45].
Кислотное число определяли по ГОСТ 5476-8 1 «Масла растительные. Методы определения кислотного числа». Перекисное число — йодометрией.
Проведен отбор модельных систем для анализа:
I. Модельная система — высшие жирные кислоты, тип инициации ПОЛ — автоокисление, титриметрический метод анализа. Выявлена прямопропорциональная зависимость между величиной кислотного числа (КЧ) и временем окисления ВЖК (рис. 1).
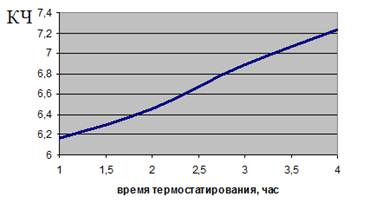
Рисунок 1. Зависимость величины КЧ от времени термостатирования
II. Модельная система — стандартные растворы формальдегида, тип инициации ПОЛ — автоокисление, фотометрическое определение производных 2-тиобарбитуровой кислоты. Выявлена прямопропорциональная зависимость между величиной оптической плотности и количеством формальдегида в реакционной смеси. На каждые 50 мкл 40% раствора формальдегида увеличение оптической плотности в среднем составляло 0,01 (рис. 2).

Рисунок 2. Зависимость оптической плотности от объема формалина
III. Модельная система — фосфолипидные липосомы, тип инициации ПОЛ — химический (2,5 мМ раствор CuSO4), фотометрическое определение гидразонов ДНФГ и продуктов ПОЛ. Выявлена прямопропорциональная зависимость между величиной оптической плотности и временем термостатирования фосфолипидных липосом. В начальный момент времени оптическая плотность составляла 0,015. За первые 30 мин. произошло максимальное увеличение оптической плотности на 0,02. Затем через каждые 30 мин прирост оптической плотности происходил с уменьшением скорости образования альдегидов. Соответственно 0,015; 0,01 и 0,005 (рис. 3).

Рисунок 3. Зависимость оптической плотности от времени термостатирования липосом
IV. Модельная система — 1,2 М раствор ванилина, фотометрическое определение гидразонов ванилина. Выявлена прямопропорциональная зависимость между величиной оптической плотности и содержанием ванилина в реакционной смеси. На каждые 100 мкл 1,2 М раствора ванилина увеличение оптической плотности в среднем составляло 0,113 (рис. 4).
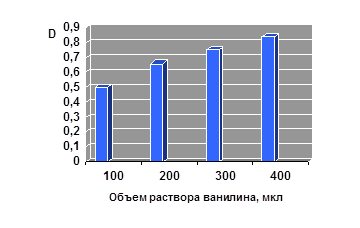
Рисунок 4. Зависимость оптической плотности от количества ванилина
V. Модельная система — фосфолипидные липосомы, тип инициации ПОЛ — химический (5 мМ, 7,5 мМ и 10 мМ растворы CuSO4), фотометрическое определение гидразонов. По результатам исследования определено, что максимальное окисление липосом происходило в соотношениях ФЛ: раствор сульфата меди:
для 5 мМ раствора — 1 х 3; величина оптической плотности 0,06.
для 7,5 мМ раствора — 1 х 5; величина оптической плотности 0,08.
для 10 мМ раствора — 1 х 3; величина оптической плотности 0,11.
Для создания модельной системы спиртовый раствор фосфолипидов головного мозга КРС смешивали в пробирках в соотношениях от 8х1 до 1х1 с водным раствором сульфата меди различной концентрации (5, 7,5 и 10 мМ), инициирующей процесс ПОЛ. Через 3 ч готовили свежеприготовленный реактив, содержащий 2,4-динитрофенилгидразин. Из исследуемых смесей отбирали аликвоты 200 мкл, смешивали с 2 мл реактива и через 10 мин. фотометрировали растворы на ФЭКе при длине волны 420—490 нм (рис. 5).
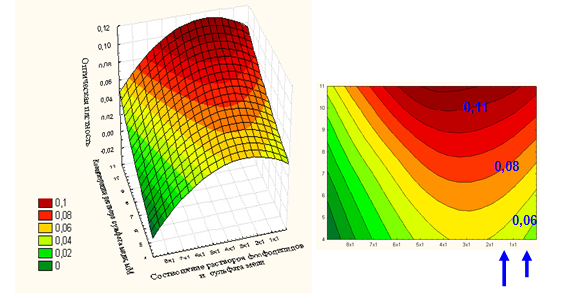
Рисунок 5. Зависимость оптической плотности модельной системы от количества и концентрации раствора сульфата меди
Итак, в результате проведенного исследования Выявлена прямопропорциональная зависимость между величиной кислотного числа и временем окисления ВЖК. Установлена прямопропорциональная зависимость между величиной оптической плотности и количеством формальдегида в реакционной смеси. На каждые 50 мкл формалина увеличение оптической плотности в среднем составляло 0,01. Определена прямопропорциональная зависимость между величиной оптической плотности и временем термостатирования фосфолипидных липосом. В начальный момент времени оптическая плотность составляла 0,015. За первые 30 мин. произошло максимальное увеличение оптической плотности на 0,02. Затем через каждые 30 мин прирост оптической плотности происходил с уменьшением скорости образования альдегидов. Соответственно 0,015; 0,01 и 0,005.
Кроме того выявлена прямопропорциональная зависимость между величиной оптической плотности и содержанием ванилина в реакционной смеси. На каждые 100 мкл 1,2 М раствора ванилина увеличение оптической плотности в среднем составляло 0,113.
По результатам исследования определено, что максимальное окисление липосом происходило в соотношениях фосфолипиды : раствор сульфата меди:
для 5 мМ раствора — 1 х 3; величина оптической плотности 0,06.
для 7,5 мМ раствора — 1 х 5; величина оптической плотности 0,08.
для 10 мМ раствора — 1 х 3; величина оптической плотности 0,11.
Унифицированной методикой проведения эксперимента в различных условиях является методика определение концентрации карбонильных соединений с использованием 2,4-динитрофенилгидразина.
Список литературы:
1.Боев В.М., Красиков С.И., Свистунова Н.В., Неплохов А.А., Боев М.В., Шарапова Н.В., Тимошинова С.В. Свободнорадикальное окисление в оценке риска здоровья // Гигиена и санитария. — 2006. — № 5. — С. 19—20.
2.Жаворонок Т.В., Степовая Е.А., Рязанцева Н.В., Петина Г.В., и др. Нарушение «окислительного» метаболизма при острых воспалительных заболеваниях // Клиническая лабораторная диагностика. — 2006. — № 12. — С. 10—15.
3.Ланкин В.З., Тихазе А.К., Беленков Ю.Н. Свободнорадикальные процессы в норме и при патологических состояниях: пособие для врачей. М., 2001. — 78 с.
дипломов


Оставить комментарий