Статья опубликована в рамках: XXVIII Международной научно-практической конференции «Современная медицина: актуальные вопросы» (Россия, г. Новосибирск, 12 февраля 2014 г.)
Наука: Медицина
Секция: Патологическая физиология
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
ВЛИЯНИЕ СИМВАСТАТИНА И АНТАГОНИСТА РЕЦЕПТОРОВ ИНТЕРЛЕЙКИНА-1 НА ЭКСПРЕССИЮ TLR-2 ЛИМФОЦИТАМИ У КРЫС С ЭКСПЕРИМЕНТАЛЬНЫМ ОКСАЗОЛОНОВЫМ КОЛИТОМ
Жеребятьев Александр Сергеевич
ст. лаборант Запорожского государственного медицинского университета, Украина, г. Запорожье
E-mail: Gerya2009@yandex.ru
Камышный Александр Михайлович
д-р мед. наук, доцент Запорожского государственного медицинского университета, Украина, г. Запорожье
E-mail:
EFFECT OF SIMVASTATIN AND RECOMBINANT ANTAGONIST OF RECEPTORS OF INTERLEUKIN-1 ON EXPRESSION OF TLR-2 WITH LYMPHOCYTES IN RATS WITH EXPERIMENTAL OXAZOLONE-INDUCED COLITIS
Zherebiatiev Aleksandr Sergeevich
senior technician of Zaporozhye State Medical University, Ukraine, Zaporozhye
Kamyshnyi Aleksandr Mikhailovich
doctor of Medicine, Associate Professor of Zaporozhye State Medical University, Ukraine, Zaporozhye
АННОТАЦИЯ
Целью данного исследования было изучение возможности применения симвастатина и арил-1 для фармакологической коррекции колита у крыс. Колит индуцировали ректальным введением оксазолона. Иммунопозитивные клетки определяли с помощью иммуногистохимии. Было установлено, что введение препаратов при развитии экспериментальной патологии сопровождалось изменением экспрессии TLR-2 в кишечнике. В заключение, наше исследование показало, что симвастатин и арил-1 оказывают положительные эффекты на течение колита.
ABSTRACT
The aim of this study was to investigate the possibility of Simvastatin and ARIL-1 for pharmacological correction of colitis in rats. Colitis was induced by the rectal administration of oxazolone. The immunopositive cells were determined by using an immunohistochemistry. It has been established that drug administration during the development of experimental pathology was accompanied by changes in the expression of TLR-2 in the inflamed colonic tissue. In conclusion, our study indicated that an administration of Simvastatin and ARIL-1 reveals a potential mechanism for their beneficial effects in colitis.
Ключевые слова: язвенный колит; Toll-подобный рецептор 2; симвастатин; антагонист рецепторов интерлейкина-1 (АРИЛ-1)
Keywords: ulcerative colitis; Toll-like receptor 2; simvastatin; recombinant antagonist of receptors of interleukin-1 (ARIL-1).
Введение. Воспалительные заболевания кишечника (ВЗК) включают в себя язвенный колит (ЯК), точная причина которого остается неизвестной. Имеющиеся данные свидетельствуют о том, что аномальный иммунный ответ, направленный на микроорганизмы кишечной флоры, отвечает за развитие заболевания у генетически восприимчивых индивидуумов. Последние достижения в области иммунологии и генетики показали, что врожденный иммунный ответ является столь же важным, как и адаптивный иммунитет, в развитии и поддержании кишечного воспаления у этих больных. Изменение экспрессии Toll-подобных рецепторов 2 типа (TLR-2), лигандами для которых являются липотейхоевые кислоты и бактериальные липопротеины, входящие в состав клеточной стенки грамположительных и грамотрицательных бактерий может быть связано с патогенезом ВЗК. Особого внимания заслуживает уровень экспрессии TLR-2 лимфоцитами кишечно-ассоциированной лимфоидной ткани (КАЛТ), учитывая что прямая активация TLR на поверхности клеток адаптивной иммунной системы влияет на направление их дифференцировки, пролиферацию, выживание, продукцию цитокинов и костимуляторных молекул, подчеркивая участие сигналов от TLR в развитии воспаления кишечника [9, с. 453].
Остается открытым вопрос качественной терапии ЯК, и в этом ракурсе привлекает внимание использование статинов. Статины ингибируют 3-гидрокси-3-метилглутарил-КоА-редуктазу, которая катализирует превращение ГМГ-КoA в L-мевалонат, и были активно использованы в качестве гипохолестеринемических агентов. Кроме того, недавние исследования показали, что статины оказывают дополнительные иммунорегулирующие эффекты, независимые от гиполипидемической активности; им приписывают модулирующее действие на иммунную систему, влияние на экспрессию MHC класса II, функции Тh1 и Th2-лимфоцитов, экспрессию молекул адгезии, подвижность и миграцию лейкоцитов, синтез провоспалительных цитокинов. Например, было сообщено, что аторвастатин снижает продолжительность и тяжесть активного и пассивного экспериментального аутоиммунного энцефаломиелита (ЕАЕ), демонстрируют положительный эффект у пациентов с рассеянным склерозом и у пациентов с ревматоидным артритом [5, с. 361].
Кроме того, наиболее мощным системным провоспалительным цитокином является IL-1β, поэтому наше внимание привлек антагонист рецепторов интерлейкина-1 (АРИЛ-1) в качестве терапевтического средства при экспериментальном оксазолон-индуцированном колите (ОИК).
Цель исследования. Изучение экспрессии TLR-2 лимфоцитами толстого кишечника крыс в условиях развития экспериментального оксазолон-индуцированного колита, и при коррекции его симвастатином и рекомбинантным антагонистом рецепторов интерлейкина-1.
Объект и методы исследования. Исследования проведены на 40 самцах-крысах линии Вистар весом 110—160 грамм. Экспериментальную часть работы выполняли в соответствии с положениями «Европейской конвенции о защите позвоночных животных, которых используют для экспериментальных и других научных целей» (Страсбург, 1985). Животные были разделены на четыре группы по 10 крыс: группа 1 ― контрольные животные, группа 2 ― животные с экспериментальной патологией ― оксазолон-индуцированным колитом (ОИК), группа 3 ― животные с ОИК которым вводили симвастатин, группа 4 ― животные с ОИК которым вводили АРИЛ-1 (производство ОАО «РЭСБИО» г. Санкт-Петербург, Россия). ОИК индуцировали на седьмые сутки после предварительной сенсибилизации, однократным внутриректальным введением 0,1 % раствора оксазолона (Sigma, США) в дозе 10 мг/животное под кетаминовым наркозом. Предварительная сенсибилизация осуществлялась нанесением на предварительно выбритый участок кожи животного 0,2 мл. 3 % сенсибилизирующего раствора состоящего из смеси ацетона, оливкового масла и оксазолона [13, с. 543]. Симвастатин вводили внутрибрюшинно в дозе 20 мг/кг через 24 часа после индукции колита в течение 5 дней. АРИЛ-1 вводили подкожно в дозе 3 мг/кг через 24 часа после индукции колита в течение 5 дней. Все группы животных выводили из эксперимента декапитированием под наркозом на 6 сутки после индукции колита. Изымали участки проксимального и дистального отделов толстого кишечника и на 20 часов погружали в фиксатор Буэна.
Структуру популяции TLR-2+ лимфоцитов изучали на основании анализа серийных гистологических срезов и данных их морфометрических и денситометричних характеристик. Для проведения данного исследования на ротационном микротоме MICROM HR-360 (Microm, Германия) делали 5-микронные серийные срезы проксимального и дистального отделов толстого кишечника, которые затем депарафинировали в ксилоле, проводили регидратацию в нисходящих концентрациях этанола (100 %, 96 %, 70 %), отмывали в 0,1 М фосфатном буфере (рН=7,4) и окрашивали гематоксилином-эозином или инкубировали с поликлональными антителами (МКАТ) к TLR-2 (HycultBiotech, Нидерланды) конъюгированными с флюоресцеином изотиоционатом (FITC) в течение 18 часов во влажной камере при Т = 4 оС. После инкубации все срезы промывали 0,1 М фосфатным буфером и помещали в смеси глицерина и фосфатного буфера (1:9) для последующей люминесцентной микроскопии. Обработанные гистологические срезы изучали с помощью компьютерной программы ImageJ (NIH, США). Изображение, получаемое на микроскопе Primo Star (ZEISS, Германия) в ультрафиолетовом спектре возбуждения 390 нм (FITC) с помощью высокочувствительной камеры Axio Cam 5 c (ZEISS, Германия) и пакета программ для получения, архивирования и подготовки изображений к публикации Axio Vision 4.7.2 (ZEISS, Германия) немедленно вводили в компьютер. При этом в автоматическом режиме определялись области со статистически значимой флюоресценцией, характерной для лимфоидных клеток экспрессирующих рецепторы. Исчислялись морфометрические и денситометрические характеристики имунопозитивних клеток. При окраске МКАТ исследовали TLR-2+ лимфоциты, расположенные в собственной пластинке слизистой оболочки (СПСО) и в подслизистой основе (ПО) толстого кишечника.
Все полученные экспериментальные данные обрабатывали на персональном компьютере пакетом прикладных и статистических программ EXCEL из пакета MS Office 2010 (Microsoft Corp., США), STATISTICA 6.0 (Stat-Soft, 2001). Для всех показателей рассчитывали значение средней арифметической выборки (М), ее дисперсии и ошибки средней (m). Для выявления достоверности различий результатов исследований в опытных и контрольных группах животных определяли коэффициент Стьюдента (t), после чего определяли возможность разницы выборок (р) и доверительный интервал средней. Критический уровень значимости при проверке статистических гипотез принимали равным 0,05.
Результаты и их обсуждения. Развитие колита сопровождается макроскопическими изменениями в толстом кишечнике: отек, гиперемия, множественные эрозии и язвы. При гистологическом исследовании тканей окрашеных гаматоксилином-эозином мы наблюдали признаки воспаления, укорочение и исчезновение кишечных крипт, воспалительную инфильтрацию лимфоцитами и плазматическими клетками с примесью эозинофилов и утолщением СПСО и ПО толстого кишечника.
Анализ серийных срезов толстого кишечника животных показал, что развитие колита сопровождается однонаправленным уменьшением суммарной плотности популяции TLR-2+ лимфоцитов в проксимальном отделе толстого кишечника (в СПСО на 27 %, в ПО на 31 %, р<0,05) (рис. 1A), и увеличением в дистальном отделе толстого кишечника (в СПСО на 39 %, в ПО на 88 %, р<0,05) (рис. 1D), по сравнению с контролем. При этом в обеих морфофункциональных зонах проксимального отдела толстого кишечника уменьшилась плотность TLR-2 на поверхности лимфобластов и увеличилась у средних лимфоцитов; в дистальном отделе кишечника увеличилась плотность TLR-2 в лимфобластах.
Введение симвастатина животным с ОИК сопровождается однонаправленным уменьшением суммарной плотности популяции TLR-2+ лимфоцитов как в проксимальном отделе толстого кишечника (в СПСО на 34 %, в ПО на 30 %, р<0,05) (рис. 1В), так и в дистальном отделе толстого кишечника (в СПСО на 26 %, в ПО на 36 %, р<0,05) (рис. 1Е), по сравнению с контролем. При этом в СПСО проксимального отдела кишечника увеличилась плотность TLR-2 у малых лимфоцитов; в СПСО дистального отдела кишечника уменьшилась плотность TLR-2 в малых лимфоцитах; в ПО ― лимфобластах и малых лимфоцитах.
Введение арила животным с ОИК сопровождается однонаправленным уменьшением суммарной плотности популяции TLR-2+ лимфоцитов как в проксимальном отделе толстого кишечника (в СПСО на 30 %, р<0,05) (рис. 1С), так и в дистальном отделе толстого кишечника (в СПСО на 28 %, в ПО на 48 %, р<0,05) (рис. 1F), по сравнению с контролем. При этом в СПСО проксимального отдела кишечника увеличилась плотность TLR-2 в лимфобластах; в СПСО дистального отдела кишечника уменьшилась плотность TLR-2 в лимфобластах в ПО ― в лимфобластах и малых лимфоцитах.

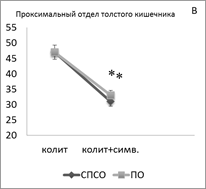
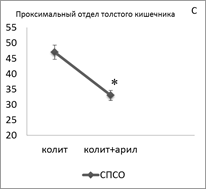
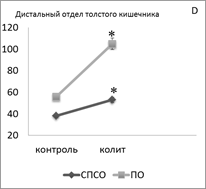
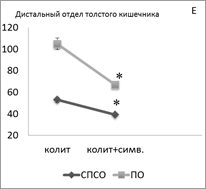
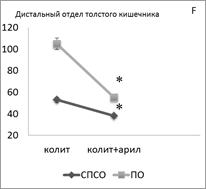
Рисунок 1. Суммарная плотность (на 1мм2) TLR2+ — клеток в СПСО и ПО толстого кишечника при развитии ОИК (A, D), после введения симвастатина (В, E) и арила (C, F) экспериментальным животным, * — p < 0,05
Аномальная сигнализация через TLR может привести к нарушению гомеостаза «комменсалы-слизистая», способствуя тем самым усилению воспаления при ЯК. Бактериальные продукты, такие как липополисахарид и пептидогликан, находятся в высокой концентрации в кишечнике и способны, осуществляя передачу сигнала через TLR-2 активировать NF-kB, который регулирует транскрипцию различных провоспалительных цитокинов (IL-1β, TNF-α , IL-6, IL-8, IL-12), играющих роль в развитии ЯК. Существует убедительные доказательства, что аномальный уровень ответа на синантропные бактерий является важным компонентом возникновения ВЗК. Так, экспериментальный колит не развивается у мышей содержащихся в стерильных условиях или подвергшихся введению антибиотиков, предполагая, что кишечная микрофлора имеет важное значение для инициирования развития и поддержания колитогенных CD4+ Т-клеток. В совокупности MyD88-зависимый путь, который контролирует передачу сигналов TLR в Т-клетках может непосредственно способствовать пролиферации и выживания колитогенных CD4+ Т-клеток и поддержанию хронического колита [11, с. 5292].
Прямые доказательства роли комменсальной микрофлоры получены в исследованиях иммунных реакций по отношению к конкретным бактериальным антигенам кишечника. Например, мыши со спонтанным колитом C3H/HeJBir (CBIR), показали увеличение реактивности B-клеток и Т-клеток к бактериальным антигенам, и перенос CD4+ Т-клеток от CBIR мышей вызывал колит у иммунодефицитных мышей-реципиентов. Этот ответ является специфическим по отношению к синантропной микрофлоре, поскольку соответствующие Т-клетки не реагировали на пищевые антигены или фекальные экстракты стерильных мышей [10, с. 149].
Cantó E. et al. выявил высокий уровень экспрессии TLR2 и TLR4 в слизистой оболочке толстой кишки пациентов с ЯК, показывая, что микроорганизмы в кишечнике играют важную роль в инициации и поддержании заболевания [2, с. 156]. Среди всех TLRs, TLR-2 по-видимому, один из основных игроков в поддержании гомеостаза кишечника, оказывает цитопротективные эффекты в клетках кишечного эпителия. Отсутствие TLR-2 повышает восприимчивость к повреждению кишечника и воспалению, а TLR2 стимуляция эффективно усиливает защитную функцию эпителиального барьера. Пероральное введение Pam3CSK4 (агонист TLR2) показало терапевтический потенциал в модели DSS-индуцированного колита. Протективный эффект при этом опосредован через сигналы от TLR2 которые индуцируют выработку цитопротекторного фактора TFF3 и белка плотных контактов ZO-1 через активацию протеинкиназы С, которые способствуют сохранению целостности эпителиального барьера и резистентности клеток к апоптозу. Хотя агонисты TLR2 еще не прошли клинические испытания для терапии заболеваний у человека, эти результаты предполагают, что они могут быть идеальной мишенью для лечения ВЗК [9, с. 460]. Dong L. et al. показали, что при развитии DSS-индуцированного колита повышается экспрессия TLR-2 в эпителии толстого кишечника с повышением содержания Escherichia coli и уменьшением содержания Lactobacillus и Bifidobacterium, но при введении моноклональных антител к TLR-2 активность колита уменьшается и содержание Lactobacillus и Bifidobacterium повышается к нормальному уровню [3, с. 111]
TLRs играют большую роль в адаптивном иммунитете. Наивные CD4+ и CD8+ T-клетки экспрессируют TLR-2 и TLR-4. Передача сигналов через TLR -2 влияет на развитие и функцию Th17, активность Treg клеток, дендритных клеток, способствующих дифференцировке наивных Т-клеток в разные типы Т-хелперов. Например, используя мышей, дефицитных по TLR-2 или MyD88, было показано, что стимуляция TLR-2 на Treg клетках индуцирует их пролиферацию и преходящую потерю супрессивной активности [10, с. 146]. Передача сигналов через TLR-2 влияет на развитие и функцию Th17, которые участвуют в развитии аутоиммунных заболеваний человека, при которых важную роль играет баланс Th17/Treg [8, с. 989]. Gonzalez-Navajas J.M. et al продемонстрировали, что удаление TLR в CD4+ T-клетках привела к увеличению продукции IFNγ и тяжелому колиту у мышей [4, с. 577], а Lee J.Y. et al. показали, что симвастатин ингибирует экспрессию провоспалительных генов, блокирует передачу сигналов через ядерный фактор-kB и ослабляет течение острого колита у мышей [6, с. 245].
Баланс IL-1 и IL-1ra играет важную роль в регуляции воспаления и иммунного ответа. Maeda S. et al. указали на дисбаланс между IL-1β и IL-1ra, который может играть роль в патогенезе ВЗК [7, с. 68]. Birgit et al. продемонстрировали, что блокада IL-1β путем введения животным антагониста IL-1R (ИЛ-1Ra; Анакинра) ингибирует развитие колита [1, с. 5676]. Также этот препарат был одобрен в Америке для лечения ревматоидного артрита [12, с. 478], однако высокая цена лимитирует повсеместное использование его в практике врача и заставляет акцентировать внимание исследователей на поиске и разработке бюджетных аналогов препарата.
Выводы
1. При развитии оксазолонового колита наблюдается уменьшение количества TLR-2+ лимфоцитов в проксимальном отделе толстого кишечника с уменьшение плотности Toll-подобных рецепторов. В дистальном отделе толстого кишечника наблюдается обратная тенденция с увеличением числа TLR-2+ лимфоцитов и возрастанием плотности TLR-2 в лимфоцитах.
2. Введение симвастатина на фоне развития колита вызвало уменьшение количества TLR-2+ лимфоцитов, а также увеличение плотности TLR-2 в лимфоцитах проксимального и дистального отделов толстого кишечника.
3. Введение арила на фоне развития колита вызвало уменьшение количества TLR-2+ лимфоцитов, как в проксимальном, так и в дистальном отделе толстого кишечника, при этом наблюдалась разнонаправленная тенденция к увеличению плотности TLR-2 в лимфоцитах проксимального отдела и уменьшению в дистальном отделе толстого кишечника.
Список литературы:
1.Birgit E. Loss of TLR2 worsens spontaneous colitis in MDR1A deficiency through commensally induced pyroptosis // J. Immunol. — 2013. — Vol. 190. — № 11. — P. 5676—5688.
2.Cantó E. TNF alpha production to TLR2 ligands in active IBD patients // Clin. Immunol. — 2006. — Vol. 119. — P. 156—165.
3.Dong L. Toll-like receptor 2 monoclonal antibody or/and Toll-like receptor 4 monoclonal antibody increase counts of Lactobacilli and Bifidobacteria in dextran sulfate sodium-induced colitis in mice // Gastroenterol. Hepatol. — 2012. — Vol. 27. — № 1. — P. 110—119.
4.Gonzalez-Navajas J.M. TLR4 signaling in effector CD4+ T cells regulates TCR activation and experimental colitis in mice // J. Clin. Invest. — 2010. — Vol. 120. — P. 570—581.
5.Greenwood J. Statin therapy and autoimmune disease: from protein prenylation to immunomodulation / J. Greenwood, L. Steinman, S.S Zamvil // Nat. Rev. Immunol. — 2006. — Vol. 6. — № 5. — P. 358—370.
6.Lee J.Y. Simvastatin inhibits NF-kappaB signaling in intestinal epithelial cells and ameliorates acute murine colitis // Ist. Immunopharmacol. — 2007. — Vol. 7. — № 2. — P. 241—248.
7.Maeda S. Mucosal imbalance of interleukin-1β and interleukin-1 receptor antagonist in canine inflammatory bowel disease // Vet. J. — 2012. — Vol. 194. — № 1. — P. 66—70.
8.Mai J. Th 17 cells interplay with Foxp3+ Tregs in regulation of inflammation and autoimmunity / J. Mai, H. Wang, X.F. Yang // Front. Biosci. — 2010. — Vol. 15. — P. 986—1006.
9.Fukata M. The Role of Pattern Recognition Receptors in Intestinal Inflammation / M. Fukata, M. Arditi // Mucosal Immunol. — 2013. — Vol. 6. — № 3. — P. 451—463.
10.Megan E. The role of T-regulatory cells and Toll-like receptors in the pathogenesis of human inflammatory bowel disease // Immunology. — 2008. — Vol. 125. — № 2. — P. 145—153.
11.Takayuki T. MyD88-Dependent Pathway in T Cells Directly Modulates the Expansion of Colitogenic CD4+ T Cells in Chronic Colitis // J. Immunol. — 2008. — Vol. 180. — № 8. — P. 5291—5299.
12.Thompson R.C. Interleukin-1 receptor antagonist (IL-1ra) as a probe and as a treatment for IL-1 mediated disease / R.C. Thompson, D.J. Dripps, S.P. Eisenberg // Int. J. Immunopharmacol. — 1992. — Vol. 14. — № 3. — Р. 475—480.
13.Wirtz S. Chemically induced mouse models of intestinal inflammation // Nat. Protocols. — 2007. — Vol. 2. — № 3. — Р. 541—546.
дипломов


Оставить комментарий