Статья опубликована в рамках: XXVI Международной научно-практической конференции «Современная медицина: актуальные вопросы» (Россия, г. Новосибирск, 16 декабря 2013 г.)
Наука: Медицина
Секция: Патологическая физиология
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
ВЛИЯНИЕ ИНСУЛИНОПОДОБНОГО ФАКТОРА-1 НА РЕПЕРАТИВНУЮ РЕГЕНЕРАЦИЮ ПЕЧЕНИ ПРИ ХРОНИЧЕСКОМ МЕДИКАМЕНТОЗНОМ ГЕПАТИТЕ У НЕПОЛОВОЗРЕЛЫХ КРЫС
Рыкало Надежда Анатольевна
д-р мед. наук, доцент ВНМУ, Украина, г. Винница
E-mail: rikalo77@mail.ru
Андрощук Ольга Васильевна
старший преподаватель ВНМУ, Украина, г. Винница
INFLUENCE OF INSULIN-LIKE GROWTH FACTOR-1 ON LIVER REPARATIVE REGENERATION IN CASE OF INVETERATE DRUG-INDUCED HEPATITIS WITH IMMATURE RATS
Nadezhda Rykalo
doctor of Medical Science, associate professor of Vinnitsa National Medical University, Ukraine Vinnytsia
Olga Androschuk
head teacher of Vinnitsa National Medical University, Ukraine Vinnytsia
АННОТАЦИЯ
На модели хронического медикаментозного гепатита изучено влияние IGF-1 на репаративную регенерацию печени неполовозрелых крыс. Установлено, что при ХМГ уровень IGF-1 увеличивается в 2 раза, что приводит к усилению процессов синтеза ДНК в 2,5 раза. Кверцетин и тиотриазолин способствуют репаративной регенерации печени, влияя на различные фазы клеточного цикла. IGF-1 активирует процессы репаративной регенерации гепатоцитов при ХМГ, активируя процессы синтеза ДНК и митоза клеток. Тиотриазолин усиливает репаративную регенерациию за счет гиперплазии гепатоцитов, кверцетин — их полиплоидизации.
ABSTRACT
Based on the model of inveterate drug-induced hepatitis IGF-1 influence on liver reparative regeneration of immature rats has been studied. It is found that in case of inveterate drug-induced hepatitis level of IGF-1 doubles that leads to an enhancement of DNA synthesis processes two and a half times. Quercetin and tiotriazolini serve to liver reparative regeneration influencing on different cycling states. IGF-1 promotes reparative regeneration processes of hepatocyte in case of inveterate drug-induced hepatitis activating DNA synthesis and mitosis processes. Tiotriazolini intensifies reparative regeneration by means of hyperplasia of hepatocytes, and quercetin — by means of its polyploidization.
Ключевые слова: репаративная регенерация; печень.
Keywords: reparative regeneration; liver.
Вступление. На сегодняшний день хронические гепатиты относятся к числу наиболее распространенных заболеваний детского возраста. Актуальность проблемы определяется не только высокой заболеваемостью, а, главным образом, — тяжестью течения у детей, продолжительностью и нередко тяжелыми последствиями – развитием злокачественных (фульминантных) форм хронического гепатита и цирроза печени [6, с. 36]. Важное место среди токсических поражений печени занимают хронические медикаментозные гепатиты (ХМГ), что обусловлено особенностями кровоснабжения печени и метаболизма в ней лекарственных веществ [9, с. 370]. Среди всех случаев острой недостаточности печени у детей 20 % связано с приемом лекарственных препаратов, среди них 5 % — с приемом противотуберкулезных препаратов, в частности, изониазида и рифампицина [10, с. 940; 2, с. 40].
В результате токсического повреждения печени запускаются последовательные регенераторные механизмы, которые включают пролиферацию, дифференцировку и миграцию клеток, а также реструктуризацию стромы и ангиогенез. Регуляция этих механизмов осуществляется факторами, продуцируемыми как самой печенью, так и другими тканями. Среди таких факторов существенное значение имеет инсулиноподобный фактор-1 (IGF-1), который оказывает стимулирующее действие на функциональную и митотическую деятельность клеток, обеспечивает постоянство притока клеточной массы, поддержание видовой специализации тканей и восстановление внутри- и внеклеточных структур как в процессе жизнедеятельности организма, так и вследствие их повреждения [14, с. 384]. Известно, что гепатоциты начинают секретировать IGF-1 в ходе воспалительной реакции, который подавляет воспалительный ответ путем уменьшения макрофагальной инфильтрации и уровня фактора некроза опухолей, подавляет экссудативный стресс, а также подавляет апоптоз паренхиматозных клеток и эндотелиоцитов. Увеличение концентрации IGF-1, который в процессе фиброгенеза синтезируется клетками Купфера и звездчатыми клетками, указывает на важность этого фактора в процессах регенерации печени при ее токсическом поражении [3, с. 13]. По данным литературы [13, с. 186], при лечении низкими дозами IGF-1 экспериментального тетрахлорметан-индуцированного цирроза печени у крыс наблюдалось снижение почти всех показателей, участвующих в окислительных механизмах повреждения печени. Это, в свою очередь, свидетельствует о том, что экзогенный IGF-1 индуцирует гепатопротекторное и антифибротическое действие при экспериментальном циррозе печени.
Цель: исследовать влияние IGF-1 на репаративную регенерацию печени неполовозрелых крыс при медикаментозном поражении печени противотуберкулезными препаратами.
Материалы и методы: Проведено экспериментальное исследование на 50 нелинейных белых лабораторных неполовозрелых крысах - самцах исходной массой тела 60—70 г. Выбор неполовозрелых животных обусловлен необходимостью максимального приближения экспериментальной патологии к патологии, изучаемой у детей. Моделирование ХМГ было проведено по собственной разработанной методике [7, с. 385] путем интрагастрального введения рифампицина и изониазида трижды в неделю в течение 29 дней. Экспериментальные животные были разделены на 4 группы: 1-я - интактные животные (n = 12 , контроль), 2-я — моделирование ХМГ (n = 14), животным 3-й группы (n = 12) параллельно с рифампицином и изониазидом в течение 29 дней ежедневно интрагастрально вводили кверцетин («Квертин», ЗАО НПЦ Борщаговский химико-фармацевтический завод) из расчета 75 мг/кг, животным 4-й группы (n = 12) параллельно с рифампицином и изониазидом в течение 29 дней ежедневно интрагастрально был введен тиотриазолин (АО «Галичфарм», корпорация «Артериум») из расчета 22,5 мг/кг. Пересчет ЕД50 для кверцетина и тиотриазолина проводили по методике Ю.Р. Рыболовлева [8, с. 1514]. После завершения эксперимента животных в условиях эвтаназии под тиопенталовым наркозом декапитировали и проводили забор сыворотки крови и ткани печени.
Содержание IGF-1 определяли иммуноферментным методом с использованием высокочувствительных коммерционных наборов «DRG» (Германия). Исследования проводили на иммуноферментном анализаторе Humareader 2106 (США).
После извлечения печени в стерильных условиях под капсулой с левой большой доли печени из свежего материала вырезали кусочек печени размером 0,5 см3, который промывали стерильным раствором NaCl и погружали в фосфатно-солевой буфер рН 7,4 (Sigma) в переносной холодильник с температурой 4—8 0С для дальнейшего исследования. Цитофлуориметрический анализ проводился на многофункциональном научно-исследовательском проточном цитометре "Partec PAS" фирмы Partec (Германия) в НИЦ ВНМУ им. Н.И. Пирогова (Украина). Содержание ДНК в ядрах клеток печени определяли методом проточной цитометрии. Суспензии ядер из клеток печени получали при помощи специального раствора для исследования ядерной ДНК CyStain DNA фирмы Partec, Германия соответственно протоколу-инструкции изготовителя. Данный раствор позволяет быстро и одновременно выполнять экстракцию ядер и маркировать ядерную ДНК диамидинофенилиндолом (DAPI), который входит в его состав. В каждом образце нуклеарной суспензии анализировалось не меньше 20000 событий. Циклический анализ (фазы клеточного цикла) выполнен средствами програмного обеспечения FloMax в полном цифровом соответствии. Цифровое соответствие экспериментальным данным выполнено согласно математической модели. Пиковый анализ (плоидность) выполнен средствами програмного обеспечения FloMax методом цифрового соответствия с линейным усилением. В цифровом методе соответствия математическая модель (сумма колоколообразных распределений Гаусса) сопоставлялась с данными гистограммы. В модели каждый пик представлен распределением Гаусса с заданным положением, шириной и высотой.
Статистический анализ полученных результатов проводили с использованием непараметрических методов оценки полученных данных. Оценивали правильность распределения признаков по каждому из полученных вариационных рядов, средние значения по каждому изучаемому, стандартные ошибки и отклонения. Достоверность разницы значений между независимыми количественными величинами определяли с помощью непараметрического парного теста Вилкоксона. Для определения вида взаимосвязи полученных данных нами был проведен анализ корреляционных полей, что позволило выявить линейную зависимость и для более детального анализа использовать коэффициент корреляции Пирсона.
Результаты и их обсуждение:
Проведенное исследование показало, что уровень IGF-1 у животных с ХМГ увеличивался почти вдвое (р<0,01). Это можно трактовать как своеобразную компенсаторно-приспособительную реакцию, направленную на усиление репаративной регенерации ткани печени в ответ на ее повреждение рифампицином и изониазидом, учитывая данные литературы, указывающие на то, что IGF-1 способствует регенерации печени вследствие увеличения выработки фактора роста гепатоцитов (НGF) звездчатыми клетками [11, с. 5732; 12, с. 4685]. При лечебно-профилактическом введении кверцетина содержание IGF-1 уменьшалось на 31 % (р<0,05), тиотриазолина — на 11 % (р>0,05) по сравнению с животными, которые не получали лечения. При этом содержание IGF-1 у животных, которым вводили кверцетин, приближался к таковому у животных группы контроля, тогда как у крыс, которым проводилась коррекция тиотриазолином данный показатель достоверно был выше на 62 % (р<0,01).
Поскольку важными показателями регенерации ткани являются фазы клеточного цикла, мы исследовали их изменения при ХМГ и при его медикаментозной коррекции. Установлено, что количество ядер клеток печени, которые находятся в G0-G1 интервале, была меньше на 9 % по сравнению с контролем (р<0,05) (табл. 1), что может быть следствием альтерации высокоспециализированных гепатоцитов, которые являются наиболее чувствительными к действию гепатотоксинов, а также мобилизации резервов (G0 фаза) для обеспечения регенерации. На фоне введения тиотриазолина данный показатель возвращался к нормальным значениям, что указывает на восстановление пула 2с-гепатоцитов, как основных клеток печени, выполняющих специализированную функцию.
Таблица 1.
Характеристика показателей у неполовозрелых крыс в зависимости от используемого гепатопротектора, (М±m)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Примечания:
1. * — достоверная разница в сравнении с контролем (р<0,05).
** — достоверная разница в сравнении с контролем (р<0,01).
2. # — достоверная разница в сравнении с ХМГ (р<0,05).
3. р3—р4 — достоверная разница между группами ХМГ + кверцетин и ХМГ + тиотриазолин (р<0,05).
Процент ядер в фазе синтеза ДНК (S — фазе) при ХМГ был достоверно больше в 2,5 раза (р<0,05), что свидетельствует об усилении синтетических процессов в ядрах гепатоцитов в ответ на поражение печени. У животных группы ХМГ+тиотриазолин данный показатель почти не отличался от аналогичного в группе контроля, однако достоверно был ниже чем у животных с ХМГ без медикаментозной коррекции (табл. 1), что указывает на его достаточно высокие гепатопротекторные свойства.
Установлено, что постсинтетическая и митотическая фазы (интервал G2М) клеточного цикла ядер печеночных клеток в условиях ХМГ и его лечения гепатопротекторами представлены следующим образом: в группе ХМГ+тиотриазолин данный показатель не отличался от такового в контроле, тогда как у животных группы ХМГ+кверцетин он достоверно превышал аналогичный (процент ядер, находящихся в постсинтетической и митотической фазах) у интактных животных на 15 % (р<0,05). По нашему мнению, это может указывать на незавершенную репаративную регенерацию гепатоцитов на фоне лечебно-профилактического введения кверцетина.
Свидетельством усиления репаративной регенерации гепатоцитов в ответ на их повреждение рифампицином и изониазидом было достоверное увеличение индекса пролиферации на 20 % (РІ — сумма показателей фаз S и G2М) (р<0,05). На фоне введения тиотриазолина происходила его нормализация.
При анализе плоидности ядерной ДНК доказано, что состав популяций клеток, выделенных из нормальной и патологически измененной печени, отличается по количеству наборов ДНК (рис. 1). Так, при ХМГ процент диплоидных ядер меньше на 7 % по сравнению с контрольной группой. Это свидетельствует о повреждении 2с-гепатоцитов, поскольку они более чувствительны к действию патогенных факторов, а также подтверждает полученные нами данные об уменьшении количества ядер, которые находятся в интервале G0—G1 и переходят в следующие фазы клеточного цикла, готовят клетку к делению для реализации репаративной регенерации поврежденной ткани печени. При введении животным тиотриазолина данный показатель приближался к таковому у интактных животных. На фоне введения кверцетина — не отличался от такового у нелеченных животных и достоверно был меньше чем в контроле, что указывает на хорошую репаративную регенерацию ткани печени под действием тиотриазолина.
Контроль
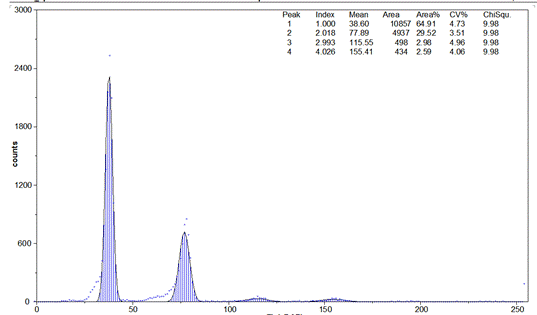
ХМГ + кверцетин

Рисунок 1. Пиковый анализ плоидности ядерной ДНК клеток печени: peak-1 — диплоидный набор ядерной ДНК (2 с); Peak-2 — тетраплоидный набор ядерной ДНК (4 с); Peak-3 — октаплоидный набор ядерной ДНК (8 с); Peak-4 — 16 с; Peak-5 — 32 с; Peak-6 — 64 с
Типичным вариантом регенерации поврежденной печени противотуберкулезными препаратами с гепатотоксическими свойствами была полиплоидизация ядер гепатоцитов за счет увеличения процента ядер с плоидностью ДНК 16с, появление нетипичных для здоровых животных данного возраста ядер гепатоцитов с набором ДНК 32с, которые являются более устойчивыми к действию гепатотоксинов. Так, количество полиплоидных ядер с набором ДНК > 8 с (16 с и 32 с) у животных с ХМГ была увеличена на 47 % (р<0,05) (табл. 1). В группе животных ХМГ+кверцетин полиплоидизация ядер гепатоцитов сохранялась даже после завершения лечения, как и у животных группы сравнения с ХМГ, что мы расцениваем как неполноценную регенерацию ткани печени, поскольку клетки с полиплоидными ядрами являются более устойчивыми к действию повреждающих факторов, однако не способны выполнять специализированные функции в полном объеме [4, с. 63; 5, с. 65; 1, с. 36]. У животных группы ХМГ+тиотриазолин данный показатель почти не отличался от аналогичного в группе контроля, однако достоверно был ниже чем у животных с ХМГ без медикаментозной коррекции (табл. 1), что указывает на его достаточно высокие гепатопротекторные свойства.
Поскольку известно влияние IGF-1 на рост и дифференциацию тканей в норме, мы исследовали имеющиеся корреляционные связи с содержанием IGF-1 и исследуемыми показателями клеточного цикла, для установления влияния данного противовоспалительного цитокина на пролиферацию гепатоцитов в условиях ХМГ и его патогенетической коррекции гепатопротекторами. Установлено, что IGF-1 активирует процессы репаративной регенерации гепатоцитов, влияя на фазы клеточного цикла, активирует переход из фазы покоя G0 в следующие фазы для обеспечения пролиферативных процессов. Доказательством этого являются прямые сильные и достоверные корреляционные связи между IGF-1 и интервалом G2М при введении тиотриазолина (r = 0,86, р<0,05), IGF-1 и РІ (r = 0,83, р<0,05), IGF-1 и процентом тетраплоидных ядер (r = 0,86, р<0,05), а также обратные сильные — между IGF-1 и процентом диплоидных ядер (r = –0,82, р<0,05) и ядер, находящихся в фазе G0/G1 клеточного цикла (r = –0,83, р<0,05). То есть, тиотриазолин усиливает процессы репаративной регенерации поврежденной ткани печени за счет гиперплазии гепатоцитов.
Также установлено, что IGF-1 у животных с ХМГ, которым с целью гепатопротекции вводили кверцетин, усиливал репаративную регенерацию по механизму полиплоидизации. Это подтверждается существованием прямых сильных корреляционных связей между IGF-1 и процентом полиплоидных ядер (более 8с) (r = –0,86, р<0,05). Следует отметить, что именно в группе ХМГ + кверцетин были обнаружены гепатоциты с набором ядерной ДНК 32 с и 64 с (рис. 1).
Выводы:
1. IGF-1 активирует процессы репаративной регенерации гепатоцитов, влияя на фазы клеточного цикла, активирует переход из фазы покоя G0 в следующие фазы для обеспечения пролиферативных процессов.
2. Тиотриазолин усиливает процессы репаративной регенерации поврежденной ткани печени за счет гиперплазии гепатоцитов с диплоидным набором ДНК, может обеспечивать восстановление не только структуры и массы органа, но и его функцию.
3. Кверцетин усиливает репарацию ткани печени по механизму полиплоидизации ядер гепатоцитов, что не может обеспечивать полную регенерацию, поскольку полиплоидные клетки не способны полноценно выполнять специализированную функцию.
Список литературы:
1. Анацкая О.В. Полиплоидия в серце: защита и слабость / О.В. Анацкая, А.Е. Виноградов // Химия и жизнь. — 2008. — № 9. — С. 34—37.
2. Анісімова С.І., Шаяхметова Г.М., Бондаренко Л.Б., Волошина О.С., Вороніна А.К., Карацуба Т.А., Блажчук І.С., Коваленко В.М. Роль індукції цитохрому Р-450 2Е1 в реалізації токсичної дії протитуберкульозних засобів у печінці // Укр. біохімічний журн. — 2010. — Том 82. — № 4 (додаток 2). — С. 40.
3. Бабак О.Я. Фиброз печени: современные представления о механизмах, способах диагностики и лечения / О.Я. Бабак, Е.В. Колесникова, Н.А. Кравченко // Сучасна гастроентерологія. — 2009. — № 2(46). — С. 5—17.
4. Мороз В.М. Поліплоїдія гепатоцитів у статевонезрілих щурів при хронічному токсичному гепатиті, медикаментозна корекція / В.М. Мороз, Н.А. Рикало // Загальна патологія та патологічна фізіологія. — 2010. — № 1. — С. 61—72.
5. Мороз В.М. Вплив гепатопротекторів на клітинні механізми репаративної регенерації тканини печінки при хронічному токсичному гепатиті та цирозі у статевонезрілих щурів / В.М. Мороз, Н.А. Рикало // Журнал АМН України. — 2010. — Т. 16, — № 4. — С. 701—712.
6. Охотнікова О.М. Хронічні гепатити в практиці педіатра (частина 1) / О.М. Охотнікова // Мистецтво лікування. — 2010. — № 2 (68). — С. 35—39.
7. Рикало Н.А., Гумінська О.Ю., Андрощук О.В. Експериментальна модель хронічного медикаментозного гепатиту у статевонезрілих щурів // Таврический медико-биологический вестник. — 2012. — Т. 15., — № 3, — ч. 1 (59), — С. 283—286.
8. Рыболовлев Ю.Р., Рыболовлев Р.С. Дозирование веществ для млекопитающих по константам биологической активности // Докл. Академии наук СССР. 247. — С. 1513—1516.
9. Трахтенберг І.М. Труднощі диференційної діагностики токсичних і вірусних гепатитів / І.М. Трахтенберг, М.А. Андрейчин, В.С. Копча // Журнал НАМН України. — 2011. — Т. 17, — № 4. — С. 368—380.
10. An Official ATS Statement: Hepatotoxicity of Antituberculosis Therapy / J.J. Saukkonen, D.L. Cohn, R.M. Jasmer [et al.] // American Journal of Respiratory and Critical Care Medicine. — 2006. — Vol. 174. — Р. 936—952.
11. Insulin-like growth factor signaling pathways in rat hepatic stellate cells : importance for deoxyribonucleic acid synthesis and hepatocyte growth factor prodaction / S. Skrtic, K. Wallenius, A. M. Gressner [et al.] // Endocrinology. — 1999. — № 140 (12). — P. 5729—5735.
12. Insulin-like growth factor stimulate expression of hepatocyte growth factor but not transforming growth factor beta 1 in cultured hepatic stellate cells / S. Skrtic, K. Wallenius, S. Ekberg [et al.] // Endocrinology. — 1997. — Vol. 138, — № 11 — P. 4683—4689.
13. Fernandez M.G. Antioxidant effects of insulin-like growth factor-I (IGF-I) in rats with advanced liver cirrhosis / M.G. Fernandez, I.C. Cortazar, M.D. Sanchez [et al.] // Gastroenterology. — 2005. — Vol. 5. — Р. 180—188.
14. Furnus C.C. Chronobiology of the proliferative events related to angiogenesis in mice liver regeneration after partial hepatectomy / C.C. Furnus, A.M. Inda, L.B. Andrini [et al.] // Cell Biol. Int. — 2003. — Vol. 27, — № 4. — P. 383—386.
дипломов

Оставить комментарий