Статья опубликована в рамках: XXIII Международной научно-практической конференции «Современная медицина: актуальные вопросы» (Россия, г. Новосибирск, 23 сентября 2013 г.)
Наука: Медицина
Секция: Стоматология
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
ЭКСПЕРИМЕНТАЛЬНОЕ ИСЛЕДОВАНИЕ ВОЗМОЖНОСТИ ПРИМЕНЕНИЯ НОВЫХ КОМПОЗИТНЫХ МАТЕРИАЛОВ В ЧЕЛЮСТНО-ЛИЦЕВОЙ ХИРУРГИИ
Маланчук Владислав Александрович
член-корреспондент НАН Украины, д-р мед. наук, проф., зав. каф. хирургической стоматологии и челюстно-лицевой хирургии Национального медицинского университета имени А.А. Богомольца, Украина, Киев
Астапенко Елена Александровна
канд. мед. наук, доцент каф. хирургической стоматологии и челюстно-лицевой хирургии Национального медицинского университета имени А.А. Богомольца, Украина, Киев
Чепурный Юрий Владимирович
канд. мед. наук, ассистент каф. хирургической стоматологии и челюстно-лицевой хирургии Национального медицинского университета имени А.А. Богомольца, Украина, Киев
Жуковцева Елена Игоревна
аспирант каф. хирургической стоматологии и челюстно-лицевой хирургии Национального медицинского университета имени А.А. Богомольца, Украина, Киев
E-mail:
EXPERIMENTAL RESEARCH INTO THE USES OF NEW COMPOSITE MATERIALS IN MAXILLOFACIAL SURGERY
Malanchuk Vladislav
corresponding member of NAMS of Ukraine, Doctor of Medicine, Professor, Head of surgical stomatology and maxilla-facial surgery, Ukraine, Kiev
Astapenko Elena
phD., department of surgical stomatology and maxilla-facial surgery, Ukraine, Kiev
Chepurnoii Yuriii
phD., department of surgical stomatology and maxilla-facial surgery, Ukraine, Kiev
Zhukovtceva Elena
graduate student, department of surgical stomatology and maxilla-facial surgery, Ukraine, Kiev
АНОТАЦИЯ
В эксперименте на 20 крысах были изучены особенности травматически-ишемических, реактивных, репаративных и регенераторных процессов, путем создания дырчатого дефекта нижней челюсти с закрытием наружного отверстия дефекта образцами из полиуретана (ПУ), карбид кремния и титана в сроки 7, 14, 30 суток после операции. Гистологически проведена оценка особенностей процесса заживления дефекта и формирования фиброзной капсулы вокруг исследуемых образцов имплантатов.
ABSTRACT
In experiment on 20 rats were studied especially of the traumatic-ischemic, reactive, reparative and regenerative processes by creating the defect of a mandibular and then closing the outer opening of the defect by samples of polyurethane (PU), silicon carbide and titanium in terms of 7, 14, 30 days after surgery. Histological evaluation characteristic of the healing processes of the defect and the formation of a fibrous capsule around the sample of the implants.
Ключевые слова: полиуретановые пластины; карбид кремния; титановые пластины, травматический дефект; челюсть; эксперимент; крысы; гистологические изменения.
Keywords: polyurethane plates; silicon carbide; titanium plates; traumatic defect; jaw; experiment; rats; histological changes.
Введение
Одним из актуальных направлений современной челюстно-лицевой хирургии является реконструктивная хирургия лицевого черепа. Данное направление призвано решать вопросы восстановления целостности лицевого черепа, нарушенной в результате травмы, устранения дефектов и деформаций, возникших в результате разного рода патологических процессов, последствий оперативных вмешательств. Традиционно, с этой целью при проведении хирургического вмешательства используются разного рода фиксаторы, чаще всего из титана, аутогенные костные трансплантаты. Но данный подход часто сопровождается рядом недостатков, что негативно сказывается на конечном результате лечения. Так, использование для этих целей аутокости связанно с нанесением дополнительной травмы пациенту, возможностью нагноения послеоперационной раны, частичного или полного рассасывания с потерей исходной формы или же с отторжением трансплантата, увеличением длительности оперативного вмешательства, вовлечением дополнительной бригады оперирующих хирургов [1, с. 27]. Металлические имплантаты, в частности широко используемый титан, подвержены коррозии [4, с. 127]. При этом частички титана и легирующих веществ, (ванадий, алюминий) попадая в окружающие ткани, приводят к развитию металлоза, а также местных иммунно-воспалительных и аллергических реакций [6, с. 5]. Поэтому разработка новых материалов для остеосинтеза и устранения дефектов костей лицевого черепа остается актуальной проблемой реконструктивной хирургии челюстно-лицевой области.
В этом плане представляет интерес поиск и дальнейшее изучение возможностей использования новых имплантационных материалов.
Нами предложены два новых материала — на основе полиуретанового полимера (ПУ) и биоморфного карбида кремния (SiC), которые обладают высокой коррозионной устойчивостью, достаточной механической прочностью, низкой теплопроводимостью.
Биоматериал на основе ПУ — биоактивного действия, так как в его состав входит иммуномодулятор левамизол для стимуляции процесса остеосинтеза, который проходит параллельно с биорезорбцией материала. Ряд исследований показал, что скорость деструкции материала не превышает время необходимое для сращения костных фрагментов [2, с. 150; 3, с. 8].
Основой карбида кремния является углеродный каркас, полученный в результате пиролиза (обугливания) заготовки из древесины, в котором сохраняется ячеистая морфология дерева. Данная структура имеет поры различного диаметра (от 20 до 100 мкм) и схожа со структурой природной кости (фото 1.). Механическая прочность достигается с последующим этапом изготовления материала — пропиткой жидким кремнием.
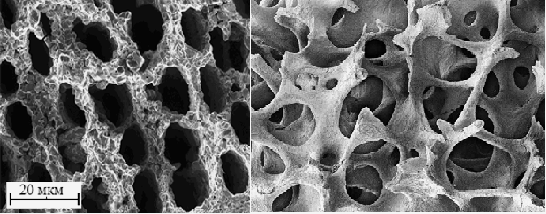
Фото 1. СЭМ-снимки морфологии поверхности образцов биоморфного карбида кремния (слева), полученного из заготовки древесины бука и костной ткани (справа)
Целью исследования было изучение в эксперименте на животных особенности реакций костной и мягких тканей при имплантации полиуретана и карбида кремния, а также оценка их биоинертности и биосовместимости по сравнению с образцами из титана.
Эксперимент выполнен на 20 белых лабораторных крысах-самцах массой 250—280 г, которым под внутримышечным кетаминовым наркозом, с соблюдением принципов медицинской этики наносили дырчатые дефекты кости нижней челюсти бором диаметром 1,5 мм на глубину 3 мм. После гемостаза в дефекты помещали образцы титана, полиуретана, карбида кремния одинаковых размеров диаметром около 1,5 мм, длиной 2 мм, после тщательного гемостаза ткани послойно ушивали. Пять интактных крыс служили контрольной группой. Животных содержали в обычных условиях вивария и выводили из эксперимента в сроки 7, 14, 30 суток после имплантации ингаляционной летальной дозой эфира для наркоза.
При вскрытии оценивали макроскопическую картину в области имплантации и состояние имплантатов, после чего проводили забор вместе с окружающими тканями. Кость декальцинировали в 5 %-ном растворе азотной кислоты, вырезали гистологические блоки в плоскости дефекта и установленных имплантатов, кусочки заливали в парафин, срезы готовили по стандартным методикам, толщиной 10 мкм окрашивали гематоксилин-эозином и гематоксилин-пикрофуксином по Ван-Гизону. Гистологические исследования и микрофотографии выполняли на микроскопе OLYMPUS CX-41, фотографии гистотопографических препаратов — методом макрофотосъёмки.
Результаты исследования.
При проведении анализа гистологических результатов исследования особое внимание уделялось выраженности фиброзной капсулы вокруг имплантированных образцов материала, её клеточному составу и характеру воспалительных процессов в её толще, как показателям биосовместимости материалов. В данном случае нами учитывалась точка зрения, что фиброзный барьер представляет собой защитную реакцию организма на внедрение чужеродного материала. Соответственно, чем ниже уровень «защиты», тем выше совместимость организма с материалом и ниже «чужеродность» последнего.
В срок наблюдения 7 суток дырчатый дефект кости нижней челюсти почти во всех случаях был перекрыт незрелой соединительной, в частности — незрелой фиброзной, тканью, а также — губчатым костным регенератом (фото 2.).
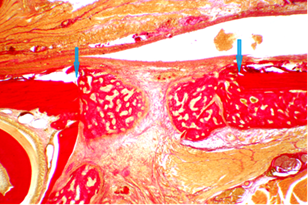
Фото 2. Замещение дефекта челюсти незрелым фиброзно-костным регенератом (границы дефекта обозначены стрелками, слева — полость от ПУпластины). Микрофото гистологического препарата челюсти крысы, срок 7 суток после имплантации. Окраска гематоксилин-пикрофуксином по Ван-Гизону. Ув. микроскопа 20 ×
Соединительная ткань, заполняющая дефект, переходила непосредственно в капсулу вокруг образцов и была представлена грануляционной или незрелой фиброзной тканью (фото 3.), в которой отмечалась мононуклеарная инфильтрация различной плотности; в инфильтратах преобладали лимфоциты и макрофаги, экссудативное воспаление в этих случаях имело серозный характер. В некоторых случаях в экссудате и инфильтратах преобладали нейтрофилы и скопления фибрина, то есть воспаление имело характер фибринозно-гнойного. Новообразованная костная ткань была представлена незрелой, ретикуло-фиброзной тканью, которая врастала от края дефекта к центру, циркулярно охватывая края костного дефекта, встречались также небольшие оссификаты в глубине фиброзной ткани, по краям дефекта и интерстициального регенерата наблюдались признаки активного остеогенеза. Костная ткань поверхностного слоя, прилегающего снаружи к фиброзной капсуле образцов материалов, а также спонгиозе, образующей стенки дефекта, на разном протяжении была некротизирована. Периостальные и эндостальные костные регенераты располагались по краям ложа образцов, регенерат по краям дефекта во всех локусах представлен незрелой костной тканью с признаками активного остеогенеза.
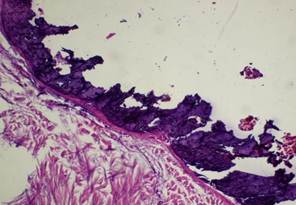
Фото 3. Соединительнотканная капсула вокруг образца карбида кремния, срок имплантации — 7 дней. Капсула тонкая, без воспалительной реакции. В одном из участков остаточная макрофагальная реакция
Через 14 суток после операции отмечено увеличение относительного объема костной части регенерата, заполняющего дефект, а также некоторое увеличение объема периостального и эндостального костных регенератов по краям образцов (фото 4.). По сравнению с предыдущим сроком наблюдения костные регенераты выглядели более плотными, а признаки активного остеогенеза, в виде юных остеобластов, расположенных на поверхностях костных трабекул регенератов, встречались только в некоторых местах, но преимущественно отсутствовали.
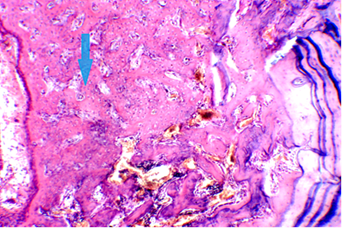
Фото 4. Регенерат представлен незрелой губчатой костной тканью (обозначено стрелкой) с сохранением активности остеогенеза и признаками перестройки. Микрофото гистологического препарата челюсти крысы, срок 14 дней после имплантации. Окраска гематоксилин-эозином. Ув. микроскопа 50 ×
На 30 сутки после создания дырчатого дефекта и фиксации имплантатов, в большинстве случаев, полость дефекта была полностью выполнена костно-фиброзным регенератом, при этом четко прослеживались признаки созревания в виде утолщения и уплотнения костных трабекул, участков остеорезорбции (как фазы цикла перестройки), замещения незрелой фиброзной ткани в костномозговых полостях желтым и красным костным мозгом (фото. 5). В костных трабекулах регенерата сохранялись участки пластинчатой костной ткани (результат фазы остеогенеза — процесс перестройки). Капсула вокруг образцов была представлена зрелой фиброзной тканью с незначительно выраженной мононуклеарной воспалительной инфильтрацией, в отдельных случаях воспаление капсулы имело характер экссудативного: серозно-фибринозного, реже — серозно-гнойного.
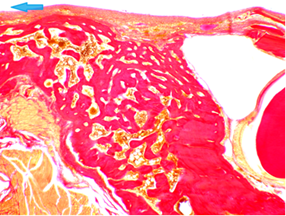
Фото 5. Почти сплошное заполнение дефекта челюсти стрелкой показана полость от ПУ образца. Микрофото гистологического препарата челюсти крысы, срок 30 дней после имплантации. Окраска гематоксилин-пикрофуксином по ван Гизону. Ув. микроскопа 20 ×
Сравнительный анализ патологических изменений и основных процессов в кости крыс в альтернативных группах исследования показал, что изменения в организации дефекта челюсти, капсуле вокруг имплантатов — однотипные и отличаются только выраженностью проявления тех или иных морфологических симптомов. Данный факт является свидетельством сопоставимой биосовместимости исследуемых образцов, а соответственно дает возможность имплантатам из ПУ и карбида кремния конкурировать с титаном с биологической точки зрения.
Можно отметить только одно отличие: в параоссальных компонентах капсулы полиуретановой (ПУ) пластины у некоторых животных встречались мелкие инкапсулированные инородные тела — микрофрагменты ПУ, вокруг которых наблюдалась мононуклеарная инфильтрация, которая отвечает неспецифическому продуктивному воспалению низкой активности. Данная картина является лишь следствием процесса биодеструкции материала.
Степень и характер тканевых регенератов, замещающих дырчатый дефект кости, оказались неодинаковыми даже в сериях, относящихся к одному сроку наблюдения в группах сравнения. Так, на 7 сутки после нанесения дефекта, в группе, где применяли ПУ пластины, среди 5 животных у 3 были обнаружены большие краевые губчатые костные регенераты, у 2 — дефекты были заполнены грануляционной тканью с небольшими краевыми костными регенератами и островками десмального остеогенеза; в группе с образцами карбида кремния — дефект выполнен незрелой фиброзной тканью; в группе крыс, где применены титановые пластины, полость дефекта была замещена регенератом с преобладанием грануляционной и незрелой фиброзной тканью.
При проведении сканирующей электронной микроскопии (СЭМ, JEOL-100) образцов карбида кремния извлеченных через неделю после имплантации определяется заселение каналов пор клеточными элементами крови (фото 6). Данный факт следует трактовать, как потенциальную возможность материала способствовать течению репаративного остеогенеза за счет создания условий для адгезии клеток.
СЭМ образца SiC через месяц после имплантации подтвердила, что поры данного размера являются достаточными для заселения и роста клеток костной ткани (фото 7.).
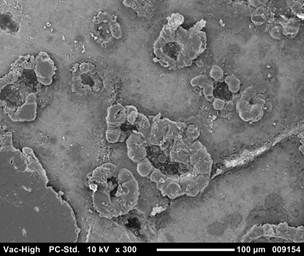
Фото 6. СЭМ образца карбида кремния через неделю после имплантации
В течение 30 суток в группе ПУ пластин из 6 наблюдений у 3 — дефект был полностью замещен зрелым костным регенератом, в группе крыс с образцами из титана и карбид-кремния в этот срок во всех случаях дефект был восполнен фиброзно-костным регенератом.

Фото 7. СЭМ образца карбида кремния через 30 дней после имплантации
Сопоставление морфологических особенностей замещающих регенератов в группах сравнения показывает, что при использовании ПУ образцов частота замещения дефектов регенератами, в которых преобладает костная ткань, несколько выше, чем в группе, где применяли карбид-кремниевые образцы и титановые пластины, что обнаружено нами в сериях животных в сроки 7 и 30 суток от начала эксперимента.
Полученные экспериментальные результаты дают основание полагать, что биосовместимость образцов из карбида кремния и ПУ сопоставима с таковой у титана. Последний взят для сравнения, как материал с высокими показателями биоинертности и биосовместимости, широко применяющийся для решения разнообразных задач в медицине. Вместе с тем, предложенные материалы имеют ряд преимуществ, таких как биодеградация как у ПУ композиции и микроскопическая архитектоника, напоминающая костную ткань [5, с. 380], характерная для карбида кремния. Это дает предпосылки для дальнейших клинических исследований возможности применения указанных материалов в медицине, и в челюстно-лицевой хирургии в частности.
Выводы.
1. Наличие в фиброзной капсуле вокруг имплантатов из биоморфного карбида кремния и полиуретана неспецифической воспалительной реакции низкой активности свидетельствует о биоинертности исследуемых материалов в отношении организма экспериментальных животных.
2. Формирование наиболее тонкой фиброзной капсулы вокруг образцов карбида кремния свидетельствует о его более высокой биосовместимости с живыми тканями. Вместе с тем, толщина фиброзной капсулы вокруг образцов ПУ и титана существенно не отличаются, что доказывает высокую биосовметимость ПУ композиции, сходной с титаном.
3. Заселение пор материала из карбида кремния регенераторным клетками и клетками крови (в сроки 7 и 30 дней после операции), зафиксированное СЭМ, доказывает потенциальную возможность материала способствовать благоприятному течению репаративного остеогенеза, что выгодно отличает его от титана, для которого подобная особенность без специальной обработки не характерна.
4. Отсутствие существенной биодеструкции ПУ-образцов в сроки наблюдения до 30 суток, установленное в данном исследовании, свидетельствует о сохранении их прочностных характеристик. Данное свойство указанного материала может быть использовано при изготовлении резорбируемых фиксаторов для остеосинтеза в челюстно-лицевой хирургии, поскольку сроки этого времени в большинстве случаев достаточно для первичного костного сращения костей лицевого черепа.
5. Выше изложенные пункты дают основание для клинического исследование возможности применения имплантатов из ПУ и карбида кремния в хирургической практике, в частности в челюстно-лицевой хирургии.
Список литературы:
1.Бельченко В.А. Черепно-лицевая хирургия: Руководство для врачей. М.: ООО «Медицинское информационное агенство», 2006. — 340 с.: ил.
2.Галатенко Н.А., Маланчук В.А., Астапенко Е.А., Рожнова Р.А., Куксин А.Н. Токсиколого-гигиеническая оценка биодеградируемых биоактивных накостных пластин для остеосинтеза // Доп. НАН України. — 2008. — № 6. — С. 149—152.
3.Григорьян А.С., Набиев Ф.Н., Алавердов В.П. Динамика заживления костных дефектов при имплантации резорбируемых полимерных материалов (экспериментально-морфологическое исследование) // Российский стоматологический журнал. — 2005. — № 3. — С. 6—9.
4.Adya N., Alam M., Ravindranath T., Mubeen A., Saluja B. Corrosion in titanium dental implants: literature review // The Journal of Indian Prosthodontic Society. July — 2005. — Vol. 5. — № 3. — P. 126—131.
5.Gibson L. Biomechanics of cellular solids // J. Biomech. — 2005. — Vol. 38. — № 3. — P. 377—399.
6.Olmedo D.G., Tasat D.R., Duffo G., Guglielmotti M.B., Cabrini R.L. The issue of corrosion in dental implants: a review // Acta Odontol. Latinoam. — 2009. — Vol. 22. — № 1. — P. 3—9.
дипломов


Оставить комментарий