Статья опубликована в рамках: XX Международной научно-практической конференции «Современная медицина: актуальные вопросы» (Россия, г. Новосибирск, 01 июля 2013 г.)
Наука: Медицина
Секция: Фармацевтическая химия, фармакогнозия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
УФ-СПЕКТРОМЕТРИЯ В КОЛИЧЕСТВЕННОМ ОПРЕДЕЛЕНИИ ФИТИНА
Пенчева Иванка Димитрова
доцент, Фармацевтический факультет, Медицинский университет,
г. София, Болгария
Обрешкова Данка Петрова
профессор, Фармацевтический факультет, Медицинский университет
г. София, Болгария
Пейкова Лили Пламенова
ассистент, Фармацевтический факультет, Медицинский университет
г. София, Болгария
Папанов Стоян Илиев
ассистент, Фармацевтический факультет, Медицинский университет г. Пловдив, Болгария
Петкова Екатерина Георгиева
доцент, Медицинский колледж, Медицинский университет г. Пловдив, Болгария
E-mail:
Иванов Калин Валентинов
ассистент, Фармацевтический факультет, Медицинский университет
г. Пловдив, Болгария
Петров Георги Йорданов
ассистент, Фармацевтический факультет, Медицинский университет
г. Пловдив, Болгария
Трайкова Николета Иванова
доцент, Медицинский колледж, Медицинский университет
г. Пловдив, Болгария
Божкова Мария Кръстева
ст.преп., Медицинский колледж, Медицинский университет
г. Пловдив, Болгария
UV SPECTROMETRIC METHODS QUANTITATIVE CHARACTERIZATION OF FITIN
Penchev Ivanka Dimitrova
Associate Professor Faculty of Pharmacy, Medical University, Sofia, Bulgaria
Obreshkova Danka Petrova
Professor Faculty of Pharmacy, Medical University, Sofia, Bulgaria
Peykova Lily Plamenova
Assistant Faculty of Pharmacy, Medical University, Sofia, Bulgaria
Papanov Stoyan Iliev
Assistant Faculty of Pharmacy, Medical University, Plovdiv, Bulgaria
Petkova Ekaterina Georgieva
Associate Professor, College of Medicine Medical University, Plovdiv, Bulgaria
Kalin Ivanov Valentine
Assistant Faculty of Pharmacy, Medical University, Plovdiv, Bulgaria
Petrov Georgi Yordanov
Assistant Faculty of Pharmacy, Medical University, Plovdiv, Bulgaria
Traykova Nikoleta Ivanova
Associate Professor, College of Medicine Medical University, Plovdiv, Bulgaria
Bozhkova Maria Krasteva
Senior Lecturer., College of Medicine Medical University, Plovdiv, Bulgaria
АННОТАЦИЯ
Фитин (калциево-магниевая соль фитиновой кислоты), растительный материал, получаемый из семян житных, бобовых растений. Открываются новые фармакологические свойства фитина, что делает продукт привлекательным.
Фитин, фитиновая кислота и инозитол входят в составе большой группы медикаментов. Настоящая разработка раскрывает результаты из УФ-спектрометрического метода для количественного исследования фитина в чистом материале.
Фитин G сделан в Германии на чистом материале, фитин S сделан в России.
ABSTRACT
Fitin (calcium-magnesium salt fitin acid).
This plant material is pull out of the wheat seeds, beans plants. This open a new pharmacological properties, which make the product relevant.
The Fitin acid and the inositol are composed of a big group of medicines.
The present developments reveal the results of UV spectrometric methods for quantitative analysis of clear Fitin material.
Fitin G is made in Germany and the clear material of Fitin S is made in Russia.
Ключевые слова: Фитин, УФ-спектральные методы.
Keywords: Fitin, UV spectral methods.
Введение. Фитин — белый аморфный порошок без вкуса и запаха. Он нерастворим в воде, в минеральных, а также в органических кислотах.
Одна часть фитина растворяется в 10 частях соляной кислоты.
Наблюдения УФ-спектрального метода для количественного определения фитина.
Материалы и аппаратура.
1. исходные вещества
· Чистая субстанция Фитин (G), производитель — Германия, серия: 69324.
· Чистая субстанция Фитин (S), производитель — Россия, серия: 21832.
2. Реактивы
· Соляная кислота (1M HCl).
3. Аппаратура:
UV-VIS спектрометр НР8452А.
Спектрометр содержит следые элементов:
· источник света — дейтериевая ламп,
· входная и выходная щель
· устройство для дисперсий — голографическая дисперсная решетка,
· кювета для исследуемого раствора,
· детектор-фотодиод.
Принцип действия построен на базе матричного фотодиода, при котором находятся 300 детекторных элементов разположенные в области 18х0,5 mm. Разогнаный решетки дисперсии свет падает на фотодиод сквозь в 2 nm в интервале 200—800 nm т. е. в целого UV-VIS интервала. Полихроматичный свет проходит сквозь кюветы и потом разлагается. Так целый UV-VIS спектр попадает на детекторе. Абсорбционная кривая изображается на экране.
Матричный фотодиод подает информацию мгновенно (~0,1 сек), что позволяет повторить исследования и измерение более 50 раз за 5 секунд, а это гарантия точных результатов [1, 3].
Подготовка растворов для анализа чистого вещества Phytin (G) производства Германии.
Приготовления раствора A (G) фитина в концентрации CA = 0,001 g/ml.
Исходящая субстанция фитина измеряется измерительным стеклом с помощью аналитической шкалы (аналитические весы). Точное количество из субстанций (0,1003 g) растворяется в части из растворителя (1М HCl), потом фильтруется в колбе 100 ml. Прибавляется вода до отметки (Cg = 0,001 g/ml). Получается исходный раствор A(G). С помощью параллельного разбавления приготовляются растворы с разными концентрациями.
Приготовление раствора B(G) фитина с концентрацией CB=0,.0005 g/ml.
Из исходного раствора с помощью пипетки тип резила 25 ml переносятся в колбу 100 ml. Колба доливается до мерки в 1 MHCl.
Приготовление раствора D(G) фитина с концентрацией CD=0,0001 g/ml
Из исходного раствора с помощью пипетки тип резила 10ml переносятся в колбу 100 ml. Колба доливается до мерки в 1МHCl.
Приготовление раствора E(G) фитина с концентрацией CE=0,00005 g/ml
Из исходного раствора с помощью пипетки тип резила 5 ml переносятся в колбу 100 ml. Колба доливается до мерки в1MHCl.
Приготовление раствора F(G) фитина с концентрацией CF=0,00001 g/ml
Из полученного раствора с помощью питетки тип резила 1 ml переносится в колбу 100 ml. Колба доливается до мерки в 1 MHCl.
Приготовления раствора для анализа из чистой субстанций Phytin (S) производства России.
Приготовление раствора A(S) фитина с концентрацией CA=0,001 g/ml.
Исходящая субстанция фитина измеряется измерительным стеклом с помощю аналитической шкалы (аналитические весы). Точное количество из субстанций (0,1005 g) растворяется в 1 MHCl в измерительной колбе 100 ml. Прибавляется вода до мерки CA=0,001 g/ml. Из полученного исходного раствора с помощью параллельного разбавления получаем растворы с разными концентрациями.
Приготовление раствора B(S) фитина с концентрацией CB=0,0005 g/ml.
Из исходного раствора с помощью пипетки тип резила 50 ml переносятся в колбу 100 ml. Колба доливается до мерки в 1 MHCl
Приготовление раствора C(S) фитина с концентрацией CC=0,00025 g/ml
Из полученного раствора фитина с помощью пипетки тип резила 25 ml переносятся в колбу 100 ml. Колба доливается до мерки в 1 MHCl.
Приготовление раствора D(S) фитина с концентрацией CD=0,0001 g/ml
Из полученного раствора с помощью пипетки тип резила 10 ml переносятся в колбу 100 ml. Колба доливается до мерки в 1 MHCl.
Приготовление раствора E(S) фитина с концентрацией CE=0,00005 g/ml
Из полученного раствора с помощью пипетки тип резила 5ml переносятся в измерительную колбу 100 ml. Колба доливается до мерки в 1 MHCl.
Приготовление раствора F(S) фитина с концентрацией CF=0,00001 g/ml.
Из готового раствора с помощью пипетки тип резила 1 ml переносится в колбу 100 ml. Колба доливается до мерки в 1 MHCl.
Сущность метода. Обработка результатов
Метод основан на последовательном измерении абсорбций полученных растворов Phytin (G) и Phytin (S) через UV-VIS спектрометр НР8452А.
Для стандартной пробы (компенсация) используется 1 MHCl. На базе результатов определяется объединенными параметрами, необходимыми для достоверности метода:
Повторяемость. этот параметр показывает степени совпадения результатов, которые получаются при измерении одной и тоже величины (в случае абсорбция) исследования, осуществляется в одинаковых условиях за коротких промежуток времени. Для достоверности используются шесть измерений.
Повторяемость характеризуется Relative Standard Deviation (RDS) или стандартным отклонением в процентах [2, 4].
 ,
,
где: SD — standard deviation (стандартное отклонение);
n — число исследования
Повторяемость меньше или равная 10 % считается нормальной.
Таблица 1 демонстрирует результаты исследования аналитического параметра (повторяемость) для чистого Phytin (G) с концентрацией C=0,001 g/ml. Измерение проводилось при волне длиной λ=208 nm и при температура 200С.
Таблица 1.
Исследование аналитичного параметра «повторяемость» для Phytin (G)
|
Проанализи-рованные парамет- ры № пробы |
Длина волны, [nm] |
Температура среды, [0С] |
Количество вещества [mg] |
Полученная абсорбция, [A] |
Стандарт SD [%] |
Relat. RSD [%] |
|
1 |
208 |
20 |
1 |
0,5957 |
0,039 |
0,65 |
|
2 |
208 |
20 |
1 |
0,5929 |
||
|
3 |
208 |
20 |
1 |
0,5715 |
||
|
4 |
208 |
20 |
1 |
0,5609 |
||
|
5 |
208 |
20 |
1 |
0,5165 |
||
|
6 |
208 |
20 |
1 |
0,5012 |
Линейность. Это диапазон, в котором результат представленый детектором остается линейно зависимым от величины вложенного компонента. Если это отношение сохраняется с изменением количества вещества, система находится в своей линейной области.
Линейность метода является исследованной как зависимость между абсорбцией и концентрацией согласно закону Буге-Ламберта-Беера [5].
Из полученных абсорбцией приготовленных растворов с пониженными концентрациями (Табл. 2 и Табл. 3) и при длина волны абсорбционного максимума 208 nm построена графическая зависимость абсорбции из концентрации — рис. 2 (для Фитин G) и рис. 3 (для Фитин S).
Линейная область правы (рис. 1 и рис. 2) определяет интервал, в котором действует закон Буге-Ламберта-Беера.
Таблица 2.
Исследования аналитического параметра «линейность» для Phytin (G)
|
Проанализи-рованные парамет- ры № пробы |
Длина волны, [nm] |
Температура среды, [0С] |
Количество вещества [mg] |
Полученная абсорбция, [A] |
Мол. Абсорбируемость, [E] |
ΔS = Emax - Emin |
|
A (G) |
208 |
20 |
1 |
0,4942 |
494,20 |
7635,8 |
|
B (G) |
208 |
20 |
0,5 |
0,3508 |
701,60 |
|
|
C (G) |
208 |
20 |
0,25 |
0,2362 |
944,80 |
|
|
D (G) |
208 |
20 |
0,10 |
0,1787 |
1787,0 |
|
|
E (G) |
208 |
20 |
0,05 |
0,1342 |
2684,0 |
|
|
F (G) |
208 |
20 |
0,01 |
0,0813 |
8130,0 |
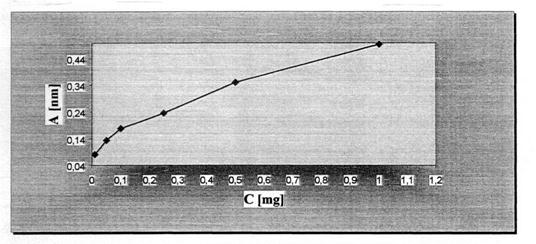
Рисунок 1. Зависимость абсорбций от концентрации раствора Phytin (G)
Таблица 3.
Исследования аналитического параметра «линейность» Phytin (S)
|
Проанализи-рованные парамет- ры № пробы |
Длина волны, [nm] |
Температура среды, [0С] |
Количество вещества [mg] |
Полученная абсорбция, [A] |
Мол. Абсорбируемость, [E] |
ΔS = Emax - Emin |
|
A (S) |
208 |
20 |
1 |
1,4666 |
1466,6 |
3353,4 |
|
B (S) |
208 |
20 |
0,5 |
0,8975 |
1795,0 |
|
|
C (S) |
208 |
20 |
0,25 |
0,3769 |
1507,6 |
|
|
D (S) |
208 |
20 |
0,10 |
0,2133 |
2133,0 |
|
|
E (S) |
208 |
20 |
0,05 |
0,1923 |
3846,0 |
|
|
F (S) |
208 |
20 |
0,01 |
0,0482 |
4820,0 |
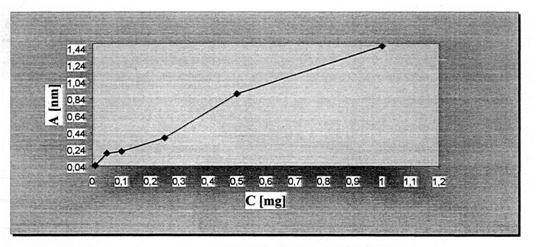
Рисунок 2. Зависимость абсорбций от концентрации раствора Phytin (S)
После (Потом) линейной регрессии получаем регрессную праву (рис. 3) и (рис. 4), а ее математическая зависимость имеет вид:
у = ах ± Ь
Регрессное уравнение — это аналитическая зависимость концентрации из абсорбций.
Степень зависимости двух переменных выражается корреляционным коэфициентом “r” и мерой определенности R2. Как видно из рисунков, R корреляционной коэффициент Phytin (G) е r = 0,9821 с линейной зависимостью С и f(С) 98 %, а за Phytin (S) е r = 0,9937 с линейной зависимостью С и f(С) 99 %.

Рисунок 3. Зависимость абсорбций от концентрации после линейной регрессии
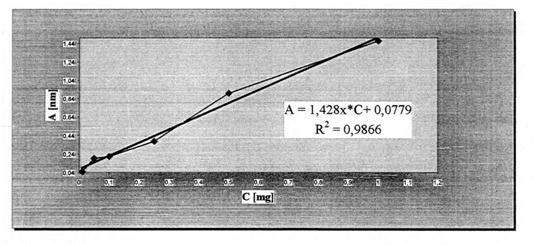
Рисунок 4. Зависимость абсорбции от концентраций после линейной регрессии
Устойчивость. Аналитический параметр, который поддерживает качество системы сохранить свой метрологический характер устойчивым в течение времени.
Метрологический характер — это зависимость абсорбции от изменения кислотности, изменения температуры системы или света, сезонов, высоты.
Устойчивость характеризуется с RDS (%).
Мы исследовали аналитический параметр «Устойчивость» чистого вещества Phytin (G) и Phytin (S) с концентрацией С = 0,001g/ml по отношению к изменению температуры системы. Определили тоже и абсорбции проб (Табл. 5) и (Табл.6) после предварительного нагревания проб до 20, 25, 30, 50, 70, 1000С.
Таблица 4.
Исследования аналитического параметра «устойчивость» для Phytin (G)
|
Проанализи-рованные парамет- ры № пробы |
Длина волны, [nm] |
Температура среды, [0С] |
Количество вещества [mg] |
Полученная абсорбция, [A] |
Стандарт SD [%] |
Relat. RSD [%] |
|
1 |
208 |
20 |
1 |
0,4992 |
0,026 |
0,44 |
|
2 |
208 |
25 |
1 |
0,5012 |
||
|
3 |
208 |
30 |
1 |
0,5164 |
||
|
4 |
208 |
50 |
1 |
0,5520 |
||
|
5 |
208 |
70 |
1 |
0,5612 |
||
|
6 |
208 |
100 |
1 |
0,5420 |

Рисунок 5 Зависимость абсорбции от изменения температуры в системе для Рhytin (G)
Таблица5.
Исследования аналитического параметра «устойчивость» для Phytin (S)
|
Проанализи-рованные парамет- ры № пробы |
Длина волны, [nm] |
Температура среды, [0С] |
Количество вещества [mg] |
Полученная абсорбция, [A] |
Стандарт SD [%] |
Relat. RSD [%] |
|
1 |
208 |
20 |
1 |
1,3925 |
0,014 |
0,24 |
|
2 |
208 |
25 |
1 |
1,4005 |
||
|
3 |
208 |
30 |
1 |
1,4174 |
||
|
4 |
208 |
50 |
1 |
1,4173 |
||
|
5 |
208 |
70 |
1 |
1,4311 |
||
|
6 |
208 |
100 |
1 |
1,4243 |

Рисунок 6. Зависимость абсорбции от изменения температуры в системе для Phytin(S)
Как видно, относительное стандартное отклонение (RSD) в двух случаях ниже 0,5 %. Устойчивость системы в зависимости от температуры остает постоянной во время.
Рис. 5 и Рис. 6 раскрывают графическую зависимость абсорбции от температуры.
Список литературы:
1.Аврамова П., Г. Георгиев, Й. Йовчев, К. Йорданова, О. Лазанова-Йовчева, Е. Найденова, М. Христов. Ръководство за практически упражнения по фарм. Анализ, МФ, София, 1996. — С. 36—42.
2.Димов Н., Хроматографиите във фармацевтичния анализ, НИХФИ, 1999. — С. 22—46.
3.Крисчън Г., Д. О`Рейли. Инструментален анализ, Университетско издателство «Св. Климент Охридски», 1998. — С. 13—22.
4.Watson D., Pharmaceutical analisys. — Edinburg — Toronto, 2005. — С. 45—48.
5.Winfield A. et al, Pharmatical practice. — Edinburg-Toronto, 2004. — С. 60—65.
дипломов


Оставить комментарий