Статья опубликована в рамках: XVII Международной научно-практической конференции «Современная медицина: актуальные вопросы» (Россия, г. Новосибирск, 08 апреля 2013 г.)
Наука: Медицина
Секция: Урология
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
ИММУНОЛОГИЧЕСКИЕ ПОКАЗАТЕЛИ В МОЧЕ БОЛЬНЫХ С ЛЕЙКОПЛАКИЕЙ МОЧЕВОГО ПУЗЫРЯ И ХРОНИЧЕСКИМ РЕЦИДИВИРУЮЩИМ ЦИСТИТОМ
Руденко Адель Викторовна
д-р биол. наук, зав. лаб. микробиологии, вирусологии и микологии ГУ «Ин-т урологии НАМНУ», г. Киев
E-mail:
Корнилина Елена Михайловна
канд. биол наук, ст. научн. сотр. лаб. микробиологии, вирусологии и микологии ГУ «Ин-т урологии НАМНУ», г. Киев
E-mail:
Бардин Андрей Владимирович
канд. мед. наук, зав. ІІІ урологическим отделением ГУ «Ин-т урологии НАМНУ», г. Киев
Старосила Дарья Борисовна
лаборант І категории лаб. микробиологии, вирусологии и микологии, ГУ «Ин-т урологии НАМНУ», г. Киев
Стойкая дизурия, уретральная или тазовая боль у женщин до сих пор остаются сложной диагностической и терапевтической проблемой. Каждая 4—5 женщина в той или иной форме страдает циститом, а 10 % больных — рецидивирующим циститом с дизурическими расстройствами разной степени выраженности. С каждым годом увеличивается количество больных с циститами, развитие которых вызывают как классические бактерии, чаще всего энтеробактерии, так и хламидии, микоплазмы, уреаплазмы [1]. Эти бактериальные возбудители способны вызывать острые или хронические формы циститов, что сопровождается пролиферативными изменениями слизистой оболочки мочевого пузыря (МП) [4].
Что касается причин возникновения и развития лейкоплакии МП (ЛМП), то и в настоящее время отсутствует единая точка зрения. Считается, что среди причинных факторов развития лейкоплакии мочевого пузыря (ЛМП) может быть вирусная инфекция, особенно на фоне нарушений гормонального баланса [8]. За данными Ильинской Е.В. [2] наиболее значительная структурная реорганизация слизистой оболочки МП происходит при микоплазменной инфекции, а работами Раковской И.В. доказано, что даже незначительное изменение в антигеном составе мембран микоплазм может привести к существенному изменению их взаимоотношений с макроорганизмом и превращению их в агрессивные агенты [6].
Часто при выраженных морфологических изменениях слизистой оболочки МП, характерных для лейкоплакии, бактерии отсутствуют, то есть инфекционные возбудители вызывают повреждение уротелия и формирование метаплазии, а дальнейшая альтерация происходит уже независимо от инфекции [5].
В развитии ЛМП на фоне бактериальной флоры значительная роль уделяется местным повреждающим факторам, в связи с чем делаются попытки выяснить роль иммунной системы в нарушении системных и местных регуляторных механизмов. Так, у пациенток с микст-инфекциями выявлены изменения в системе клеточного иммунитета; при моноинфекциях нарушается функционирование системы нейтрофилов, что проявляется в их неспособности адекватно реагировать на возбудителя [3, с. 245]. Сниженный местный иммунитет может способствовать хронизации инфекционно-воспалительного процесса в мочевом пузыре.
При развитии лейкоплакии изменяются свойства слизистой оболочки, что приводит к нарушению ее защитных функций, т. е. участок лейкоплакии может способствовать адгезии и последующей колонизации бактериальной флоры. Ведущими в данном случае является вид возбудителя и особенности его взаимодействия как с иммунокомпетентными, так и эпителиальными клетками [11]. При контакте некоторых бактерий с эпителиальными клетками происходит стимуляция выработки медиаторов воспаления (цитокинов), а характер иммунного ответа определяется степенью выраженности воспалительной реакции и соотношением между про- и противоспалительными факторами [9, 12].
Целью работы было изучение иммунологических показателей в моче у больных с ЛМП и с хроническим рецидивирующим циститом (ХРЦ) и определение роли инфекционных возбудителей разного таксономического происхождения в развития лейкоплакии и цистита.
Объект и методы исследования. Было обследовано 38 женщин с ЛМП (средний возраст 21,2±2,5 лет) и 25 пациенток с ХРЦ (39,4±2,1 лет). Диагноз лейкоплакия был установлен при цистоскопии. Половина женщин с ЛМП в анамнезе имела ХРЦ. Контрольную группу составили 12 практически здоровых женщин. Жалобами больных были ускоренное, болезненное, режущее мочеиспускание малыми порциями с периодическим зудом, боли над лоном при переполнении мочевого пузыря и после его опорожнения, императивные позывы к мочеиспусканию, количество которых за сутки составляли от 5 до 25 раз.
Материалом для исследования была моча. По данным микробиологического, молекулярно-генетического и вирусологического исследования в моче больных с ЛМП и ХРЦ были обнаружены классические бактерии, соответственно, у 8 (21,0 %) и 9 (36,0 %) женщин; моликуты (M.hominis и Ureaplasma spp.) — у 8 (21,0 %) и 8 (32,0 %), классические бактерии вместе с моликутами — у 6 (15,8 %) и 2 (8,0 %) пациенток. У 16 (42,1 %) и 6 (24,0 %) больных с ЛМП и ХРЦ микроорганизмы не обнаружены.
В образцах мочи с помощью иммуноферментных тест-систем определяли уровень иммуноглобулинов А, М, G, лактоферрина (ЛФ) и секреторного иммуноглобулина А («Вектор-Бест», Россия); концентрацию С3-компонента комплемента («Полигност», Россия), секреторного компонента (SC) («Цитокин», Россия), уровень фактора некроза опухоли-a (ФНО-a), интерлейкина (ИЛ)-10 («Procon», Россия) и ИЛ-15 (Invitrogen, Канада).
Статистическую обработку результатов исследования проводили непараметрическими методами (U-критерий Манна-Уитни) с использованием Microsoft Office Exсel 2003 для Windows и STATISTIKA 6.0 [7]. Статистически значимыми считали отличия с Р<0,05. Для каждого показателя определяли медиану (Ме), нижний и верхний квартили (25 % и 75 %).
Результаты и их обсуждение. Определение содержания гуморальных факторов иммунитета было проведено в образцах мочи 63 больных с ЛМП и ХРЦ и 12 здоровых женщин и результаты представлены в таблице 1.
Таблица 1.
Показатели гуморального иммунитета в моче больных с ЛМП и ХРЦ
|
Показатели |
Контрольная группа |
Больные с ЛМП
|
Больные с ХРЦ |
|
IgА, мкг/мл |
1,75 1,0—2,25 |
2,42 1,25—3,9 |
2,50 1,45—5,0 |
|
IgМ, мкг/мл |
0,25 0—0,5 |
0,40 · 0—0,6 |
0,55 * 0,4—1,0 |
|
IgG, мкг/мл |
0 0—2,0 |
0,50 0—4,0 |
0,90 0—6,0 |
|
sIgА, мкг/мл |
0 0—0,15 |
0,50 * 0—1,5 |
0,75 * 0—1,52 |
|
SC, мкг/мл |
0,16 0,04—0,3 |
0,16 0,04—0,38 |
0,26 0,12—0,38 |
|
С3, нг/мл |
9,0 6,0—11,0 |
3,10 * · 1,0—5,4 |
9,0 3,8—42,0 |
|
Лактоферрин, нг/мл |
0 0—1,0 |
2,20 * · 0—11,5 |
20,0 * 4,6—142,0 |
|
ФНОa, пг/мл |
16,0 13,0—36,0 |
30,0 23,0—86,0 |
44,0 23,0—93,0 |
|
ИЛ-10, пг/мл |
37,0 35,0—75,0 |
18,0 0—101,5 |
2,0 0—92,5 |
|
ИЛ-15, пг/мл |
41,2 33,2—48,2 |
23,5 * 19,2—29,0 |
26,0 23,5—36,0 |
Примечание: верхняя строчка — медиана, нижняя строчка — нижний и верхний квартили (25 %—75 %); * — достоверные отличия (Р<0,05) по сравнению с группой контроля; · — достоверные отличия (Р<0,05) по сравнению с больными с ХРЦ
При сравнении полученных данных было установлено, что уровень IgА (по величине Ме) был повышенным почти в одинаковой степени в обеих группах больных относительно контрольного показателя (рис. 1).
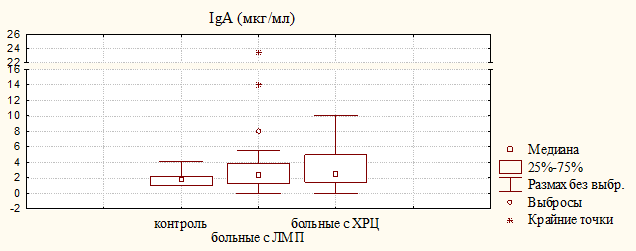
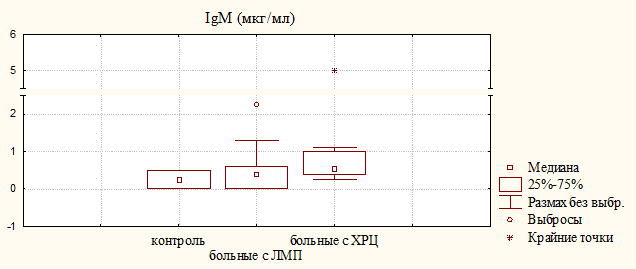

Рисунок 1. Уровень иммуноглобулинов A, М, G в моче больных с ЛМП и ХРЦ и здоровых доноров (контроль)
Одновременно наблюдалось увеличение концентрации IgG и IgМ в моче больных с ХРЦ, при этом достоверная разница для IgМ обнаружена как относительно доноров, так и больных с ЛМП. Наиболее важную роль в местном иммунитете играет секреторный иммуноглобулин А (sIgA), способный более эффективно нейтрализовать вирусы и бактериальные токсины. Секреторный IgА проявляет активность в биологических средах с высоким содержанием протеолитических ферментов, а резистентность sIgA к действию протеолитических ферментов обусловлена секреторным компонентом. Медиана и квартильные величины для sIgA и SC у больных с ХРЦ были незначительно выше, чем у больных с ЛМП (рис. 2); уровень sIgA у больных обеих групп достоверно превышал контрольный показатель, при этом увеличения уровня секреторного компонента в моче больных с ЛМП не наблюдалось, что может свидетельствовать о недостаточной функции эпителиальных клеток, в которых происходит синтез SC.
Наиболее выраженные отличия обнаружены у больных с ЛМП относительно группы доноров и больных с ХРЦ при анализе содержания лактоферрина и С3-компонента комплемента (рис. 3). Существенный рост уровня ЛФ у пациенток с ХРЦ может быть обусловлен не только увеличением числа нейтрофилов, но и их интенсивной дегрануляцией, которая является следствием гиперактивации клеток веществами бактериального происхождения, активированными компонентами комплемента и их фрагментами, и свидетельствует о воспалении. Концентрация ЛФ как маркера активации нейтрофильных гранулоцитов может служить показателем остроты и степени выраженности воспалительных реакций. Снижение уровня С3-компонента комплемента у больных с ЛМП по сравнению с группой здоровых женщин и больных с ХРЦ свидетельствует об ингибиции системы комплемента. Известно, что некоторые возбудители способны блокировать активацию системы комплемента: вирус простого герпеса содержит гликопротеин, который, соединяясь с С3b повышает нестабильность С3bВb-комплекса и тем самым замедляет классический и альтернативный пути активации комплемента; бактерии (стрептококки, кишечная палочка) содержат сиаловые кислоты, которые усиливают связывание фактора Н с фрагментом С3b.

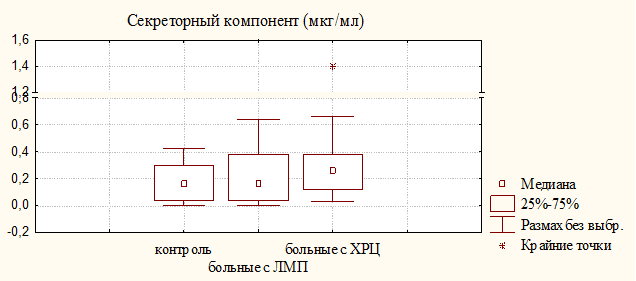
Рисунок 2. Уровень секреторного IgA и секреторного компонента в моче больных с ЛМП и ХРЦ и здоровых женщин (контроль)
Развитие локального воспаления в мочевыводящих путях под воздействием инфекционных факторов обусловлено альтерацией клеток. Типичной реакцией клетки на повреждение является дестабилизация цитоплазматической мембраны с выходом внутриклеточного содержания за ее пределы. В ответ на это происходит активация клеток мононуклеарно-фагоцитирующей системы с последующим выбросом пула медиаторов воспаления, синтезирующихся de novo, к которым относятся про- и противовоспалительные цитокины.
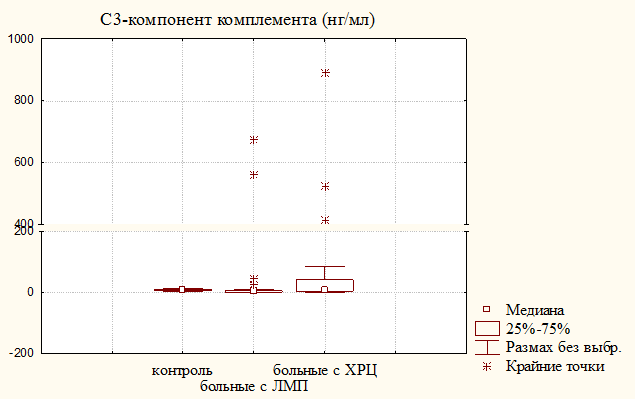

Рисунок 3. Содержание С3-компонента комплемента и лактоферрина в моче больных с ЛМП и ХРЦ и здоровых женщин (контроль)
В конечном итоге создаются благоприятные предпосылки для полного обезвреживания микроорганизмов в очаге воспаления. С другой стороны, нарушение динамического равновесия в системе взаимоконтролирующих факторов — провоспалительного (ФНО-a) и противовоспалительного (ИЛ-10) цитокинов — приводит к их накоплению и реализации деструктивных эффектов. У больных обеих групп наблюдался рост медианы для ФНО-a и снижение ее значения для ИЛ-10, при этом наибольший дисбаланс в системе цитокинов был обнаружен у больных с ХРЦ (рис. 4). Следовательно, развитие воспалительного процесса при хроническом цистите сопровождается нарастанием в моче провоспалительного цитокина в результате атаки, в первую очередь, бактериальными агентами эпителиального покрытия мочевого пузыря и активации локальных механизмов иммунной защиты слизистой оболочки от повреждения.
Анализ содержания ИЛ-15 в моче выявил снижение величины Ме, нижнего (25 %) и верхнего (75 %) квартилей у больных обеих групп по сравнению с контролем, статистическая разница установлена только для больных с ЛМП (рис. 4). ИЛ-15 продуцируется макрофагами, моноцитами, эпителиальными клетками; принимает участие в регуляции активности природных киллеров, лимфокинактивированных киллеров и цитотоксических Т-лимфоцитов, потому этот цитокин является важным для противоопухолевой защиты [10].
При детальном анализе результатов иммунологического исследования мочи в зависимости от выделенных возбудителей разного таксономического происхождения было показано, что наибольшая разница установлена для больных с ХРЦ: подгруппа больных, в моче которых обнаружены классические бактерии, имели наиболее повышенные величины Ме, 25 % и 75 % для IgA, IgM, IgG, sIgA, SC, ЛФ, ФНО-a/ИЛ-10 по сравнению с аналогичными показателями группы контроля и больных, в моче которых обнаружены моликуты (табл. 2).

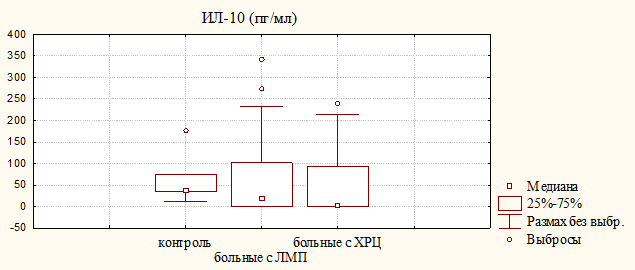
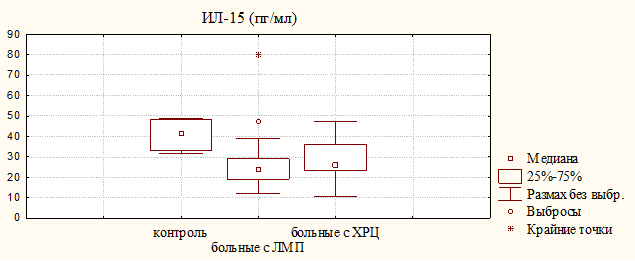
Рисунок 4. Содержание цитокинов в моче больных с ЛМП и ХРЦ и здоровых женщин (контроль)
Таблица 2.
Показатели гуморального иммунитета в моче у больных с ЛМП и ХРЦ в зависимости от таксономического происхождения обнаруженных возбудителей
|
Показа-тели |
Контроль- ная группа Me (25 %–75 %) |
Больные с ЛМП / Больные с ХРЦ |
||
|
микроорганизмы не выявлены (ч) n = 16 / 6 |
моликуты (м)
n = 8 / 8 |
классические бактерии (б) n = 8 / 9 |
||
|
IgА, мкг/мл |
1,75 (1,0—2,25) |
2,0 (1,2—3,5) 5,0 (2,5—10,0) * |
2,0 (1,4—3,1) 1,25 (0,5—1,55) |
3,2 (1,7—4,5) 2,9 (1,5—6,0) |
|
IgМ, мкг/мл |
0,25 (0—0,5) |
0,4 (0—0,72) 0,75 (0,4—0,9) ·б |
0,4 (0—0,58) 0,4 (0,4—0,4) ·б |
0,4 (0,18—0,62) Ñ 1,0 (0,72—1,08) * |
|
IgG, мкг/мл |
0 (0—2,0) |
0,75 (0—4,5) 2,5 (1,05–—10,0) |
0,25 (0—2,4) 0 (0—0) ·ч |
0 (0—3,25) 2,7 (0—9,2) |
|
sIgА, мкг/мл |
0 (0—0,15) |
0,45 (0—1,10) * 0,88 (0,75—1,52) * |
0,58 (0—1,28) 0,02 (0—0,65) |
0,20 (0—2,75) 0,80 (0,19—2,0) * |
|
SC, мкг/мл |
0,16 (0,04—0,3) |
0,12 (0,04—0,32) 0,24 (0,12—0,38) |
0,17 (0,06—0,35) 0,11 (0,08—0,30) ·б,ч |
0,16 (0,01—0,43) Ñ 0,52 (0,26—0,54) |
|
С3, нг/мл |
9,0 (6,0—11,0) |
2,5 (0,9—5,8) * Ñ 31,5 (19,0—84,0) * |
2,0 (1,4—3,9) * Ñ 6,25 (2,5—11,6) ·ч |
3,2 (2,0—5,8) Ñ 10,0 (4,0—46,0) |
|
ЛФ, нг/мл |
0 (0—1,0) |
1,5 (0—11,5) 6,5 (0—179,0) |
0,3 (0—9,6) 9,5 (0,9—19,1) * ·б |
0 (0—9,0) Ñ 142,0 (30,0—1265,0) * |
|
ФНОa, пг/мл |
16,0 (13,0—36,0) |
27,0 (7,0—45,0) 82,5 (44,0—193,5) * |
34,5 (26,0—101,5) 25,8 (21,5—50,0) |
69,0 (45,5—107,5) * ·ч 40,5 (23,5—96,5) * |
|
ИЛ-10, пг/мл |
37,0 (35,0—75,0) |
8,0 (0—126,5) 4,0 (0—240,0) |
30,5 (0—107,5) 75,0 (0—182,0) |
5,5 (0—42,5) 0 (0—4,0) * |
|
ИЛ-15, пг/мл |
41,2 (33,2—48,2) |
22,5 (17,0—27,4) * 30,0 (24,0—36,0) |
23,1 (20,9—37,5) 29,0 (24,0—39,2) |
24,0 (21,8—29,4) * 23,5 (23,1—28,0) |
Примечание: числитель — медиана, (25 %—75 %) для больных с ЛМП; знаменатель — медиана, (25 %—75 %) для больных с ХРЦ; достоверные различия (Р<0,05) по сравнению с группой контроля (*), с больными с ХРЦ (Ñ) и при сравнении между собой больных одной группы ( ·)
При сравнении изучаемых показателей у больных с ЛМП в зависимости от обнаруженных в моче возбудителей существенной разницы не обнаружено; только у больных с бактериурией отмечено существенное увеличение величин Ме, 25 % и 75 % для ФНО-a на фоне снижения этих показателей для ИЛ-10. Половина больных в данной подгруппе имели уровень sIgA менее 0,20 мкг/мл; а в подгруппе больных, у которых были выявлены в моче моликуты, величина медианы была выше (0,58 мкг/мл). У большинства больных с ЛМП, независимо от обнаруженных в моче возбудителей, уровень С3-компонента комплемента был значительно сниженным относительно контроля и больных с ХРЦ. Следовательно, наличие в моче микоплазм и уреаплазм не приводило к адекватной иммунологической перестройке со стороны слизистой оболочки мочевого пузыря даже у больных с хроническим воспалительным процессом в данном органе.
Больные с ХРЦ, в моче которых на момент забора материала не было обнаружено никаких возбудителей, по иммунологическим показателям похожи на больных, у которых воспалительный процесс в мочевом пузыре обусловлен бактериальной инфекцией. Состояние местного гуморального иммунитета в аналогичной подгруппе среди больных с ЛМП еще раз подтверждает мысль, что при лейкоплакии наблюдается слабый иммунологический ответ со стороны макроорганизма даже в присутствии бактерий.
Выводы.
1.Установлены достоверные отличия содержания секреторного IgA и лактоферрина в моче больных с ЛМП и ХРЦ относительно гриппы контроля, однако наибольшие отклонения выявлены у больных с ХРЦ.
2.В моче больных с ЛМП обнаружено существенное снижение уровня С3-компонента комплемента по сравнению с группой контроля и больными с ХРЦ, что свидетельствует об ингибиции системы комплемента, преимущественно при наличии моликутов в моче.
3.Повышение концентрации иммуноглобулина M и G в моче больных с ХРЦ подтверждает факт наличия воспалительного процесса в слизистой оболочке мочевого пузыря.
4.В моче больных с ЛМП и ХРЦ установлено нарушение равновесия в системе взаимоконтролирующих цитокинов — провоспалительного ФНО-a и противовоспалительного ИЛ-10, наиболее показательное — в группе больных с ХРЦ. Концентрация ИЛ-15 в моче была сниженной у больных обеих групп, но в большей мере у больных с ЛМП.
5.За результатами иммунологического исследования мочи в зависимости от обнаруженных в ней возбудителей наибольшие отклонения от контрольных показателей установлены для больных, в моче которых были обнаружены классические бактерии, и в первую очередь для женщин с ХРЦ. Наличие в моче моликутов у больных обеих групп не вызывало адекватной иммунологической реакции в ответ на воспалительный процесс, что свидетельствует о недостаточности мукозального иммунитета мочевого пузыря, возможно за счет их иммунодепрессивного действия.
Список литературы:
1.Адаскевич В.П. Инфекции, передаваемые половым путем. Руководство для врачей. — М., 1999. — С. 127—162.
2.Ильинская Е.В. Клинико-лабораторные особенности лейкоплакии слизистой оболочки мочевого пузыря у женщин / В кн.: Актуальные вопросы охраны здоровья населения регионов Сибири. Материалы научно- практ. конф. — Красноярск, 2007. — С. 197—199.
3.Ильинская Е.В., Лебедева Р.Н. Лейкоплакия мочевого пузыря и иммунный статус пациенток / В кн.: Актуальные вопросы диагностики и лечения урологических заболеваний: Материалы межрегиональной научно-практ. конф. урологов Западной Сибири, Белокуриха, 2007. — С. 245.
4.Лоран О.Б., Синякова Л.А., Косова И.В. Роль урогенитальных инфекций в этиологии цистита и необструктивного пиелонефрита у женщин // Урология. — 2005. — № 3. — С. 63—66.
5.Особенности хронического цистита с лейкоплакическими изменениями слизистой оболочки мочевого пузыря / А.И. Неймарк, С.И. Васильченко, Е.В. Ильинская [и др.] // Военно-медицинский журнал. — 2007. — Т. 328, № 6. — С. 58—61.
6.Раковская И.В. Микоплазмы человека и микоплазменные инфекции (Лекция. Часть I) // Клин. лабор. диагностика. — 2005. — № 2. — С. 25—32.
7.Реброва О.Ю. Статистический анализ медицинских данных: применение пакета прикладных программ STATISTIKA. — М.: Медиа Сфера, 2002. — C. 109—111.
8.Семенюк А.А., Смирнов Д.С. Лейкоплакия мочевого пузыря у женщин: диагностика и лечение // Мед. вестник МВД. — 2006. — Т. 21, № 3. — С. 250—251.
9.Cytokine repertoire of epithelial cells lining the human urinary tract / L. Hang, B. Wullt, Z. Shen [et al.] // The Journal of Urology. — 1998. — Vol. 159. — P. 2185—2190.
10.Decreased interleukin-15 from activated cord versus adult peripheral blood mononuclear cells and the effect of interleukin-15 in upregulating antitumor immune activity and cytokine production in cord blood / J.X. Qian, S.M. Lee, Y. Suen [et al.] // Blood. — 1997. — Vol. 90, № 8. — P. 3106—3117.
11.Kagnoff M.F., Eckmann L. Epithelial cells as sensors for microbial infection // J. Clin. Invest. — 1997. — Vol. 100. — P. 6—10.
12.Svanborg C., Godaly G., Hedlund M. Cytokine responses during mucosal infections: role in disease pathogenesis and host defence // Curr. Opin. Microbiol. — 1999. — № 2. — Р. 99—105.
дипломов


Оставить комментарий