Статья опубликована в рамках: XI Международной научно-практической конференции «Современная медицина: актуальные вопросы» (Россия, г. Новосибирск, 02 октября 2012 г.)
Наука: Медицина
Секция: Кардиология
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
ПЕРВЫЙ КЛИНИЧЕСКИЙ ОПЫТ ТРАНСПЛАНТАЦИИ МЕЗЕНХИМАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК ПРИ ОСТРОМ ИНФАРКТЕ МИОКАРДА
Джолдасбекова Алия Утепбаевна
д-р мед. наук, профессор ННМЦ, г. Астана
E-mail: smail_92@inbox.ru
Купенов Булат Габбасович
канд. мед. наук, зав. кардиологическим отделом ННМЦ, г. Астана
Федотовских Галина Васильевна
д-р мед. наук, профессор ННМЦ, г. Астана
Попова Надежда Владимировна
д-р мед. наук, профессор ННМЦ, г. Астана
В последние десятилетия отмечены значительные успехи в лечении пациентов с ишемической болезнью сердца (ИБС), в том числе с острым коронарным синдромом (ОКС) и сердечной недостаточностью (СН), — состояниями, сопровождающимися некрозом и дисфункцией определенного количества кардиомиоцитов [8]. При этом в отличие от других тканей миокард имеет крайне ограниченную способность к регенерации, причиной этого являются отсутствие специфических стволовых клеток (СК) в сердце и собственного потенциала кардиомиоцитов к делению [2, 3]. Поэтому, несмотря на улучшение выживаемости больных при использовании новых фармакологических препаратов, интервенционных и хирургических вмешательств, лечение таких пациентов продолжает оставаться важной задачей современной кардиологии в связи с большой распространенностью ИБС и увеличением среднего возраста населения [4]. В медикаментозных и хирургических методах лечения, которые призваны сохранить и улучшить функцию миокарда без восстановления некротизированных областей, при трансплантации стволовых клеток возможно создание новых устойчивых ростков нормально функционирующей сердечной ткани [12, 14]. Помимо способности дифференцироваться в различные типы клеток, включая клетки сердца, они способны также стимулировать ангиогенез [6], что объясняет потенциал широкого клинического применения стволовых клеток в кардиологии. Последнее время приобретает все большую популярность терапия инфаркта миокарда стволовыми мезенхимальными клетками с обнадеживающими результатами экспериментальных работ [13, 1].
Целью исследования является изучение безопасности и эффективности системного введения аллогенных мезенхимальных клеток костного мозга при остром инфаркте миокарда с подъемом сегмента ST (STEMI) и с выраженной систолической дисфункцией левого желудочка (EF<40 %).
Материал и методы исследования
Клинической базой открытого контролируемого исследования являлось кардиологическое отделение Национального научного медицинского центра г. Астаны, Республика Казахстан. Мезенхимальные стволовые клетки (МСК) были предоставлены «STEMEDICA Cell Tech. Inc.» (USA, California), произведены согласно требованиям cGMP и одобрены FDA (USA) для клинического применения. Для оценки морфо-функционального состояния МСК фиксировали в 2,5 % растворе глютаральдегида с постфиксацией в 1 % растворе четырехокиси осмия, проводили по общепринятой методике и заключали в эпон 812. Полутонкие и ультратонкие срезы получали на ультрамикротоме Leiсa E.M. ИС 7. Ультратонкие срезы контрастировали уранилацетатом и цитратом свинца по Рейнольдсу и изучали в электронном микроскопе Libra-120 (Carl Zeiss). Клинический протокол введения мезенхимальных стволовых клеток был разработан совместно ННМЦ и «STEMEDICA Cell Tech. Inc.» (USA, California) и одобрен FDВ (California, USA).
Нами было обследовано 35 пациентов (34 мужчин и 1 женщина) с острым инфарктом миокарда с подъемом сегмента ST (STEMI), без сахарного диабета, в возрасте до 60 лет, доставленные в экстренном порядке. Всем больным первые 2 часа с момента поступления в стационар проведено чрескожное коронарное вмешательство с открытием инфаркт зависимой артерии.
На этапе отбора всем пациентам выполнены следующие исследования согласно протоколу: клинические и биохимические анализы крови, исследование на онкомаркеры (РЭА, NSE, CYFRA,CA72-4,PCA, α-фетопротеин), ЭКГ, ЭХОКГ. У всех больных, отобранных для включения в исследование, было получено информированное согласие на участие в исследование. В основную группу были отобраны 20 пациентов, которым на 7 сутки провели трансплантацию МСК путем однократного внутривенного капельного введения в течение 60—90 минут в локтевую вену под контролем изменений артериального давления, частоты сердечных сокращений и термометрии. Контрольная группа 15 пациентов с тем же диагнозом, после ангиопластики на 7 сутки вводили физиологический раствор. Качество жизни больных с ХСН определяли по Миннесотскому опроснику (MLHFO).
Таблица 1.
Клиническая характеристика групп
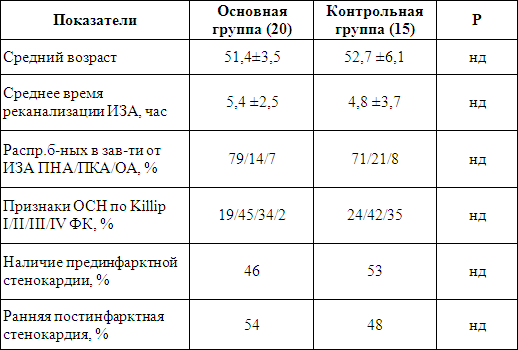
Среднее время реканализации, а также распространенность поражения коронарной инфаркт зависимой артерии в основной и контрольной группе достоверно не различались. По наличию прединфарктной и ранней постинфарктной стенокардии в сравниваемых группах достоверной разницы не выявлено. В основной группе признаки острой сердечной недостаточности по Killip IV ФК встречались в 2 % случаев, тогда как в контрольной группе их не было.
Статистическая обработка данных: все данные полученные в ходе исследования и анализа 35 пациентов, были внесены в базу данных Microsoft Excel. Статистическая обработка результатов проводилась в пакете программ Statistica 6,0.
Результаты исследования
При электронно-микроскопическом исследовании мезенхимных стволовых клеток, культивированных в условиях гипоксии, признаки ультраструктурной специфической дифференцировки отсутствовали. Высокое содержание эухроматина ядра и гиперплазированная сеть расширенных канальцев гранулярного эндоплазматического ретикулума (ГЭР) с хлопьевидным материалом в просвете свидетельствовали о высоком уровне белкового синтеза. Гранулярный эндоплазматический ретикулум тесно контактировал с мембранами митохондрий, формируя mitochondria associated membranes (рис. 1a). Митохондрии были представлены двумя типами — крупными набухшими деэнергизированными и мелкими регенерирующими конденсированными с электронно-плотным матриксом. Наблюдался плотный контакт мембран митохондрий разного типа (рис. 1a), возможно отражающий диффузию энергетических метаболитов. Комплекс Гольджи состоял из ряда крупных вакуолей. Отмечено явление микроклазматоза — образование и отрыв цитоплазматических выростов (рис. 1b).
a)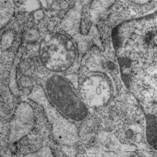 b)
b)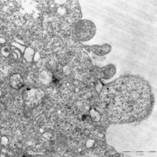
Рисунок 1. Мезенхимальные стволовые клетки под электронным микроскопом: a) мембраны, связанные с митохондрием и различные типы митохондрии; b) микроплазматоз
Оценка острых эффектов процедуры клеточной терапии показала, что внутривенное введение клеток не вызывало каких-либо серьезных осложнений. Во время процедуры трансплантации, длившейся 2—2,5 часа, не отмечалось динамики АД и ЧСС. В общем анализе крови, который исследовался в день трансплантации (утром) и через 2 часа после проведения процедуры, у больных отмечено умеренное повышение лейкоцитов, которое уже не регистрировалось в анализе крови, взятом на следующий день после процедуры. Ни у одного больного не было отмечено аллергической реакции.
В основной группе у всех пациентов отмечено субъективное улучшение общего состояния. Если у 54 % больных имело место ранняя постинфарктная стенокардия, то после клеточной терапии у 89 % пациентов не отмечали ни одного приступа стенокардии.
Таблица 2.
Динамика показателей после трансплантации МСК

Также в основной группе, после введения стволовых клеток (Таблица 2), отмечено тенденция к достоверному снижению высокочувствительного СРБ в динамике с 14 суток, через 3 и 6 месяцев (Р<0,001, соответственно), нормальные показатели достигнуты уже через 3 месяца. В контрольной группе (Таблица 3), также имелась тенденция к снижению, но оставаясь выше нормы через 3 и 6 месяцев (13,4±7,3 мг/дл; 9,2±5,6 мг/дл соответственно), что свидетельствует о влияние клеточной терапии на улучшение функции эндотелия. Уровень ангиопоэтина-1 у пациентов после трансплантации МСК был наивысшим через 6 месяцев. Объяснение тому, что на поздних стадиях ангиогенеза в ремоделировании сосудов участвует ангиопоэтин-1, с действием которого также связывают стабилизирующее влияние на сосуд.
При изучении уровня предсердного натрийуретического пептида (Pro-BNP), являющегося самым ранним маркером сердечной недостаточности, в основной группе после клеточной терапии имело место достоверное снижение данного показателя в динамике уже на 7 сутки после трансплантации, и снижение продолжалось через 3 месяца и к 6 месяцу уровень Pro-BNP (186,6±110,8 ng/ml) в пределах нормы. В группе, где не проводилась клеточная терапия, имеется тенденция к снижению, но к 6 месяцу уровень Pro-BNP оставался высоким (946,2±885 ng/ml), что свидетельствует о развитии систолической дисфункции левого желудочка в контрольной группе.
Анализ ангиогенных факторов, в изученных группах показал, что у пациентов после трансплантации стволовых клеток идет достоверное повышение, уже начиная с 7 дня после трансплантации маркеров ангиогенеза: VEGF (vascular endothelial growth factor), FGF (fibroblast growth factor), ANG-1 (angiopoietin-1) и максимальное значение достигается через 3 и 6 месяцев. А в группе, где не проводилась клеточная терапия в динамике через 3 и 6 месяцев не зарегистрировано рост маркеров ангиогенеза, а напротив, имеет тенденция к снижению.
Таблица 3.
Динамика контрольной группы (без трансплантации МСК)
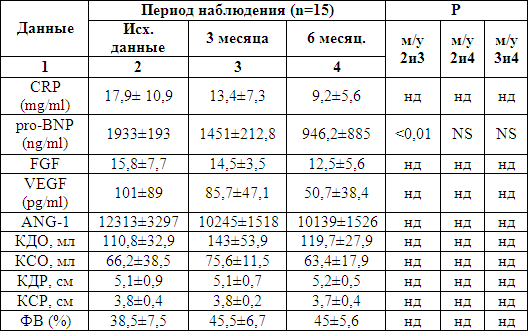
Анализ параметров сердечной функции по данным ЭХОКГ показал, что исходные параметры насосной функции сердца — фракция выброса левого желудочка (ФВЛЖ) — по исследуемым группам составила 38 % (38,4±6,1 и 38,5±7,5, соответственно). Через 3 месяца после клеточной терапии значение ФВЛЖ достоверно увеличилось на 13,9 % , составляя 52,3±6,8 %; к 6 месяцу увеличился на 16,3 % и достиг 54,7±5,3 %. В контрольной группе, где не проводилась клеточная терапия, ФВЛЖ имеет тенденцию к повышению, но не достоверно и выросла к 3 месяцу на 7 %, составляя 45,5±6,7 %; к 6-у месяцу на 10,5 % и составила 49±5,6 %.
Также у пациентов после клеточной терапии отмечалось значимое уменьшение объемов левого желудочка уже к 3 месяцу — КСО ЛЖ(62,6±27,7 мл, Р=0,007) и к 6 месяцу 58,3±24,3 (Р<0,001). Уменьшение КДО проходило от 128,4±40,3 мл исходно до 120,1±36,2 мл через 6 месяцев (Р>0,05). Отмечено, что на фоне клеточной терапии шло достоверное уменьшение ассинергических сегментов левого желудочка.
В контрольной группе, где клеточная терапия не проводилась, отмечалось увеличение КСО и КДО к 3 месяцу, с незначительным снижением к 6 месяцу. Функциональный класс ХСН в группе без клеточной терапии в среднем соответствовал 3,1±0,3, тогда как после клеточной терапии -1,5±0,7 (Р<0,05), что свидетельствует о нарастании систолической дисфункции левого желудочка с расширением полостей сердца и развитием хронической сердечной недостаточности.
Обсуждение
Мезенхимальные стволовые клетки костного мозга стимулируют ангиогенез. Они секретируют широкий спектр ангиогенных и антиапоптотических факторов, причем экспрессия многих из них повышается в условиях гипоксии [10]. Секреция ростовых и антиапоптотических факторов, которые обладая паракринным действием, стимулируют рост новых сосудов, предотвращают апоптоз эндотелиальных и гладкомышечных клеток сосудов, способствуют выживанию кардиомиоцитов в условиях гипоксии. Использованные в нашей работе мезенхимальные стволовые клетки тоже культивированы в условиях гипоксии.
По данным Iso et al. (2007) также было показано, что внутривенное введение мезенхимальных стволовых клеток позволяет улучшить функциональные показатели сердца через 3 недели после инфаркта миокарда, что объясняется транзиторным паракринным воздействием введенных клеток, способствующим защите кардиомиоцитов и эндотелиальных клеток от гибели и стимуляции ангиогенеза (7). Общий регенераторный эффект трансплантации МСК может быть обусловлен также и их противовоспалительным влиянием. В работе Lee et al. (2009) было показано, что МСК, осевшие после внутривенной трансплантации в легких, способны активироваться и начать секрецию противовоспалительного белка TSG-6 (11). Учитывая, что хронический воспалительный процесс считается важным аспектом прогрессирования атеросклероза, противовоспалительное воздействие МСК представляется эффективным для улучшения сердечно-сосудистого прогноза. Кроме того, системное введение МСК секретирует и другие факторы, обладающих антиапоптотическим и ангиогенным эффектом, оказывая благотворное влияние на поврежденный миокард [1].
В развитии коронарной сети важную роль играют ростовой ангиогенный фактор VEGF (vascular endothelial growth factor), вовлеченный в васкулогенез и ангиогенез, секретируемый кардиомиоцитами [9]. В экспериментах на трансгенных мышах получено генетическое доказательство того, что недостаточная доступность ангиогенного фактора VEGF приводит к развитию ишемической болезни сердца [5]. Неоваскуляризация области инфаркта миокарда является признаком нормального заживления после инфаркта миокарда. Поэтому ранее назначение клеточной терапии в составе комплексной терапии при остром инфаркте миокарда с подъемом сегмента ST представляется оптимальным способом воздействия на процессы неоваскуляризации ишемического очага с целью нормализации перфузии сердечной мышцы и восстановления ее сократительной способности. Следует отметить, что относительно небольшое увеличение фракции выброса левого желудочка значительно снижает вероятность развития застойной сердечной недостаточности.
Выводы
1.Трансплантация аллогенных мезенхимальных стволовых клеток при остром инфаркте миокарда с подъемом сегмента ST после ангиопластики, является безопасной процедурой.
2.Сочетание реваскуляризации миокарда с введением МСК при остром инфаркте миокарда с подъемом сегмента ST приводит к улучшению общей и локальной сократительной функции миокарда, а также нормализации систолического и диастолического наполнения левого желудочка.
3.Системное введение МСК стимулирует неангиогенез у пациентов с острым инфарктом миокарда, предупреждая ишемии в ремоделирующихся, жизнеспособных участках миокарда и может применяться самостоятельно или в сочетании с ангиопластикой.
4.Ультраструктура мезенхимных клеток отражала адаптационную системную реакцию на гипоксию в условиях культивирования in vitro, включая синтез защитных адаптивных белков, усиление мощности митохондриального аппарата и увеличение рецепторной поверхности клеток путем микроклазматоза.
Список литературы:
1.Головкин А.С., Великанова Е.А., Матвеева В,Г. и др. Оценка механизмов терапии инфаркта миокарда стволовыми мезенхимальными клетками в эксперименте // Стволовые клетки и регенеративная медицина. — 2011. — 318 с.
2.Румянцев П.П. Кардиомиоциты в процессах репродукции, дифференцировки и регенерации. Л: Наука, 1982.
3.Beltrami A.P., Urbanec K., Kajstura J et al. Evidence that human cardiac myocytes divide after myocardial infarction // N.Engl.J.Med. — 2001; 344: 1750—1757.
4.Berry C., Murdoch D., Mc Murray J Economycs of chronic heart failure // Eur.J. Heart Failure — 2001; 3: 383—291.
5.Carmeliet, P., et al. Impaired myocardial angiogenesis and ischemic cardiomyopathy in mice lacking the vascular endothelial growth factor isoforms VEGF164 and VEGF188 // Nat Med. — 1999; 5(5): 495—502.
6.Eisenberg L.M., Moreno R. Multiple stem cell populations contribute to the formation of the myocardium // Ann N Y Acad Sci. — 2005. — V. 1047. — P. 38—49.
7.Iso Y., Spees J.L., Serano C.et al. Multipotent human stromal cells improve cardiac function after myocardial infarction in mice without long-term engraftment// Biochem. Biophys. Res. Commun. — 2007; 354(3): 700—6.
8.Koh G., Soonpaa M., Klug M. et al. Strategies for myocardial repair// J.Int.Cardiol. — 1995; 8: 4: 387—393.
9.Kinnaird T., Stabile E., Burnett M.S. et al. Marrow-derived stromal cells express genes encoding a broad spectrum of arteriogenic cytokines and promote in vitro and in vivo arteriogenesis through paracrine mechanisms// Circ Res. — 2004; 94: 678—685.
10.Kinnaird T., Stabile E., Epstein S.E. Fuchs S. Current perspectives in therapeutic myocardial angiogenesis // J.Interv.Cardiol. — 2003; 16(4): 289—297.
11.Lee R.H., Pulin A.A., Seo M.J. et al. Intravenous hMSCs improve myocardial infarction in mice because cells embolized in lung are activated to secrete the anti inflommatory protein TSG-6// Cell.Stem.Cell. — 2009; 5(1): 54—63.
12.Nakamura T., Schneider M.D. The way to a human’s heart is through the stomach: visceral endoderm-like cells drive human embryonic stem cells to a cardiac fate // Circulation. — 2003. — V. 107. — P. 2638—9.
13.Orlic D., Kajstura J. Quaini F. et al. Mobilized bone marrow cells repair the infracted heart, improving function and survival // Proc Natl Acad Sci USA. — 2001. — V. 98. — P. 10344—9.
14.Sugi Y., Markwald R.R. Endodermal growth factors promote endocardial precursor cell formation from precardiac mesoderm // Dev. Biol. — 2003. — V. 263. — P. 35—49.
дипломов


Оставить комментарий