Статья опубликована в рамках: X Международной научно-практической конференции «Современная медицина: актуальные вопросы» (Россия, г. Новосибирск, 05 сентября 2012 г.)
Наука: Медицина
Секция: Анестезиология и реаниматология
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
ИСПОЛЬЗОВАНИЕ СУБАНЕСТЕТИЧЕСКИХ ДОЗ КЕТАМИНА У КАРДИОХИРУРГИЧЕСКИХ БОЛЬНЫХ КАК КОМПОНЕНТА МУЛЬТИМОДАЛЬНОГО ОБЕЗБОЛИВАНИЯ В ПОСЛЕОПЕРАЦИОННОМ ПЕРИОДЕ
Доев Денис Петрович
канд. мед. наук, ассистент кафедры анестезиология
и реаниматология, СОГМА, г. Владикавказ
E-mail: Doev.Denis@mail.ru
Сердечно-сосудистые заболевания занимают первое место среди причин смертности (33 % в мире и 55 % в России) и инвалидизации населения планеты [3]. Наиболее частой причиной смерти является острый инфаркт миокарда [2]. Поэтому лечению ишемической болезни сердца (ИБС), в том числе хирургическим методам, придается во всем мире большое значение. По данным А.Д. Гуреева, в развитых странах, аорто-коронарное шунтирование сердца составляет до 50—60 % кардиохирургических программ [1].
Исходы оперативных вмешательств и достижение максимального лечебного эффекта зависят не только от техники и качества выполнения операции, но и от реабилитационно-восстановительных мероприятий в послеоперационном периоде, где адекватное купирование болевого синдрома имеет первостепенную задачу. Сами по себе послеоперационные болевые ощущения представляют только видимую часть айсберга, являясь первопричиной развития патологического послеоперационного синдромо-комплекса.
Острая боль повышает ригидность мышц грудной клетки и передней брюшной стенки, что ведет к снижению дыхательного объема, жизненной емкости легких и альвеолярной вентиляции. Следствием этого является коллапс альвеол, гипоксемия и снижение оксигенации крови [6]. Затруднение откашливания на фоне болевого синдрома нарушает эвакуацию бронхиального секрета, что способствует ателектазированию с последующим развитием легочной инфекции.
Боль сопровождается гиперактивностью симпатической нервной системы, что клинически проявляется тахикардией, гипертензией и повышением периферического сосудистого сопротивления. Помимо этого, симпатическая активация вызывает послеоперационную гиперкоагуляцию и, следовательно, повышает риск тромбообразования.
Активация вегетативной нервной системы на фоне болевого синдрома повышает тонус гладкой мускулатуры кишечника со снижением перистальтической активности и развитием послеоперационного пареза. Парентеральное введение опиоидов может усиливать и продлевать данный эффект [5].
В ряде исследований показано существенное ухудшение иммунного статуса и повышение частоты септических осложнений периоперационного периода при неадекватном купировании послеоперационной боли, особенно у пациентов повышенного риска [8]. И, наконец, ноцицептивная стимуляция боль-модулирующих систем спинного мозга может привести к расширению рецепторных полей и повышению чувствительности боль воспринимающих нейрональных структур спинного мозга. Результатом является формирование хронических послеоперационных нейропатических болевых синдромов, в основе которых лежат вышеупомянутые пластические изменения ЦНС. В частности, известно, что от одной до двух третей пациентов, перенесших операции на грудной клетке, в течение длительного времени страдают от постторакотомических болей [7]. Частота их развития зависит от интенсивности боли в раннем посленаркозном периоде и адекватности анальгезии в течение первой послеоперационной недели.
Однако в настоящее время, несмотря на наличие большого количества обезболивающих препаратов и различных методик обезболивания, острая послеоперационная боль у кардиохирургических пациентов остается серьезной проблемой и требует новых подходов или, как сейчас принято говорить —«асимметричных решений».
Основная тенденция клинических исследований последних лет в области послеоперационной анальгезии — использование принципа мультимодальной защиты боли (использование двух и более анальгетиков с разным воздействием на патогенетические звенья болевого синдрома) с акцентом на профилактическую (до нанесения операционной травмы) защиту. С этой целью мы решили использовать в составе мультимодального обезболивания препарат обладающий свойствами неконкурентного антагониста NMDA-рецепторов-кетамин (рис. 1).
Рис. 1 Молекула кетамина
Выбор данного препарата не случаен. Уникальность его заключается в способности взаимодействовать практически со всеми известными нейротрансмиттерными системами: холинергической, моноаминергической, пуринергической, опиатной. Кетамин действует на никотиновые и мускариновые рецепторы, он блокирует натриевые каналы периферической и центральной нервной системы, действует на µ-, δ- и κ-опиатные рецепторы, препятствует гипервозбудимости спинальных нейронов, снижая суммацию боли (рис. 2). По данным F.Adama использование субанестетических доз кетамина при тотальном эндопротезировании коленного сустава потребовало достоверно меньше количество опиодных анальгетиков [4].
Рис. 2. Расположение NMDA-рецепторов в спинальных нейронах
Однако использование кетамина у больных с ИБС не желательно ввиду присущего ему положительного хронотропного и инотропного действия. Данное обстоятельство способствует повышению потребления кислорода над его доставкой, что недопустимо у больных с коронарной недостаточностью. В доступной литературе мы не нашли исследования касающиеся использование микродоз кетамина в составе мультимодальной анальгезии (опиоиды, НПВП) у кардиохирургических больных оперированных в условиях ИК.
Цель исследования:
1.Повысить качество послеоперационной анальгезии у кардиохирургических больных с использованием антагониста NMDA-рецепторов-кетамин.
2.Оценить влияние субанестетических доз кетамина на показатели сердечно-сосудистой системы у кардиохирургических больных.
Материал и методы исследования:
В исследование включено 97 пациентов с ишемической болезнью сердца оперированных в ФГБУ СК ММЦ г. Беслан. Пациентом было выполнено аортокоронарное шунтирование (АКШ), маммарокоронарное шунтирование (МКШ) в условиях искусственного кровообращения с поддержанием условной нормотермией тела
(34—36 С). Наркоз проводился с использованием севорана
МАК 0,6—0,9 об. %, пропофола 800±200 мг, фентанила 700±100 мкг, эсмерон 7±2 мкг/кг/мин. В основной группе (45 больных) перед кожным разрезом применялся кетамин в дозе 0,5 мг/кг,
с последующим постоянным в/в ведением через инфузомат со скоростью 0,1 мг*кг/час в течение 24 часов. В послеоперационном периоде все больные получали нестероидные противовоспалительные препараты (кеторолак) и опиоидные анальгетики (промедол 2 %) по требованию. Больные были сопоставимы по возрасту (45—70 лет), время окклюзии аорты (87±20 минут), частоте использования гемотрансфузии (1—3 дозы), проведения ультрафильтрации, а также по показателям центральной гемодинамики (ЧСС, ОПСС, ФВ и т. д.).
Для оценки интенсивности боли в послеоперационном периоде использовали визуально аналоговую шкалу боли — 100 (ВАШ). Оценка болевого синдрома проводилась через 6 часа, 12 часов
и 18 часов с момента поступления из операционной как в покое, так и при кашле. Кроме того, оценивали частоту использования наркотических аналгетиков в первые 18 часов, а также длительности нахождения пациента на искусственной вентиляции легких (ИВЛ). В реанимационном отделении с помощью импедансного кардиографа оценивали следующие гемодинамические показатели: АДсист (систолическое артериальное давление), АДдиаст (диастолическое артериальное давление), ЧСС (частота сердечных сокращений), ОПСС, УО (ударный объем) анализ ЭКГ в отведениях II и V5.
Таблица 1.
Результаты исследования и выводы
|
Показатель |
6 часа |
12 часов |
18 часов |
|||
|
Основн. группа n-45 |
Контрол. группа n-52 |
Основн.
группа |
Контрол.
группа |
Основн. группа n-45 |
Контрол.
группа |
|
|
ВАШ покой |
33±8 * |
47±7 |
41±5 |
38±3 |
44±5 * |
57±4 |
|
ВАШ кашель |
51±5 * |
67±5 |
54±7 |
53±8 |
57±7 * |
69±5 |
* различия показателей между группами достоверны (р<0,05)
Использование в протоколе мультимодальной анальгезии субанестетических доз неконкурентного антагониста
NMDA-рецепторов-кетамина привело к достоверному снижению выраженности болевого синдрома в первые сутки наблюдения (табл. 1; диаграмма 1).
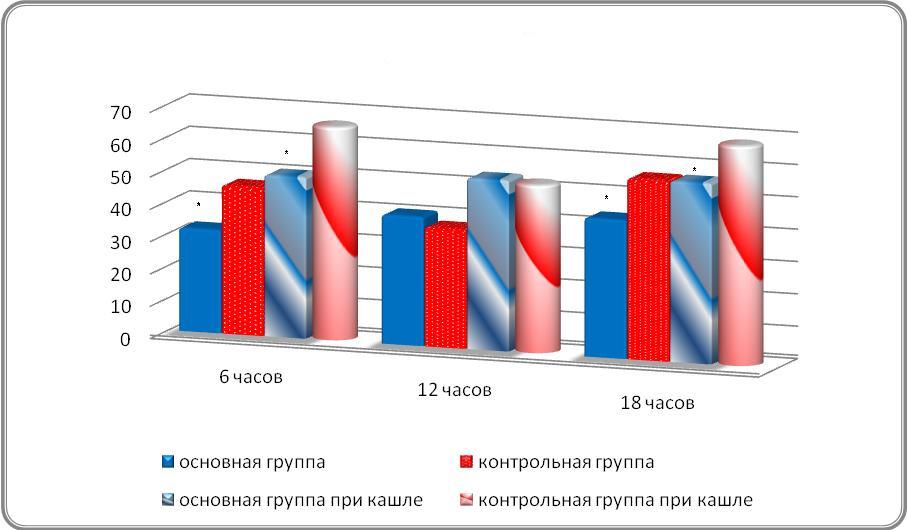
* различия показателей между группами достоверны (р<0,05)
Диаграмма 1. Оценка боли
Как видно из таблицы 1, интенсивность болевого синдрома у пациентов основной группы была достоверна меньше через 6 и 18 часов по сравнению с контрольной группой. Следует отметить, что статистически значимые различия были нами получены даже на фоне более частого использования наркотических анальгетиков в контрольной группе (диаграмма 2).
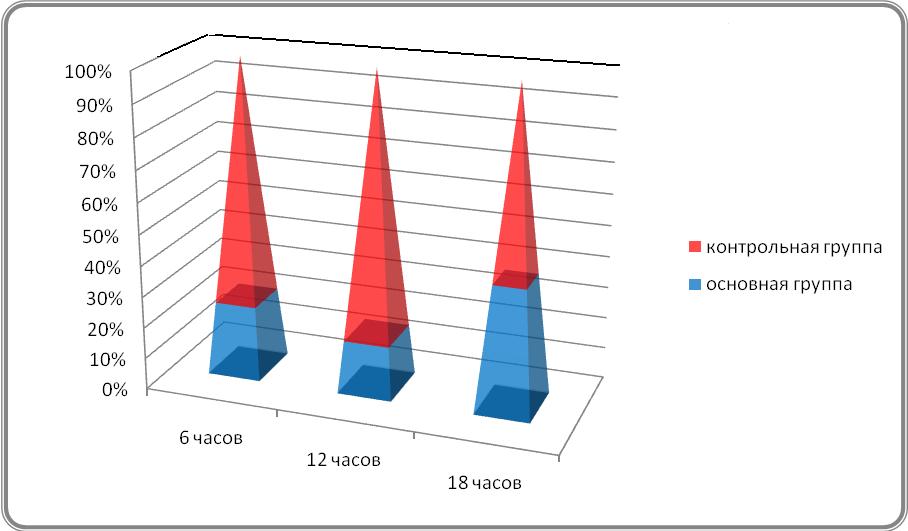
Диаграмма 2. Частота использования промедола
Более частое использование опиоидов способствовало более длительному нахождению больных контрольной группы на продленной ИВЛ (в среднем на 2—3часа), так как препараты данной группы вызывают седативный эффект и потенцирует действие других седативных препаратов. При сравнении гемодинамических показателей в основной группе не было выявлено увеличения ЧСС, УО, ОПСС, что говорит об отсутствие влияния субанестетической дозы кетамина на показатели сердечно-сосудистой системы (ССС).
Однако отсутствия влияния кетамина на ССС возможно было обусловлено нивелированием симпатической активности кетамина В-блокатором эсмололом, который получают все наши больные после экстубации в дозе 12,5—25 мг.
Выводы
Таким образом, можно говорить о безопасном применении в составе мультимодального обезболивания субнаркотических доз кетамина у кардиохирургических больных. Включение кетамина в протокол анальгезии приводит к достоверному снижению выраженности болевого синдрома, в потребности опиоидных анальгетиков и как следствие, ранней реабилитации пациента.
Список литературы:
1.Гуреев А.Д., Труханова И.Г. Применение искусственного кровообращения при операциях реперфузии миокарда в клиниках САМГМУ. Научные тезисы Материалы Пленума правления ФАР 2011 г.
2.Чазов Е.И. В России возросла смертность от сердечно—сосудистых заболеваний // Мед. новости. — 2003. — № 1. — С. 4—6.
3.Шиганов М.Ю., Волочков В.А. Влияние пульсирующего и непульсирующего режимов искусственного кровообращения на течение перфузии и послеоперационного периода//Вестник анестезиологии и реаниматологии. Том 7, № 4., 2010. С. — 3
4.Adam F., Chauvin M. Smal dose ketamin infusion improves postoperative analgesia and rehabilitation after tjtalkneearthroplasty// Anesth.Analg.2005;100:475—480
5.Leon-Casasola, Karabella D, Lema M. The effects of epidural bupivacaine-morphine and intravenous PCA morphine on bowel function and pain after radical hysterectomies. // Anesth.Analg. — 1993. — V. 76. — P. 73.
6.Liu S, Carpenter R, Neal J. Epidural anesthesia and analgesia. Their role in postoperative outcome. // Anesthesiology. — 1995. — V.82. — P. 1474—1506.
7.Mailis A, Umana M, Feindel CM. Anterior intercostal nerve damage after coronary artery bypass graft surgery with use of internal thoracic artery graft. Ann Thorac Surg 2000; 69: 1455—8.De Kock M., Waterloos H. Balanced analgesia in the perioperative period: is there place for ketaminе? // Pain.2001;92:373—380
8.Yeager M, Glass D, Neff R, Brick-Johnsen T. Epidural anaesthesia and analgesia in high risk surgical patients. // Anesthesiology. — 1988. — V. 73. — P. 729—736.
дипломов


Оставить комментарий