Статья опубликована в рамках: V Международной научно-практической конференции «Современная медицина: актуальные вопросы» (Россия, г. Новосибирск, 02 апреля 2012 г.)
Наука: Медицина
Секция: Онкология
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
ИЗМЕНЕНИЕ СОДЕРЖАНИЯ ЖЕЛЕЗА И МЕДИ В ОПУХОЛЯХ, ВОЗМОЖНЫЕ МЕХАНИЗМЫ
Бакурова Елена Михайловна
канд. мед. наук, доцент каф. химии, ДонНМУ, г. Донецк
Дорошкевич Виктор Сергеевич
науч. сотр., НИЧ каф. биохимии, ДонНУ, г. Донецк
Борзенко Берта Георгиевна
д-р. биол. наук, проф. каф. химии, ДонНМУ, г. Донецк
Шендрик Александр Николаевич
д-р. хим. наук, проф., зав. каф. химии, ДонНМУ, г. Донецк
Ищенко Роман Викторович
канд. мед. наук, обл. онколог, Донецкий Областной Противоопухолевый Центр, г. Донецк
Е-mail: 32023@mail.ru
Известно, что одним из механизмов опухолевой инвазии является генерация активных форм кислорода, т. ч. перекиси водорода, ее диффузия в межклеточное пространство. При этом в клетках опухолевой стромы инициируется синтез цитокинов, сосудистого эндотелиального фактора роста (VEGF), активируются матриксные металлопротеиназы. Все эти процессы являются механизмами ангиогенеза, активируя новообразование сосудов в растущей опухоли. Известно о неравномерной оксигенации ее участков, об активации ангиогенеза в условиях гипоксии. Это и происходит в периферических отделах пролиферирующей опухоли, в том числе за счет активации процессов образования активных форм кислорода (АФК) и свободнорадикального окисления [1]. Существуют пути направленной генерации свободных радикалов за счет образования АФК, в том числе процессы последовательного присоединения электронов к кислороду в присутствии ионов металлов с переменной степенью окисления. К последним принадлежат железо, медь. Среди многочисленных функций этих металлов в организме человека для них характерно мощное прооксидантное действие [8].
Целью работы является определение особенностей содержания металлов переходной группы, а именно железа и меди, в опухолях по сравнению с нетрансформированными тканями, а также выяснение возможных механизмов их перераспределения. Считаем, что это будет способствовать расширению знаний о роли дисбаланса металлов в патогенезе опухолевой трансформации, а именно, в реализации механизмов ее инвазии.
Материалы и методы
Содержание железа и меди в тканях и эритроцитах крови определено у 8 больных раком желудочно-кишечного тракта (ШКТ) распространенных стадий (T3-4N1-xM0-x). Одновременное исследование содержания металлов проведено в 8 образцах карцином желудка и кишечника по сравнению с 8 образцами нетрансформированных тканей этих органов в краях резекции, а также в гемолизатах эритроцитов периферической венозной крови, полученной из локтевой вены, а также в гемолизатах эритроцитов венозной крови, оттекающей от органа. Забор материала проводился во время хирургического лечения в условиях Донецкого Областного Противоопухолевого Центра. Предварительно от больных было получено согласие на участие в исследовании. Содержание металлов в образцах биоматериала было определено методом атомно-эмиссионной спектрометрии. Для статистической обработки результатов использовались программы пакета «MedStat».
Результаты и их обсуждение
Согласно с полученными данными содержание железа в тканях (как в контрольных образцах, так и в опухолях) преобладает над содержанием меди (соответственно, 63,44 ± 9,52 мкг/г и 7,5 ± 2,9 мкг/г, р<0,01). Это хорошо согласуется с данными других авторов [8], а также многообразием функций микроэлемента — железа в клетках. При сравнении уровней металлов в опухолях и в нетрансформированных тканях установили, что уровни железа и меди в опухолях преобладают над их содержанием в отдаленных от опухолей тканях слизистой оболочки (СО) (рис. 1). Нами установлено повышение уровней железа (в 1,3—1,6 раза) и меди (в 1,6—2,4 раза) в опухолях желудка и кишечника по сравнению с контрольными образцами тканей. На наш взгляд, интересным является случай, когда содержание железа в опухоли и отдаленной контрольной СО были почти неизменными — содержание Fe в опухоли было 58 мкг/г, а в СО — 60 мкг/г, но при этом для меди в этой же именно опухоли было зарегистрировано рекордное ее содержание — 44,1 мкг/г, в то время как содержание в СО не отличалось от показателей в других образцах СО — 3,8 мкг/г. Возможно, что именно железо и медь являются теми эссенциальными элементами, которые вовлекаются опухолями в процессы генерации АФК и инвазии. Полученные результаты согласуются с данными о перераспределении некоторых металлов в опухолях [7], о накоплении среди других металлов именно меди, что является характерным для активно пролиферирующих аденокарцином.
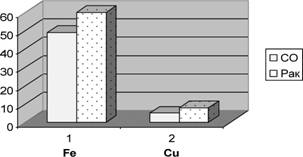
Рис 1. Изменение содержания металлов переходной группы в опухолях по сравнению с нетрансформированными тканями, мкг/г.
Важную роль в канцерогенезе именно Fe и Cu могут иметь, благодаря их способностям инициировать окислительные реакции, активировать кислород за счет неспецифического комплексирования с их ионами во время реакций Фентона и Хабера — Вейса при взаимодействии металлов (в первую очередь железа) с перекисью водорода, образуя наиболее токсичную форму АФК — гидроксильный радикал (НО·). По своей реакционной способности гидроксильный радикал превосходит даже атомарный кислород (в 300 раз), обладает мощными разрушительными свойствами [6]. Он обладает максимальным повреждающим действием как на ДНК и РНК, так и на углеводы, аминокислоты, липиды. В повреждении и структурной модификации клеточных мембран микроокружения опухоли, кроме НО, определенную роль также имеют другие АФК — супероксид, синглетный кислород, перекись водорода. Так Н2О2, являясь относительно стабильной молекулой в присутствии многих органических соединений, может накапливаться и легко преодолевать мембраны [6]. Проникая внутрь клеток и взаимодействуя с ионами железа или меди, способен выполнять уже описанную роль источника НО·. Также в присутствии ионов металлов, кроме спонтанной окислительной модификации белков, происходит индуцированная металлами окислительная модификация белков [2]. Известно, что такие измененные белки становятся более чувствительными к протеолизу. Следовательно, накопление металлов переходной группы различными путями может способствовать инвазии опухоли в окружающие ткани.
Параллельно с определением содержания металлов в тканях, их определяли в эритроцитах периферической и непосредственно в оттекающей от пораженного органа венозной крови. Содержание железа варьировало как в эритроцитах периферической крови (от 12340 до 1862 мкг/г), так и в оттекающей крови (от 10397 до 1023 мкг/г). Однако при попарном сравнении в каждом частном случае содержание железа в эритроцитах оттекающей крови было ниже (t-критерий сравнения парных совокупностей), а снижение его уровней колебалось от 2,26 до 1,2 раза (рис. 2).
В это же время содержание меди изменялось по-разному, и не всегда было ниже в эритроцитах оттекающей крови. Трудно утверждать, но возможно, что именно эритроциты являются источником железа при его перераспределении в опухоли. Основанием для этого могут быть данные о том, что около 10 % гемоглобина эритроцитов связано с мембраной [3], такой гемоглобин имеет относительно высокое сродство к О2. При действии на него НО·, протеазный комплекс эритроцитов реализует процесс деградации Hb [3]. Гем, который при этом может высвобождаться из гемоглобина, является липофильным соединением с мощными прооксидантными свойствами (благодаря наличию в нем железа). Это может приводить к повреждению мембранных белков и ПОЛ (перекисному окислению липидов) при проникновении его через мембрану [3].
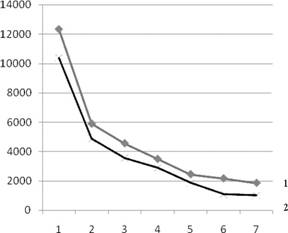
Рис. 2. Индивидуальные показатели уровней железа в периферической крови и в оттекающей от пораженного органа, мкг/г.
Кроме этих механизмов перераспределения содержания железа в опухолевой строме по сравнению с контрольными образцами тканей, является возможным непосредственный гемолиз эритроцитов, особенно их дефектных или стареющих форм из-за интенсификации в них процессов окисления липидов и деструкции мембран [4]. Следовательно, изменения метаболизма и структуры мембран эритроцитов, действительно, могут непосредственно быть связанными с перераспределение железа, т. ч. и в опухолях.
Таким образом, одним из существенных механизмов при опухолевой инвазии может стать повышение содержания железа и меди в опухолевой ткани. Эти металлы способны непосредственно принимать участие в генерации АФК опухолью, активации ими путей ангиогенеза и продвижения опухоли в окружающие ткани. Эритроциты могут быть донорами железа для опухолей.
Список литературы:
- Бакурова О. М., Борзенко Б. Г., Дорошевич В. С., Шендрик О. М. Зміни вмісту металів перехідної групи в слизовій шлунка як один з механізмів пухлинної агресії // Мед. хімія. — 2011. — Т. 13, № 4 (49). — С. 187.
- Дубинина Е. Е., Коновалов П. В., Солитернова И. Б. и ДР. Окислительная модификация белков плазмы крови у пожилых людей с сосудистой деменцией // Укр. Біохім. Журн. — 2001. — Т. 73, № 1. — С. 125—131.
- Калиман П. А., Баранник Т. В. Метаболизм гема и оксидативный стресс // Укр. Біохім. Журн. — 2001. — Т. 73, № 1. — С. 5—13.
- Лишневская В. Ю., Дужак Г. В. Эритроциты при старении // Матеріали IV національного конгресу геронтологів і геріатрів України , 11—13 жовтня 2005 р., м. Київ. — Проблемы старения и долголетия. — 2005. — Т. 14 (приложение).— С. 157—158.
- Новицкий В. В., Рязанцева Н. В., Степовая Е. А. Молекулярные нарушения мембраны эритроцита при патологии разного генеза являются типовой реакцией организма: контуры проблемы // Бюллетень сибирской медицины. — 2006. — № 2. — С. 62—69.
- Учебно-методическое пособие по спецкурсу «Радикальные реакции в клетке» (для студентов специальности «Биохимия»)/Авт.: А. Н. Шендрик, Л. В. Каниблоцкая — Донецк: ДонНУ, 2007. — 152 с.
- Mohammad Muzaffar Mir, N. A. Dar, M.A. Malik et al. Studies on association between Copper excess, Zinc deficienty and P53 mutations in esophageal squamous cell carcinoma from Kashmir valley, India — a high risk area // Intern. J. of Health Sciences. — Vol. 1, № 1. — 2007. — p. 35—41.
- Maulik S. K., Kumar S. Oxidative stress and cardiac hypertrophy // IIOABJornal. — Vol. 2, Issue 6. — 2007. — p. 107—113.
дипломов


Оставить комментарий