Статья опубликована в рамках: LI Международной научно-практической конференции «Современная медицина: актуальные вопросы» (Россия, г. Новосибирск, 11 января 2016 г.)
Наука: Медицина
Секция: Инфекционные болезни
Скачать книгу(-и): Сборник статей конференции
дипломов
АНАЛИТИЧЕСКАЯ ПЛАТФОРМА ИММУНОХРОМАТОГРАФИЧЕСКОЙ ДВУХУРОВНЕВОЙ ДИАГНОСТИКИ ОПАСНЫХ И РЕЗИСТЕНТНЫХ ИНФЕКЦИЙ НА ОСНОВЕ ПРОТЕОМНЫХ ТЕХНОЛОГИЙ
Выходные данные сборника:
ANALYTICAL PLATFORM OF TWO-LEVEL IMMUNOASSAY DIAGNOSIS OF HAZARDOUS AND RESISTANT INFECTIONS BASED ON PROTEOMICS TECHNOLOGIES
Pavel Gladyshev
doctor of Chem. Science, Professor of Chemistry, New Technologies and Materials Department of State University “Dubna”,
Russia, Moscow region, Dubna
Alexey Vasiliev
doctor of Tech. Science, Leading Researcher of National Research Centre “Kurchatov Institute”,
Russia, Moscow
Oleg Morenkov
doctor of Biol. Science, Head of Laboratory Cell Cultures and Cellular Engineering of Institute of Cell Biophysics,
Russia, Pushchino
Veronica Vrublevskaya
candidate of Biol. Science, Senior Researcher of Laboratory Cell Cultures and Cellular Engineering of Institute of Cell Biophysics
Russia, Pushchino
Yuri Tumanov
doctor of Biol. Science, Leading Researcher of CollectionMicroorganisms Department of State Research Center of Virology and Biotechnology “Vector”, Russia, Novosibirsk, Koltsovo
Alexander Boldyrev
candidate of Biol. Science, Senior Researcher of CollectionMicroorganisms Department of Research Center of Virology and Biotechnology “Vector”, Russia, Novosibirsk, Koltsovo
Sergey Dezhurov
researcher Research Institute of Applied Acoustics,
Russia, Moscow region, Dubna
Dmitry Krilsky
doctor of Chem. Science, Head of Laboratory of Research Institute of Applied Acoustics,
Russia, Moscow region, Dubna
Sagila Ibragimova
graduate Student of State University “Dubna”,
Russia, Moscow region, Dubna
Работа выполнена при поддержке Российского научного фонда в рамках гранта № 15-19-00229.
АННОТАЦИЯ
В рамках концепции контроля и предупреждения биологических угроз Федерального медико-биологического агентства России разработана концепция аналитической платформы двухуровневой иммунохроматографической диагностики особо опасных и резистентных инфекций на основе протеомных технологий. Она предусматривает использование в качестве флуоресцентных меток биомаркеров коллоидных квантовых точек и выдвигает требования к автоматизированной диагностической технике. Для испытаний и комплексной поверки создаваемой роботизированной техники предложена референс-тест-система на основе модельного апатогенного для человека вируса болезни Ауески и его антител. Реализация концепции требует разработки тест-систем на конкретные особо опасные и резистентные инфекции. Для снижения затрат на разработку и производство необходимого широкого набора высокоспецифичных биологических компонентов тест-систем предложено использовать высокоэффективные технологии фаговых дисплеев и мишень-специфичных аптамеров, позволяющих получать комбинаторные библиотеки пептидов и белков высокой специфичности без стадии иммунизации животных.
ABSTRACT
As part of the Federal Medical-Biological Agency of Russia concept of control and prevention of biological threats on proteomic technology base it developed the concept of the two-level analytical platform immunoassay diagnosis of dangerous and drug-resistant infections. It involves the use of fluorescent colloidal quantum dots as labels biomarkers and makes the requirements for automated diagnostic equipment. Reference-test-system based on the non-pathogenic human virus of Aujeszky's disease and its antibody has been proposed for testing and verification of developed robotics. The implementation of the concept requires the development of test systems for specific highly dangerous and persistent infections. To reduce the cost of developing and manufacturing a wide range of highly specific biological components required for the test systems, it is proposed to use phage display technology and aptamers targeted to provide highly specific combinatorial libraries of peptides and proteins without the step of immunization of animals.
Ключевые слова: аналитическая платформа диагностики инфекций; протеомные технологии; иммунохроматографический анализ; моноклональные антитела; коллоидные квантовые точки; конъюгаты с антителами; технологии фаговых дисплеев; аптамер; тест-система; роботизированная техника.
Keywords: analytic platform of infection diagnosis; proteomic technology; immunoassay analysis; monoclonal antibodies; colloidal quantum dots; conjugates with antibodies; phage display technology; aptamer; test systems; robotic machinery.
ВВЕДЕНИЕ.
Ранняя диагностика инфекционных опасных и резистентных заболеваний является приоритетным направлением здравоохранения. Совершенствование молекулярной диагностики опасных инфекционных заболеваний предусматривалось Федеральной целевой программой (ФЦП) «Национальная система химической и биологической безопасности Российской Федерации (2009–2013)» и сохраняет свою актуальность в настоящее время [14]. Эта ФЦП определяет перечень инфекционных заболеваний человека. Итоги выполнения программы приведены в [1]. Аналогичные проблемы стоят и перед ветеринарными службами России. Роль и место Федерального центра охраны здоровья животных (ФГБУ «ВНИИЗЖ») в разработке и создании перспективных средств диагностики и специфической профилактики в Российской Федерации рассмотрены в [10], где приводится перечень инфекционных заболеваний сельскохозяйственных и диких животных, а также методы их диагностики. Важность развития современных биосенсорных технологий в диагностике инфекционных болезней отражена в [2].
Целью исследования являлась разработка концепции аналитической платформы иммунохроматографической диагностики особо опасных и резистентных инфекций, основанной на использовании современных протеомных технологий. Данная концепция представляет собой возможный вариант развития первых двух уровней структуры контроля и предупреждения биологических угроз, предусмотренной концепцией Федерального медико-биологического агентства (ФМБА) России [4; 8] (рис. 1):
- На высшем уровне стоит экспертный головной координационный центр, которому подчиняются базовые (региональные) центры (лаборатории). На основе базовых центров должны быть созданы мобильные лаборатории биологической безопасности.
- Общим принципом оснащения лабораторий всех уровней является стандартизация оборудования, реагентов и материалов, стандартных протоколов исследования.
- При выявлении доминирующего возбудителя базовые лаборатории должны координировать сбор материала и проведение первичных исследований мобильными лабораториями.
- Выдвигается требование соблюдения единой политики информационной безопасности, в частности:
- - вся информация о результатах исследований должна храниться в защищенной базе данных;
- - на отдельных лабораторных анализаторах информация о результатах исследований не должна сохраняться.
- Создание полномасштабной трехуровневой системы с учетом территории России требует больших затрат и длительного времени. Поэтому предлагается начать с реализации двухуровневой системы.
Поскольку разрабатываемая система диагностики, прежде всего, предназначена для использования на территории Российской Федерации, важно чтобы она вписывалась в концепцию развития медико-биологических и ветеринарных служб Российской Федерации. В этом отношении целесообразно учитывать положения концепции деятельности мобильных лабораторий биологической безопасности ФМБА России [4], предусматривающую оснащение лабораторий всех уровней стандартизованным лабораторным оборудованием, реагентами, и расходными материалами и использование стандартных протоколов исследования.

Рисунок 1. Трехуровневая структура биологического контроля
Очевидно, что проблема разработки прецизионных методов ранней диагностики особо опасных и резистентных инфекций может быть решена на основе протеомных технологий, и новые эффективные аналитические платформы иммунодиагностики могут быть созданы на базе иммунохроматографического анализа (ИХА). Систематическое рассмотрение проблем ИХА и базирующиеся на ней аналитические платформы рассмотрены в опубликованной в 2009 году книге [59]. Прогноз и идеи развития ИХА, изложенные в этой книге, сохраняют свою актуальность и в настоящее время. Реализация новой аналитической платформы является междисциплинарной задачей и требует решения большого набора научно-технических задач из разных областей науки и техники: разработки биокомпонентов тест-систем, биомаркеров и их конъюгантов, тест-полосок для ИХА, системы пробоподготовки и протокола проведения иммунохроматографического процесса, системы детектирования комплексов антиген-антитело и оптимального уровня автоматизации всех аналитических процессов. Большинство этих задач взаимосвязаны и не могут решаться независимо друг от друга. Все это повышает роль создаваемой концепции аналитической платформы иммунодиагностики, которая должна обеспечивать совместимость и сбалансированность закладываемых в нее идей.
В основе концепции лежит двухуровневая система диагностики инфекций на основе ИХА. Предлагаемая система призвана обеспечить повышение чувствительности и воспроизводимости анализа, автоматизацию аналитических процессов, совершенствование технологии получения и обработки аналитического сигнала и передачу получаемых результатов диагностики в банк данных диагностической информации. Это позволяет создать «бесшовные» медицинские услуги в системе врачи – клиники – лаборатории – больницы.
Общими требованиями к разрабатываемой системе являются:
- Соответствие концепции ФМБА России контроля и предупреждения биологических угроз на территории Российской Федерации;
- Обеспечение политики информационной безопасности, исключение субъективных факторов и фальсификации (определение наличия патогенов только в считывающем устройстве с использованием в качестве маркеров КТ и передача результатов в Центр, принимающий решения);
- Исключение взаимной контаминации образцов.
Создание и развитие новых аналитических платформ в протеомике в значительной мере определяет прогресс и создание новых медицинских технологий и методов клинического анализа. Одним из направлений протеомных технологий является молекулярная диагностика белковых компонентов, возникающих при патологических процессах в организмах человека и животных, которые могут служить биомаркерами патогенных биологических процессов. Одним из направлений в диагностике инфекций является выявление прогностических маркеров, в том числе ранних белков на начальной стадии развития болезни [28; 3; 48]. Более 3000 белков представлено в протеоме человека. Специфические белки и продукты их гидролиза, могут использоваться в качестве маркеров заболеваний. Сравнение протеомов здоровых и больных людей и животных позволяет выявить конкретные белки, вовлеченные в развитие болезни [9]. Возможности и ограничения различных аналитических платформ для профилирования белков по их активности (Activity-based protein profiling – ABPP) обсуждаются в [53; 57; 31]. Хотя платформы ABPP направлены только на определение ферментов и белков, взаимодействующих с низкомолекулярными группировками, разработанная при этом методология может быть полезна при создании платформ, основанных на селективном взаимодействии белков. Ранняя диагностика особо опасных инфекций может строиться на обнаружении вирусов и других антигенов с использованием их антител (или на обнаружении антител, специфичных к патогенам, в сыворотке инфицированных людей или животных), получаемых различными методами. Высокоспецифическое взаимодействие антител с соответствующими им антигенами могут служить доказательством наличия в пробе конкретных антигенов. Антитела, специфичные к патогенам, определяются с помощью различных иммунохимических методов. В последние годы широкое применение нашли новые методы инструментального контроля, позволяющие измерять пикомольные (10-12) и аттомольные (10-18) количества исследуемого аналита [60; 39; 24].
Среди методов выявления возбудителей инфекционных заболеваний наиболее важное место занимают иммунохимические методы детектирования антигенов возбудителей. Одним из важнейших направлений развития иммунохимических методов диагностики инфекционных заболеваний является разработка экспресс-методов ИХА. Новые эффективные аналитические платформы иммунодиагностики могут быть созданы именно на основе развития ИХА. Систематическое рассмотрение проблем ИХА и базирующиеся на ней аналитические платформы рассмотрены в книге [4]. Примером успешного применения ИХА для определения антител может служить работа [44]. Для формирования новой концепции аналитической платформы двухуровневой иммунохроматографической диагностики особо опасных и резистентных инфекций необходимо рассмотреть состояние технологий ИХА и возможные пути их развития.
СОСТОЯНИЕ ТЕХНОЛОГИЙ ИММУНОХРОМАТОГРАФИЧЕСКОГО АНАЛИЗА И ПУТИ ИХ РАЗВИТИЯ.
Основой ИХА являются тест-полоски (стрипы) для определение конкретных анализируемых белков или агентов. Схема типичной тест-полоски для ИХА приведена на рис. 2.

Рисунок 2. Схема иммунохроматографической тест-полоски: а – вид сбоку; б – вид сверху
Фильтр для нанесения образцов делают из целлюлозы, стеклянной фильтровальной бумаги или других несорбирующих материалов. Фильтр детектирующего конъюгата также изготавливается из несорбирующих материалов. Иногда фильтры для нанесения образцов отсутствуют, и образец сразу наносится на фильтр конъюгата. Детектирующий конъюгат высушивается на подушке конъюгата и сохраняется на этом месте до тех пор, пока жидкий образец не попадает на подушку для нанесения образца. Жидкость из образца под действием капиллярных сил движется к подушке конъюгата, переводит конъюгат в раствор и обеспечивает смешивание образца с детектирующим конъюгатом. При этом аналит образует с коньюгатом комплекс, и все растворенные компоненты движутся по нитроцеллюлозной мембране тестовой зоны. В ИХА используются различные типы детектирующих конъюгатов, позволяющих визуально или инструментально обнаруживать реакции с иммунохимическими агентами на тестовой и контрольной линиях стрипа (тест-полоски). Наличие реакции на обеих линиях свидетельствует о наличии аналита.
Аналитический процесс в ИХА включает несколько этапов: пробоотбор, пробоподготовка, реакционный хроматографический процесс, измерение, численная обработка аналитического сигнала и оценка результатов. При этом методика пробоотбора особо важна для предотвращения кросс-контаминации и репрезентативной выборки неоднородных объектов. Кросс-контаминация может приводить к ложно положительным результатам диагностики. Таким образом, разработка методов пробоотбора, пробоподготовки, маркировки компонентов аналитической системы, а также методов детектирования взаимосвязаны и требуют комплексного рассмотрения.
При проведении одиночных анализов в неавтоматизированном анализе в режиме POCT (point of care test – тест по месту оказания медицинской помощи) преимущественно используются стрипы с нанесенными на них коньюгатами. Использование при этом стрипов без коньюгатов и введение их в анализируемые образцы до нанесения на стрип (аналитическая платформа быстрого аналитического измерения биомедицинского отклика RAMP – Rapid Analyte Measurement Platform) [34; 20] существенно усложняет POCT анализ и чаще всего в этом случае неприемлемо. Тем не менее, аналитическая платформа RAMP в ряде случаев обеспечивает существенное повышение отношения аналитический сигнал/шум и в автоматизированном варианте не приводит к удорожанию анализа. Поэтому в автоматизированном анализе может использоваться RAMP-процесс.
Обладая высокой чувствительностью, ИХА в основном является качественным или в лучшем случае полуколичественным методом диагностики [41; 47; 48]. Делаются лишь первые шаги в направлении разработки количественного определения инфекций [13]. Для реализации количественного ИХА необходимо обеспечить снижение относительных стандартных отклонений измерений при низких концентрациях аналита. Другим важным фактором является чувствительность определения аналита. Требования к чувствительности значительно различаются в зависимости от метода и области применения анализа. Повышение чувствительности и воспроизводимости позволит использовать автоматизированные ИХА системы для применения в областях, где ПЦР – диагностика (полимеразная цепная реакция) считается «золотым» стандартом. Другим важным требованием современных технологий клинического анализа является интеграция технологий считывания аналитических данных и системы сбора данных.
В ИХА наиболее часто используют метки белков, включающие коллоидное золото и монодисперсные латексы, маркированные видимым или флуоресцентным красителем. Повышение чувствительности иммунохроматографических методов достигается при использовании высокочувствительных флуоресцентных меток. Особое место среди флуоресцентных маркеров занимают коллоидные квантовые точки (КТ) [16; 30; 36]. Варьируя состав, структуру и размер КТ, можно получить маркеры с различными оптическими характеристиками. КТ, в отличие от органических и большинства других флуорофоров, имеют широкий спектр поглощения при более высоком коэффициенте экстинкции, узкий симметричный пик эмиссии, высокий квантовый выход и высокую фотостабильность. Это обеспечивает высокую яркость и увеличение аналитического сигнала [61; 32]. Для КТ хорошо разработаны методы модификации их поверхности и ковалентной конъюгации с биополимерами [33; 7; 29; 23]. КТ обеспечивают также требование политики информационной безопасности ФМБА по скрытности результата анализа для человеческого глаза и определения патогена только в специальном считывающем устройстве. Часто аналитическое использование флуоресцентных маркеров затрудняется из-за собственной флуоресценции компонентов анализируемых биологических образцов и материалов тест-системы. Для повышения отношения аналитический сигнал маркера / фон важно обеспечить различие их спектральных характеристик. Для получения низкого фонового уровня флуоресценции необходимо, чтобы материал мембраны стрипа минимально флуоресцировал в максимуме флуоресценции маркера. В ИХА исторически в качестве мембраны используют нитроцеллюлозу, которая, к сожалению, обладает собственной флуоресценцией. В связи с этим и другими недостатками нитроцеллюлозы было сделано много безуспешных попыток заменить ее другими материалами. Тем не менее, сегодня нитроцеллюлозные мембраны, обладающие комплексом уникальных свойств, остаются практически единственным материалом, который успешно и широко применяется в ИХА и других иммунологических методах анализа [42; 48]. Нитроцеллюлоза имеет собственную флуоресценцию, особенно в зеленой – желтой части спектра, поэтому желательно использовать метки с флуоресценцией в ближней ИК-области. В качестве таких меток могут выступать КТ [25; 40; 46; 56]. Использование маркеров с флуоресценцией в ближней инфракрасной области (> 650 нм) почти исключает влияние флуоресценции пористой нитроцеллюлозы. Тем самым детекция в ближней ИК области на пористых нитроцеллюлозных пленках повышает чувствительность определения белков, меченных КТ. Учитывая вышесказанное, а также опыт авторов в получении, исследовании и применении КТ [27; 38], в основу разрабатываемой аналитической платформы заложено использование в качестве маркеров конъюгатов антител с КТ с оптимальными для селективного анализа спектральными характеристиками.Использование в качестве флуоресцентных меток КТ, совершенствование технологий получения высокочувствительных и специфических антител и конъюгатов антител с КТ, а также высокочувствительная техника обнаружения комплексов «антиген-антитело», позволяют разработать новую аналитическую платформу и роботизированную технику для двухуровневой иммунохроматографической диагностики инфекций.
Техника первого уровня предназначена для диагностики по месту отбора образцов для анализа (POCT диагностика), а второго уровня – для централизованного анализа образцов. Для испытаний и комплексной поверки создаваемой роботизированной техники разрабатывается образцовая тест-система на основе модельного апатогенного для человека вируса болезни Ауески и его антител.
Для создания диагностических тестов на конкретные инфекции необходимо будет учитывать свойства каждой конкретной системы, в том числе диапазон концентрации аналита, метод отбора проб и методику предобработки образца. Разработка методов пробоотбора, пробоподготовки, маркировки компонентов аналитической системы, а также методов детектирования взаимосвязаны и требуют комплексного рассмотрения. Высокий уровень автоматизации может обеспечить экономическую целесообразность использования нетипичной для POCT аналитической платформы RAMP (Response Biomedical’s Rapid Analyte Measurement Platform), обеспечивающей существенное повышение отношения аналитический сигнал/шум. Было показано, что в разброс результатов измерений большой вклад вносят стадии пропитки подложки конъюгатом, сушка и последующий переход коньюгата в жидкую фазу при анализе [43]. В платформе RAMP коньюгат не включается в тест-полоску, его предварительно смешивают с образцом, а затем наносится на стрип вместе с образцом. При интерпретации результата анализа используется соотношение интенсивности тестовой и контрольной линии («RAMP отношение»).
Автоматизация анализа может также сделать целесообразным использование не обычного фронтального хроматографического процесса, а более сложно реализуемого элюционного иммунохроматографического процесса. При фронтальном процессе иммунохроматографическая тест-полоска помещается непосредственно в исследуемую жидкую пробу (или на тест-полоску наносится анализируемый образец), тем самым начинается фронтальный иммунохроматографический процесс. Такой процесс с точки зрения аналитической хроматографии малоэффективен и затрудняет регистрацию иммунной реакции из-за наличия большого количества примесей. При элюционном процессе аликвота анализируемого образца наносится на стартовую накладку тест-полоски и после впитывания образца наносится элюент (буферный раствор), тем самым начинается элюционный иммунохроматографический процесс, в ходе которого, в конечном счете, все несвязывающиеся на тестовой и контрольной линиях компоненты образца вымываются, и детекция образующихся комплексов идет на более чистом фоне.
ТЕХНОЛОГИИ ПОЛУЧЕНИЯ СПЕЦИФИЧЕСКИХ БИОАГЕНТОВ ДЛЯ ИММУНОХРОМАТОГРАФИЧЕСКОГО АНАЛИЗА.
Для ИХА необходимы идентичные моноклональные антитела (МКА) илииные специфические агенты к определяемым антигенам (АГ). Главной проблемой коммерческого производства широкого набора диагностических тестов являются большие затраты на разработку и производство высокоспецифичных биологических компонентов тестов, в частности МКА. При диагностике патогенных штаммов необходимо использовать МКА, избирательно связывающие только определяемые штаммы. Список белков, используемых для изготовления конъюгатов с маркерами аналитического процесса и моноклональных антител, не может быть ограничен существующими на рынке белками. Этот список должен регулярно пополняться в зависимости от эпидемиологической ситуации в мире, и постоянно требуются новые разработки и внедрение их в производство. Поэтому биотехнологическая составляющая проекта является важнейшей, ограничивающей производство полного спектра тестов.
Развитие различных методов получения моноклональных антител рассмотрено в [11]. До того, как в 1975 году была предложена гибридомная технология получения МКА, единственным источником МКА были опухолевые клетки миеломы и плазмацитомы, выделяемые из тканей больных людей и животных. Такие клетки могли быть адаптированы к росту в культуральных средах и секретировать МКА, однако при этом было трудно определить антиген, к которому они направлены и получать стандартные препараты. Гибридомные технологии позволили получать гибридные клетки (гибридомы) путем слияния антитело-продуцирующих В-лимфоцитов и опухолевых клеток миеломного или плазмацитомного ряда. Такие гибридомы обладают способностью секретировать антитела определенной специфичности и способностью к бесконечному делению.
Для получения желаемых МКА проводят клонирование и нарабатывают необходимое количество МКА в культуре или в перитонеальной полости мышей и других животных. В процессе получения МКА конечный успех в значительной мере определяется эффективностью иммунизации. Обычно при гибридизации сливается одна пара клеток из десятков тысяч. При этом часть гибридом гибнет при дальнейших манипуляциях с ними. Выделяемые МКА подвергаются тщательной очистке с привлечением набора различных методов. Гибридомная технология постоянно совершенствуется и позволяет получать МКА к различным антигенам. В целом получение моноклональных антител включают в себя иммунизацию животных, подготовку миеломных клеток, слияние клеток, клонирование и культивирование гибридомных клеток, синтезирующих МКА, и многочисленные промежуточные стадии очистки [5]. Одной из важных проблем использования МКА, полученных по гибридной технологии является их потенциально сильная иммуногенностью для человека.
При использовании описанных выше методов для получения человеческих МКА в основном получаются нестабильно секретирующие продуценты. Одним из решений проблемы является использование генно-инженерных методов с изготовлением векторов, содержащих гены иммуноглобулинов или их фрагментов, с последующей их вставкой в геном бактерий или других биологических организмов. Для этого из клеток, секретирующих МКА, выделяют гены, кодирующие цепи или фрагменты цепей иммуноглобулинов или соответствующую им матричную РНК. Затем с помощью ПЦР получают необходимое количество копий ДНК (кДНК). Эти кДНК встраивают в плазмиды или кольцевые бактериофаги, которые вводят в бактериальные клетки для размножения векторов и последующего культивирования для наработки иммуноглобулинов или их фрагментов.
Когда доступность иммунных В-лимфоцитов ограничена, целесообразно использовать фаговые библиотеки (фаговые дисплеи). Метод фагового дисплея был предложен в середине 80-х годов и получил широкое применение в научно-исследовательской практике [54]. Фаговый, рибосомный и дрожжевой дисплей относят к методам скрининга одноцепочечных антител (scFv) или Fab-фрагментов антител нужной специфичности из комбинаторных библиотек. Из этих антител можно конструировать полноразмерные иммуноглобулины человека. Выделенные из лимфоидных органов группы неиммунизированных людей В- лимфоциты могут продуцировать антитела с очень широким спектром специфичности и аффинитетом практически к любым возможным антигенным детерминантам. Из В-лимфоцитов выделяют, полиаденилированную мРНК и, используя ПЦР, получают амплифицированную кДНК, кодирующую Fv-фрагменты цепей иммуноглобулинов. Далее на основе кДНК изготавливают векторы и вставляют их в геном однонитчатых фагов. В итоге каждая фаговая частица содержит ДНК, кодирующую Fv-фрагмент определенной специфичности. Затем производится трансфекция этими фагами бактериальных клеток и получают популяцию бактерий, экспрессирующих фрагменты человеческих антител широкой направленности. Такая популяция может служить фаговой библиотекой.
Для экспрессии фрагментов антител на внешней мембране бактериальных клеток, ген Fv-фрагмента соединяют с геном какого-либо поверхностного белка. Бактерии, экспрессирующие фрагменты антител нужной специфичности, выделяют методами аффинной хроматографии на микроколонках с иммобилизованным антигеном. Далее путем клонирования отбирают клетки с наилучшими характеристиками.
Таким образом, основные этапы технологии фагового дисплея включают:
- получение популяции амплифицированных генов иммуноглобулинов;
- клонирование генов иммуноглобулинов в фагмиду, где продуцируется антиген-связывающий фрагмент иммуноглобулина с одним из поверхностных белков нитчатого бактериофага, и получение фагмидной библиотеки;
- трансформирование фагмидной библиотеки в E.coli и получение с использованием фага-помощника библиотеки фаговых частиц, которые экспонируют на поверхности клетки индивидуальную комбинацию V-доменов легких и тяжелых цепей антитела.
При помощи фаговых дисплеев удается получать Fv-фрагменты достаточной для аналитических целей аффинностью. Объем фаговой библиотеки превышает сегодня 1010 единиц. Время получения таких мини-антител не превышает двух недель по сравнению с 3–4 месяцами для гибридомной технологии. Эта технология открывает возможность высокорентабельного производства биологических компонентов тест-полосок для широкого круга инфекций.
Важно, что методы скрининга одноцепочечных антител (scFv) или Fab-фрагментов антител с необходимой специфичностью из комбинаторных библиотек с последующей реконструкцией из них полномерных иммуноглобулинов не требуют предварительной иммунизации. Фаговый дисплей является эффективной технологией, позволяющей получать комбинаторные библиотеки пептидов и белков высокой специфичности [12]. Это позволяет разработать ультра-чувствительные тесты для диагностики различных патогенов. В связи с этим, в разрабатываемой аналитической платформе в дальнейшем предусматривается использование технологии фаговых дисплеев. На сегодняшний день с помощью иммунных библиотек получены различные фрагменты антител человека, аффинные к многим антигенам, в том числе ботулина, столбнячного токсина, ВИЧ, вируса клещевого энцифалита, вирусов гепатитов В и А, вирусов простого герпеса, цитомегаловирусу, вирусам ветряной оспы, вирусам осповакцины [6; 17; 35; 45].
Особые возможности для диагностики патогенов открывает применение аптамеров – одноцепочечных олигонуклеотидов, способных связываться с определенными белками с высокой специфичностью. Мишень-специфичные аптамеры получают с помощью ПЦР в результате синтеза случайных нуклеотидных последовательностей с последующей селекцией тех последовательностей, которые имеют наибольшее сродство к мишени. В качестве молекул-мишеней могут выступать небольшие органические молекулы и биополимеры – пептиды, белки, нуклеиновые кислоты, полисахариды, а также вирусные частицы, целые клетки и ткани [52; 62]. Для получения аптамеров был разработан метод SELEX (Systematic Evolution of Ligands by Exponential Enrichment) [35; 58]. Получение мишень-направленных аптамеров является важным этапом разработки высокочувствительных методов экспресс-диагностики инфекций [51]. Аптамеры имеют ряд существенных преимуществ по сравнению с классической основой современных диагностикумов – антителами. Получение аптамеров не требует длительных этапов выделения антигена, иммунизации и получение гибридомных клонов. Разнообразие синтетических библиотек ДНК-аптамеров очень велико [37]. Аптамеры способны специфично связываться с поверхностью спор возбудителя сибирской язвы Bacillus anthracis [18; 22; 26], кристаллообразующих бактерий B. thuringiensis [19; 50; 55], стафилококка Staphylococcus aureus [15; 21]. Технологии на основе аптамеров используются для ранней диагностики туберкулеза и рекомендованы ВОЗ для широкой практики [49]. Аптамеры значительно дешевле, чем антитела, и позволяют вводить в них различные метки. Коньюгаты КТ с аптамерами сочетают высокую специфичность к патогенам или их антителам и уникальные оптические свойства КТ в качестве маркеров. В диагностикумах аптамеры имеют большие преимущества по сравнению с диагностическими системами на базе антител.
Важно использовать комплексный подход при разработке новой концепции аналитической платформы двухуровневой диагностики инфекций. Просто развитие систем считывания аналитического сигнала (ридер) с высокой чувствительностью и системы маркировки недостаточно. Важно учитывать свойства системы в целом, в том числе свойства образца, метод отбора проб, методику предварительной обработки образца и концентрацию аналита. Важными для анализа является величина сродства антител к антигенам и методы получения и свойства их коньюгатов с метками. Все эти факторы должны учитываться при разработке метода и техники анализа, обеспечивающих высокую чувствительность и высокую воспроизводимость обнаружения.
Подробный анализ современного состояния техники ИХА не входит задачи данной работы. Следует отметить, что в диагностическом комплексе, метки и ридер являются лишь частью комплексной проблемы. Ридер является не более чем инженерной задачей. Технологии регистрации аналитического сигнала строятся на обнаружении белков, меченных флуоресцентной меткой, при возбуждении их светодиодами или лазерами с использованием фотоматриц – приборов с зарядовой связью (ПЗС, CCD) или твердотельных фотоумножителей. Разработка и производство систем количественного ИХА анализа чрезвычайно сложная задача не из-за проблемы детекторов, а ввиду широкого разнообразия объектов анализа и изменчивости требований к самому анализу. Только фирма Biosite Triage and Response Biomedical, использующая нестандартный RAMP процесс ИХА, реализует в настоящее время количественные измерения. Учитывая, что только ридер сам по себе не может обеспечить высокую чувствительность анализа, важно прежде всего проведение биологических и химических исследований, связанных с пробоподготовкой и самим процессом ИХА, чтобы обеспечить эффективное использование ридера.
Портативные системы диагностики должны распечатать все данные по месту взятия пробы и передать их в банк данных диагностической информации для учета и регистрации. Программа центральной информационной системы предлагает способы управления и включает мониторинг в реальном времени как компетентности работника при использовании прибора, так и адекватности результатов анализа. Стоимость, безотказность и отсутствие регулярного технического обслуживания и калибровки ридеров, предназначенных для массовых анализов, являются наиболее критическими факторами. Такие ридеры должны быть простыми, надежными и обеспечивать внутреннюю калибровку прибора или калибровку по линии контроля стрипа.
НОВАЯ КОНЦЕПЦИЯ АНАЛИТИЧЕСКОЙ ПЛАТФОРМЫ ДВУХУРОВНЕВОЙ ИММУНОХРОМАТОГРАФИЧЕСКОЙ ДИАГНОСТИКИ.
Общие тенденции развития методов ИХА прежде всего связаны с использованием новых классов меток, повышающих чувствительность и воспроизводимость анализа, разработкой количественных методов анализа, разработкой мультикомпонентных систем анализа и разработкой на этой основе новых платформ проведения анализа и уменьшения стоимости анализа. Вышеизложенное позволят сформулировать следующие основные положения новой концепции аналитической платформы двухуровневой иммунохроматографической диагностики особо опасных и резистентных инфекций (Аналитическая платформа ИДОРИ).
В основе концепции ИДОРИ лежит основанный на протеомных технологиях метод ИХА. ИДОРИ предусматривает два уровня проведения диагностики. Первый уровень диагностики осуществляется по месту забора пробы (POCT – point of care testing) и имеет ограниченный уровень автоматизации. Второй уровень диагностики реализуется в стационарных лабораторных условиях и предназначен для проведения массового анализа и отличается роботизацией аналитических процессов. В обоих уровнях диагностики максимально используются единые стандартные подходы, протоколы, реагенты и расходные материалы.
Реализация концепции ИДОРИ предполагает выполнение нижеприведенных определений, принципов и параметров.
ИДОРИ – модульная конфигурируемая платформа для определения специфических белков, иммунохимических исследований, инфекционных заболеваний и других биологических объектов. ИДОРИ позволяет консолидировать до 90 % рутинной работы в области биохимии и иммунохимии. Исследования отобранных образцов выполняются одним оператором, и полученные результаты передаются и хранятся в едином банке данных диагностической информации.
В ИДОРИ в качестве флуоресцентных меток будут использоваться коллоидные КТ, флуоресцирующие ближней ИК области спектра. ИДОРИ предусматривает постоянное развитие и разработку на ее основе новых тестов. При этом для получения моноклональных антител и других биокомпонентов предусматривается использовать как классические технологии, так и новые высокоэффективные технологии фаговых дисплеев и мишень-специфичных аптамеров, позволяющие получать комбинаторные библиотеки биоагентов высокой специфичности без стадии иммунизации животных. Предусматривается разработка готовых к использованию реагентов для максимального удобства операторов. Достоверность результатов обеспечивается автоматической детекцией комплексов аналита с тест-специфичными белками. Кроме этого, системы ИДОРИ периодически подвергаются комплексной поверке и калибровке с использованием образцовой референс-тест-системы (например, на основе модельного апатогенного для человека вируса болезни Ауески и его антител).
Первый уровень диагностики (рис. 3) осуществляется на месте отбора образцов для анализа (POCT-диагностика). ИХА представляет хорошо отработанную технологию, которая подходит для диагностики «у постели больного» и использования в полевых условиях. Первый этап диагностики может осуществляться при обследовании отдельного больного или животного, или при массовом обследовании людей или животных в местах их расположения. Для этих различных по производительности обследования случаев целесообразна разработка различной по степени автоматизации техники диагностики. При диагностике отдельных единичных субъектов с экономической точки зрения необходима недорогая ридерная техника, имеющая минимальную автоматизацию пробоотбора и пробоподготовки. При массовом обследовании в режиме POCT целесообразно использование более дорогой техники с повышенной автоматизацией пробоотбора и пробоподготовки.
Основными требованиями к первому уровню диагностики по месту отбора образцов для анализа (POCT-диагностика) (рис. 3) являются:
- портативный автономный носимый (возимый) комплект оборудования мобильной лаборатории биологической безопасности;
- отбор и консервация проб с маркировкой RFID метками и передача их в базовый (региональный) центр;
- диагностика по месту отбора образцов для анализа (POCT диагностика);
- микропроцессорная система управления;
- режим работы полуавтоматический и ручной;
- время анализа 15–20 мин;
- протоколирование и передача результатов анализа с параметрами на внешний компьютер и базовый банк данных;
- электропитание 12 В или 220 В 50 Гц через адаптер, мощность до 100 Вт.
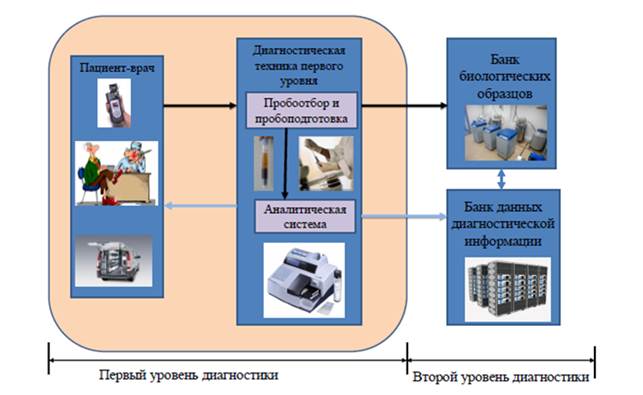
Рисунок 3. Первый уровень диагностики инфекций
Второй уровень диагностики (рис. 4) реализуется в стационарных лабораторных условиях и предназначен для проведения массового анализа. В этом случае целесообразно использование дорогостоящей высокоавтоматизированной техники диагностики.
Основными требованиями к второму уровню массового централизованного анализа образцов является:
- базовый банк данных отобранных образцов и результатов анализа, синхронизированный с банком данных экспертного головного координационного центра (третий высший уровень);
- базовый банк консервированных проб с RFID метками;
- стационарный роботизированный лабораторный комплект оборудования для высокопроизводительного централизованного анализа образцов;
- диагностика с использованием образцов из базового банка проб;
- микропроцессорная система управления;
- режим работы автоматический и полуавтоматический;
- конвейерная система подачи и анализа проб с интервалом 1–2 минуты (время пребывания образца на конвейере 15–20 мин);
- протоколирование и передача результатов анализа с параметрами на внешний компьютер и базовый банк данных;
- электропитание 220 В 50 Гц, мощность до 1 кВт.
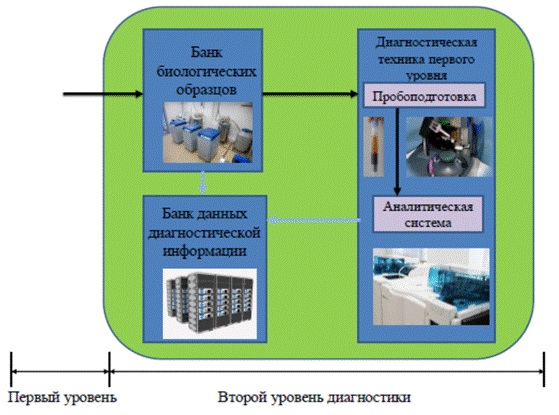
Рисунок 4. Второй уровень диагностики инфекций
ЗАКЛЮЧЕНИЕ.
Разработана концепция новой аналитической платформы двухуровневой иммунохроматографической диагностики инфекций, предусматривающая использование роботизированной техника и позволяющая в комплексе решить проблему ранней диагностики особо опасных и резистентных инфекций. Концепция предусматривает использование в качестве флуоресцентных меток коллоидных квантовых точек и выдвигает требования к автоматизированной диагностической технике. Для снижения затрат на разработку и производство необходимого широкого набора высокоспецифичных биологических компонентов тест-систем предложено использовать высокоэффективные технологии фаговых дисплеев и мишень-специфичных аптамеров, позволяющих получать комбинаторные библиотеки агентов высокой специфичности без стадии иммунизации животных. С цель апробации концептуальных решений и создаваемой роботизированной техники разрабатывается образцовая тест-система в виде тест-полосок на основе использования конъюгатов квантовых точек с моклональными антителами к вирусу болезни Ауески для выявления вирусного антигена и вирус-специфических антител. Предложенная аналитическая платформа обеспечивает беспрецедентные возможности для диагностики большого круга опасных заболеваний человека и животных. Эти возможности достигаются в результате синергии различных подходов и технологий.
Список литературы:
1. Аналитический обзор научно-исследовательских работ, выполненных к 1 января 2015 года в рамках проблем, курируемых научным советом по санитарно-эпидемиологической охране территории Российской Федерации – [Электронный ресурс]. – Режим доступа: http://www.microbe.ru/print/43/ (Дата обращения: 08.01.16).
2. Биосенсорные технологии в диагностике инфекционных болезней / Под редакцией академика РАН, профессора В.В. Кутырева. – Тверь: ООО «Издательство «Триада», 2014. – С. 1–112.
3. Казачинская Е.И., Иванова А.В., Сорокин А.В., Качко А.А., Субботина Е.Л., Разумов И.А., Локтев В.Б. Моноклональные антитела и рекомбинантные белки филовирусов. Иммунохимические свойства и оценка возможности их использования для иммунодиагностики // Медицинская иммунология. – 2010. – Т. 12 – № 3. – С. 177–190.
4. Кутырев В.В. Проблемы и перспективы молекулярной диагностики опасных инфекционных болезней. ФГУЗ Российский научно-исследовательский институт «Микроб», Москва, 24 ноября 2010 г. – [Электронный ресурс]. – Режим доступа: http://md2010.org/files/presents/sp1/sp1-4.pdf (Дата обращения: 08.01.16).
5. Моноклональные антитела – [Электронный ресурс]. – Режим доступа: http://www.ggau.by/moodle/mod/resource/view.php?id=6058 (Дата обращения: 08.01.2016).
6. Николенко Г.Н., Протопопова Е.В., Ильичев А.А., Коновалова С.Н., Карпенко Л.И., Локтев В.Б., Порываева В.А., Тикунова Н.В. Рекомбинантные антитела к вирусу клещевого энцефалита. // Вопр. Вирусологии. – 2002. – № 5. – C. 31–36.
7. Олейников В.А., Суханова А.В., Набиев И.Р. Флуоресцентные полупроводниковые нанокристаллы в биологии и медицине // Российские нанотехнологии. – 2007. – Т. 2, № 1-2. – С. 160–173.
8. О проекте концепции деятельности мобильных лабораторий биологической безопасности ФМБА России – [Электронный ресурс]. – Режим доступа: http://www.gcgie.ru/operative_2014/Webinar2/PR.pdf (Дата обращения: 08.01.16).
9. Протеомика – [Электронный ресурс]. – Режим доступа: https://ru.wikipedia.org/wiki/Протеомика (Дата обращения: 08.01.16).
10. Роль и место Федерального центра охраны здоровья животных (ФГБУ «ВНИИЗЖ») в разработке и создании перспективных средств диагностики и специфической профилактики в Российской Федерации – Киев 2013 – [Электронный ресурс]. – Режим доступа: http://www.fao.org/fileadmin/user_upload/Europe/documents/Events_2013/NUBiP/Country/Russia_ru.pdf (Дата обращения: 08.01.16).
11. Свешников П.Г., Малайцев В.В., Богданова И.М., Солопова О.Н. Введение в молекулярную иммунологию и гибридомную технологию – М.: Из-во МГУ, 2006. – Глава «Традиционные методы получения моноклональных антител» – [Электронный ресурс]. – Режим доступа: http://www.hybridoma.ru/glavi.htm (дата обращения: 08.01.2016).
12. Тикунова Н.В., Морозова В.В. Фаговый дисплей на основе нитчатых бактериофагов: применение для отбора рекомбинантных антител // Actanaturae. – 2009. № 3. – С. 22–31.
13. Третьяков С.И., Башарова Л.А., Ярков С.П., Титов А.А., Храмов Е.Н. Разработка количественных иммунохроматографических тестов для определения маркеров соматических заболеваний // Вестник РАМН. – 2013. № 9. – С. 52–57.
14. ФЦП «Национальная система химической и биологической безопасности Российской Федерации (2009–2013)» – [Электронный ресурс]. – Режим доступа: http://fcp.economy.gov.ru/cgi-bin/cis/fcp.cgi/Fcp/ViewFcp/View/2011/255?yover=2009 (Дата обращения: 08.01.16).
15. Abbaspour A., Norouz-Sarvestani F., Noori A., Soltani N., Aptamer-conjugated silver nanoparticles for electrochemical dual-aptamer-based sandwich detection of staphylococcus aureus // Biosens. Bioelectron. – 2014. – Vol. 18. – P. 149–155.
16. Algar W.R., Tavares A.J., Krull U.J. Beyond labels: A review of the application of quantum dots as integrated components of assays, bioprobes, and biosensors utilizing optical transduction // Analytica Chimica Acta. – 2010. – Vol. 673. – P. 1–25.
17. Bahara N.H.H., Tye G.J., Choong Y.S., Ong E.B.B., Ismail A., Lim T.S. Phage display antibodies for diagnostic applications // Biologicals. – 2013. – Vol. 41, № 4. – P. 209–216.
18. Bruno J.G., Kiel J.L. In vitro selection of DNA aptamers to anthrax spores with electrochemiluminescence detection // Biosens. Bioelectron. – 1999. – Vol. 14. – P. 457–464.
19. Bruno J.G., Ulvick S.J., Uzzell G.L., Tabb J.S., Valdes E.R., Batt C.A. Novel immuno-FRET assay method for Bacillus spores and E. coli O157:H7 // Biochem. Biophys. Res. Comm. – 2001. – Vol. 287. – P. 875–880.
20. Burkhalter K.L., Horiuchi K., Biggerstaff B.J., Savage H.M. and Nasci R.S. Evaluation Of A Rapid Analyte Measurement Platform And Real-Time Reverse-Transcriptase Polymerase Chain Reaction Assay West Nile Virus Detection System In Mosquito Pools // Journal of the American Mosquito Control Association. – 2014. – Vol. 30, № 1. – P. 21–30.
21. Cao X., Li S., Chen L., Ding H., Xu H., Huang Y., Li J., Liu N., Cao W., Zhu Y., Shen B., Shao N. Combining use of a panel of ssDNA aptamers in the detection of Staphylococcus aureus // Nucleic. Acids. Res. – 2009. – Vol. 37, № 14. – P. 4621–4628.
22. Cella L.N., Sanchez P., Zhong W., Myung N.V., Chen W., Mulchandani A. Nano aptasensor for protective antigen toxin of anthrax // Anal. Chem. – 2010. – Vol. 82. – P. 2042–2047.
23. Chan W.C.W., Nie S.M. Quantum dot bioconjugates for ultrasensitive nonisitopic detection // Science. – 1998. Vol. 281. – P. 2016–2018.
24. Chen L. Surface Functionalization and Bioconjugation of Nanoparticles for Biomedical Applications – University of Western Ontario – Electronic Thesis and Dissertation Repository, – 2014. – P. 49–71.
25. Chen O., Zhao J., Chauhan V. P., Cui J., Wong C., Harris D.K., Wei H., Han H.-S., Fukumura D., Jain R.K. & Bawendi M.G. Compact high-quality CdSe–CdS core–shell nanocrystals with narrow emission linewidths and suppressed blinking // Nature Materials. – 2013. – № 12. – P. 445–451.
26. Choi J.S., Kim S.G., Lahousse M., Park H.Y., Park H.C., Jeong B., Kim J., Kim S.K., Yoon M.Y. Screening and characterization of high-affinity ssDNA aptamers against anthrax protective antigen // J. Biomol. Screen. – 2011. – Vol. 16, № 2. – P. 266–271.
27. Dezhurov S.V., Volkova I.Y., Wakstein M.S. FRET-based biosensor for oleic acid in nanomolar range with quantum dots as an energy donor // Bioconjug Chem. – 2011. – Vol. 22, № 3. – P. 338–345.
28. Diamandis E.P. Present and future of cancer biomarkers // Clin. Chem. Lab. Med (CCLM). 2014. Vol. 52, № 6. – P. 791–794.
29. Drbohlavova J., Adam V., Kizek R., Hubalek J. Quantum Dots – Characterization, Preparation and Usage in Biological Systems // Int. J. Mol. Sci. – 2009. Vol. 10, № 2. – P. 656–673.
30. Esteve-Turrillas F.A., Abad-Fuentes A. Applications of quantum dots as probes in immunosensing of small-sized analytes // Biosensors and Bioelectronics. – 2013. – Vol. 41. – P. 12–29.
31. Galmozzi A., Dominguez E., Cravatt B.F., and Saez E. Application of Activity-Based Protein Profiling to Study Enzyme Function in Adipocytes // Methods Enzymol. – 2014. – Vol. 538. – P. 151–169.
32. Gill R., Zayats M., Willner I. Semiconductor Quantum Dots for Bioanalysis // Angew. Chem. Int. Ed. – 2008. Vol. 47. – P. 7602–7625.
33. Hermanson G.T. Bioconjugate techniques – Second edition. – Academic Press, Inc., 2008. – P. 485–497.
34. Hoile R., Yuen M., James G., Gilbert G.L. Evaluation of the Rapid Analyte Measurement Platform (RAMP) for the Detection of Bacillus anthracis at a Crime Scene // Forensic Sci. Int. – 2007. – Vol. 171, № 1. – P. 1–4.
35. Kipriyanov S.M., Little M. Generation of recombinant antibodies // Mol. Biotechnol – 1999. – Vol. 12. – P. 173–201.
36. Kuang H., Zhao Y., Ma W., Xu L., Wang L., Xu C. Recent developments in analytical applications of quantum dots // Trends in Analytical Chemistry. – 2011. Vol. 30, № 10. – P. 1620–1636.
37. Lim Y.C., Kouzani A.Z., Duan W. In Computational Intelligence and Intelligent Systems – 1st ed. Cai Z., Li Z., Kang Z., Liu Y., Eds. – Springer: Berlin, Heidelberg, Germany, 2009. – Vol. 51. – P. 118–127.
38. Loginova Y.F., Kazachkina N.I., Zherdeva V.V., Rusanov A.L., Shirmanova M.V., Zagaynova E.V., Sergeeva E.A., Dezhurov S.V., Wakstein M.S., Savitsky A.P. Biodistribution of intact fluorescent CdSe/CdS/ZnS quantum dots coated by mercaptopropionic acid after intravenous injection into mice // J. Biophotonics. – 2012. – Vol. 5, № 11-12. P. 848–59.
39. Mairhofer J., Roppert K., Ertl. Microfluidic Systems for Pathogen Sensing: A Review // Sensors. – 2009. Vol. 9. – P. 4804–4823.
40. Michalet X., Pinaud F.F., Bentolila L.A., Tsay J.M., Doose S., Li J.J., Sundaresan G., Wu A.M., Gambhir S.S., Weiss S. Quantum Dots for Live Cells, in Vivo Imaging, and Diagnostics // Science. – 28 January 2005. – Vol. 307, № 5709. – P. 538–544.
41. Ngom B., Guo Y., Wang X., Bi D. Development and application of lateral flow test strip technology for detection of infectious agents and chemical contaminants: a review // Anal Bioanal Chem. – 2010. – Vol. 397. – P. 1113–1135.
42. Novel Applications For Nitrocellulose Films – [Электронный ресурс]. – Режим доступа: http://www.gracebio.com/blog/applications-nitrocellulose-films/ (Дата обращения: 08.01.2016).
43. O’Farrell B. Developing approaches to the development and manufacture of highly sensitive, reproducible lateral flow assays // Proceedings of the Oak Ridge National Conference. – 2006. – P. 22–26.
44. Offermann N., Conrad K., Fritzler M.J., Achterrath M.F. Development and validation of a lateral flow assay (LFA) for the determination of IgG-antibodies to Pr3 (cANCA) and MPO (pANCA) // J. Immunol. Methods. – 2014. Vol. 403. – P. 1–6.
45. Pavoni E., Vaccaro P., D’Alessio V., Santis R.D., Minenkova O. Simultaneous display of two large proteins on the head and tail of bacteriophage lambda // BMC Biotechnology – 2013. – Vol. 13. – P. 79–94.
46. Petryayeva E., Algar W.R., Medintz I.L. Quantum dots in bioanalysis: a review of applications across various platforms for fluorescence spectroscopy and imaging // Applied spectroscopy. 2013. Vol. 67, № 3. – P. 215–252.
47. Posthuma-Trumpie G.A., Korf J., Amerongen A. Lateral flow (immuno) assay: its strengths, weaknesses, opportunities and threats. A literature survey // Anal Bioanal Chem. – 2009. – Vol. 393. – P. 569–582.
48. Priest J.W., Moss D.M., Visvesvara G.S., Jones C.C., Li A.. Isaac-Renton J.L. Multiplex assay detection of immunoglobulin G antibodies that recognize Giardia intestinalis and Cryptosporidium parvum antigens // Clin. VaccineImmunol. – 2010. Vol. 17. – P. 1695–1707.
49. Qin L., Zheng R., Ma Z., Feng Y., Liu Z., et al. The selection and application of ssDNA aptamers against MPT64 protein in Mycobacterium tuberculosis // Clin. Chem. Lab. Med. – 2009. – Vol. 47. – Р. 405–411.
50. Sanahuja G., Banakar R., Twyman R.M., Capell T., Christou P. Bacillusthuringiensis: a century of research, development and commercialapplications // Plant. Biotechnol. J. – 2011. – Vol. 9, № 3. – P. 283–300.
51. Santosh B., Yadava P.K. Nucleic Acid Aptamers: Research Tools in Disease Diagnostics and Therapeutics // BioMed Res. Int. – 2014. – V. 2014. – P. 1–13.
52. Shamah S.M., Healy J.M., Cload S.T. Complex target SELEX // Acc. Chem. Res. – 2008. – Vol. 41. – P. 130–138.
53. Sieber S.A. and Cravatt B.F. Analytical platforms for activity-based protein profiling – exploiting the versatility of chemistry for functional proteomics // Chem. Commun. – 2006. – P. 2311–2319.
54. Smith G.P. Filamentous fusion phage: novel expression vectors that display cloned antigens on the virion surface // Science. – 1985. Vol. 228. – P. 1315–1317.
55. Song K.M., Lee S., Ban C. Aptamers and Their Biological Applications // Sensors (Basel). – 2012. – Vol. 12. – P. 612–631.
56. Swanson Ch., D’Andrea A. Lateral Flow Assay with Near-Infrared Dye for Multiplex Detection // Clinical Chemistry. – 2013. – Vol. 59. P. 641–648.
57. The Cravatt Lab – [Электронный ресурс]. – Режим доступа: http://www.scripps.edu/cravatt/research.html (Дата обращения: 08.01.16).
58. Tuerk C., Gold L. Systematic evolution of ligands by exponential enrichment: RNA ligands to bacteriophage T4 DNA polymerase // Science. – 1990. – Vol. 249. – P. 505–510.
59. Wong R.C., Tse H.Y. (eds.) Lateral Flow Immunoassay / Humana Press, New York, NY 2009. – P. 1–34.
60. Yacoub-George E., Hell W., Meixner L., Wenninger R., Bock K., Lindner P., Wolf H., Kloth T., Feller K.A. Automated 10-channel Capillary Chip Immunodetector for Biological Agents Detection // Biosens. Bioelectron. – 2007. Vol. 22. – P. 1368–1375.
61. Yu W.W. Semiconductor quantum dots: synthesis and water-solubilization for biomedical applications // Expert Opin. Biol. Ther. – 2008. Vol. 8. – P. 1571–1581.
62. Zhou J., Rossi J.J. Cell-specific aptamer-mediated targeted drug delivery // Oligonucleotides. – 2011. – Vol. 21. – P. 1–10.
дипломов


Оставить комментарий