Статья опубликована в рамках: II Международной научно-практической конференции «Современная медицина: актуальные вопросы» (Россия, г. Новосибирск, 28 ноября 2011 г.)
Наука: Медицина
Секция: Клиническая лабораторная диагностика
Скачать книгу(-и): Сборник статей конференции, Сборник статей конференции часть II
- Условия публикаций
- Все статьи конференции
дипломов
ИСПОЛЬЗОВАНИЕ СОВРЕМЕННЫХ МЕТОДОВ ДЛЯ ВИДОВОЙ ДИАГНОСТИКИ БИФИДОБАКТЕРИЙ КИШЕЧНОГО БИОТОПА У ДЕТЕЙ С ФУНКЦИОНАЛЬНЫМИ НАРУШЕНИЯМИ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА
Немченко Ульяна Михайловна
м. н. с НЦ ПЗСРЧ СО РАМН,
г. Иркутск
E-mail: lav0467@mail.ru
Джиоев Юрий Павлович
к. б. н., ст. н. с. НЦ ПЗСРЧ СО РАМН,
г. Иркутск
Попкова София Марковна
д. б. н, НЦ ПЗСРЧ СО РАМН,
г. Иркутск
Савелькаева Марина Владимировна
врач высшей категории, клиника НЦ ПЗСРЧ СО РАМН,
г. Иркутск
Введение
Бактерии рода Bifidobacterium являются важным компонентом индигенной микрофлоры кишечника человека и теплокровных животных. В толстой кишке у детей раннего возраста бифидобактерии являются основной группой и составляют до 95% от общей популяции микроорганизмов Они обеспечивают колонизационную резистентность в отношении патогенных и условно-патогенных микроорганизмов, обладают иммуномодулирующим действием, синтезируют аминокислоты, витамины (К, РР и группы В), биотин, летучие жирные кислоты, ферменты, участвующие в процессах пищеварения и обмена веществ [2].
Еще по данным исследований 60-80 гг. было выявлено,что основными представителями бифидофлоры ЖКТ человека являются B.bifidum,B.longum, B.infantis,B.breve,B.adolescentis (Reuter G., 1963), видовое присутствие и долевое участие которых, вместе с тем, меняется в процессе онтогенеза [5,12].
Виды B.bifidum и B.longum выявляются у здоровых людей всех возрастных групп; вид B.adolescentis свойственен только детям старшего возраста и взрослым людям, а у пожилых людей он становится преобладающим. Виды B.infantis и B.breve обнаруживаются только у детей грудного возраста, при этом вид B.infantis относится к преобладающему, а значит, наиболее значимому для организма в этот возрастной период [12]. Нарушения видового и количественного баланса бифидобактерий в ЖКТ приводят к дисбиотическим состояниям, которые при отсутствии лечения и коррекции могут стать источником и причиной заболеваний инфекционной и неинфекционной природы [4,6,11]. В связи с этим, важной представляется проблема изучения особенностей видовой архитектоники бифидобактерий в ЖКТ человека в норме и при дисбиозах [1,8,10]. Активное внедрение молекулярно-генетических технологий в практику микробиологических исследований позволяет получить новую информацию о видовых и штаммовых изменениях, происходящих в составе бифидофлоры у людей по мере взросления [5,7,9,13,16]. В этой связи, очевидна актуальность проведения сравнительного мониторинга нормальной микрофлоры толстого кишечника у детей в динамике развития иммунной системы с привлечением методов молекулярно-генетической идентификации и типирования штаммов бифидобактерий.
Исходя из этого, основная цель работы — с помощью видового генотипирования изучить структуру и сочетаемость видов бифидобактерий в кишечном биоценозе у детей с функциональными нарушениями желудочно-кишечного тракта, проживающих в г. Иркутске.
Материалы и методы исследования
Объектом исследования явилась группа детей с функциональными нарушениями желудочно-кишечного тракта (моторной и секреторной), состоящая из 135 человек, проживающих в г. Иркутске, и проходивших обследование на дисбиоз кишечника в Иркутском Центре диагностики и профилактики дисбактериозов НЦ ПЗСРЧ СО РАМН. Обследованные дети были разделены по критическим периодам развития (Вельтищев Ю.Е.,2000; Леванова Л.А.,2003) на четыре возрастные группы:1 группа — дети от 0 до 6 месяцев;2 группа — от 1 года до 2 лет;3 группа — от 4 до 6 лет;4 группа — 12‑15 лет. Культуральная биомасса бифидобактерий была выращена на стандартной тиогликолевой среде (ФГУН Государственный научный центр прикладной микробиологии и биотехнологии, Оболенск, Россия) согласно Методическим рекомендациям [3]. Материал был собран в течение 2008‑2010 гг.
На этапе подготовки образцов для выделения бактериальной ДНК, согласно лабораторного протокола, была модифицирована методика подготовки и хранения образцов бифидобактерий, которая включала в себя: осаждение бактериальной биомассы из культуральной среды путем центрифугирования (13000 об/мин., 3 мин.), последующее суспендирование осадка клеток бифидобактерий в буфере Трис-ЭДТА (ТЭ), рН 7,4 и хранение при -200 С. В таких условиях бактериальная ДНК сохраняла свои качества в течение года и более. Молекулярно-генетический анализ проводили методом ПЦР с использованием видоспецифичных праймеров на основе гена 16S рРНК, отобранных согласно литературным источникам [14,15]. В таблице 1 приведены структуры используемых праймеров и размеры фрагментов ДНК видов бифидобактерий.
Таблица 1.
Структура и видовое соответствие олигонуклеотидных праймеров, используемых в работах [14,15]
|
№ |
Наименование праймеров |
Последовательности праймеров |
Ген |
ПЦР фраг-мен-ты (н.о.) |
Виды бифидобакте-рий,к кото-рым специфичны праймеры |
|
1 |
BiLON-F BiLON-R |
5-TTCCAGTTGATCGCATGGTC-3 5-GGGAAGCCGTATCTCTACGA-3 |
16SрРНК |
831 |
B. longum |
|
2 |
BiBIF-F BiBIF-R |
5-CCACATGATCGC ATG TGA TTG-3 5-CCG AAG GCT TGCT CCC AAA-3 |
16SрРНК |
278 |
B. bifidum |
|
3 |
BiINF-F BiINF-R |
5- TTC CAG TTG ATC GCA TGG TC -3 5-GGA AAC CCC ATC TCT GGG AT-3 |
16SрРНК |
828 |
В. infantis |
|
4 |
BiCATg-F BiCATg-R |
5-CGG ATG CTC CGA CTC CT-3 5-CGA AGG CTT GCT CCC GAT-3 |
16SрРНК |
285 |
B.catenelatum |
Примечание: F — форвард, прямой праймер; R-реверс, обратный праймер
Суммарную бактериальную ДНК выделяли с использованием комплекта реагентов «РИБО-преп» (ФГУН ЦНИИЭ Роспотребнадзора, Россия). ПЦР- амплификацию проводили с помощью коммерческого набораAmpliSens- 200-1 (ФГУН ЦНИИЭ Роспотребнадзора, Россия). Для одновременного проведения ПЦР амплификации с наборами праймеров к 4 видам бифидобактерий температурные условия отжига праймеров были оптимизированы по одному стандартному режиму амплификации. ПЦР амплификацию проводили по схеме: первичная денатурация ДНК при 950C в течение 3 мин, далее 30 циклов амплификации при 940C в течение 30 сек, при 560C — 30 сек, 720C- 2 мин, а после окончания циклов — при 720C в течение 7 мин. Электрофорез ПЦР фрагментов ДНК бифидобактерий проводили с использованием 1% агарозного геля в трис-ацетатном буфере. Положительным контролем для типирования трех видов бифидобактерий (B.bifidum,B.longum,В.infantis) служил стандартный маркер длин фрагментов ДНК (ZipRuler Express DNA Ladder Set, длина фрагментов от 200 до 20000 н.о.; Fermentas, Литва), а для идентификации вида B.catenulatum использовали маркер O'RangeRuler 100 bp DNA Ladder от 100 до 1500 н.о. (Fermentas, Литва), размерность фрагментов которого начинается с 100, 200, 300, 400, 500 нуклеотидных оснований (рис.1). Отрицательным контролем служила проба, в реакционной смеси которой отсутствовала искомая ДНК бифидобактерий.
Результаты и их обсуждение
Результаты эксперимента, полученные с помощью ПЦР-типирования и визуализированные электрофорезом в агарозном геле, представлены на рисунке 1.

Как видим, используемые видоспецифичные праймеры четко дифференцируют по размерным характеристикам фрагментов амплифицируемых ДНК виды бифидобактерий, в соответствии с протоколами работ авторов, разработавших их структурные конструкции [14, 15].
Результаты исследования видового состава кишечной бифидофлоры у детей различного возраста представлены в таблице 2. Как видно из таблицы, все 4 вида бифидобактерий определялись в исследуемой выборке в различных ассоциативных вариантах.
Таблица 2.
Качественный и количественный состав бифидобактерий у детей с функциональными нарушениями ЖКТ
|
Качествен-ный состав микрофлоры |
0-6 месяцев (N=40) |
1-2 года (N=39) |
4-6 лет (N=41) |
12-15 лет (N=15) |
Итого (N=135) |
|||||
|
Кол-во |
% |
Кол-во |
% |
Кол-во |
% |
Кол-во |
% |
Кол-во |
% |
|
|
B.bifidum |
26 |
65 |
15 |
38,5 |
14 |
34,1 |
8 |
53,3 |
63 |
46,6 |
|
B.longum |
13 |
32,5 |
15 |
38,5 |
24 |
58,5 |
1 |
6,7 |
53 |
39,3 |
|
B.catenulatum |
6 |
15 |
17 |
43,6 |
20 |
48,8 |
5 |
33,3 |
48 |
35,5 |
|
B.infantis |
2 |
5 |
2 |
5,1 |
5 |
12,1 |
1 |
6,7 |
10 |
7,4 |
В результате проведенного исследования было установлено, что бифидобактерии вида B.bifidum с высокой частотой встречались у детей всех возрастных групп, но наибольшей частота встречаемости вида была у грудных детей (65,0%) и у подростков 12‑15 лет (53,3%). В возрасте 1‑2 года и 4‑6 лет имело место снижение частоты встречаемости бифидобактерий этого вида (38,5% и 34,1% соответственно). Бифидобактерии вида B.longumс достаточно высокой частотой обнаруживались у детей с рождения до 6 лет и снижались к подростковому возрасту. Наоборот, частота встречаемости бифидобактерий вида B.catenulatum имела тенденцию к росту с увеличением возраста. Так, у грудных детей данный вид бифидобактерий обнаруживался у 15% обследованных. В дальнейшем у детей в возрасте от 1 до 2 лет и у детей 4‑6 лет бактерии этого вида были обнаружены с частотой 43,6% и 48,8% соответственно. У детей 12‑15 лет частота обнаружений B.catenulatum составила 33,3%.
Настораживает низкий процент обнаружения бифидобактерий вида B.infantis у детей раннего возраста (5% в группе 0‑6 месяцев; 5,1% у детей 1‑2 года), и выявление вида B.infantis у детей старшего возраста (12,1% в группе 4‑6 лет; 6,7 % у подростков 12‑15 лет). Данное обстоятельство может свидетельствовать как о нарушениях формирования нормоценозов у детей с функциональными нарушениями ЖКТ, так и являться региональной особенностью микробной экологии детей, проживающих в экологически неблагоприятных условиях Восточной Сибири (рис.2).
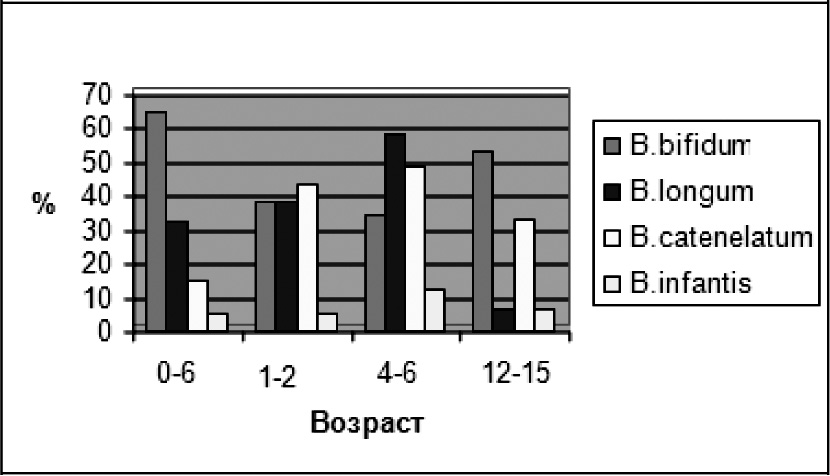
Рисунок 2. Видовой состав бифидобактерий у детей по критическим периодам развития за 2008-2010 год
Анализ общей выборки показал, что видовой пейзаж определяемых в выборке бифидобактерий отличался по соотношению видов в разные годы. Так, в 2008 году доминирующим видом являлся B.longum (у 45,6 % исследованных образцов),а виды B.bifidum и B.catenelatum определялись как субдоминантные виды (в 40,4% и 35% соответственно). В 2009‑2010 гг. доминирующим видом явился B.bifidum (51,3%),на втором месте определялся B.catenelatum (у 35,9 %), незначительно превалируя над B.longum (у 34,6 %) обследованных детей (рис.3).
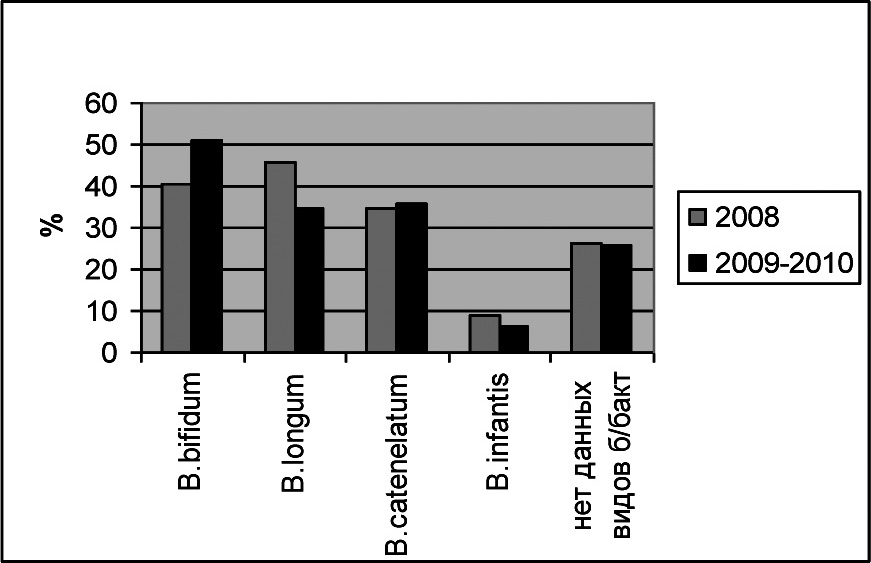
Рисунок 3.Частота встречаемости видов бифидобактерий в разные годы
Реже определялся вид B. infantis (8,8% в 2008 г. и 6,4% в 2009-2010 гг.) что, как было уже выше отмечено, может быть региональной особенностью персистенции данного вида.
Выводы
1. Молекулярно-генетические методы, основанные на амплификационной технологии (ПЦР), позволяют эффективно решать задачи по типированию бифидобактерий с целью установления уровня их внутривидовых вариаций в микрофлоре кишечника у детей.
2. Для детей всех возрастных групп характерна высокая частота выделения бифидобактерий видов B.bifidum и B.longum. Частота встречаемости бифидобактерий вида B.catenulatum имела тенденцию к росту с увеличением возраста.
3. Низкий процент обнаружения бифидобактерий вида B.infantis у детей раннего возраста (5% в группе 0‑6 месяцев;5,1% у детей 1‑2 года), может свидетельствовать о нарушениях формирования нормоценозов у детей с функциональными нарушениями ЖКТ.
Список литературы
1. Видовая архитектоника и плазмидный профиль бифидобактерий кишечной микробиоты у населения Иркутской области / Ракова Е.Б., Попкова С.М., Джиоев Ю.П. [и др.] // Вестник Российской военно–медицинской Академии. — 2008. – №2(22).Ч.П. — С.660‑661.
2. Защитная роль бифидофлоры в организме новорожденных. /Гончарова Г.И., Чистякова В.И., Лянная А.М. [и др.] // Сб. МНИИЭМ. М., — 1990. — C. 48‑53.
3. Методические рекомендации по микробиологической диагностике дисбактериоз кишечника в лечебно-диагностических учреждениях армии и флота // СПб.: СПНИИ эпидемиологии и микробиологии имени Пастера, 1999. — 36 с.
4. Новик Г.И., Астапович Н.И., Самарцев А.А. Исследование биохимических особенностей бифидобактерий на поздних стадиях развития популяций // Микробиология, 2001. — Т.70, №4. — С. 495‑502.
5. Определение видовой принадлежности штаммов бифидобактерий на основе секвенирования фрагментов генов 16S pРНК и трансальдолазы// Карзанова М.В., Воронина О.Л., Лунин В.Г., [и др.] //Сборник докладов Россельхозакадемии. —М. — 2006. — № 5. — С.9‑12.
6. Особенности микроэкологических ценотипов у детей, проживающих в условиях техногенного прессинга / Ракова Е.Б., Попкова С.М., Немченко У.М. [и др.] // Гиг.и санит. — 2011. — №4. — С.22‑26.
7. ПЦР в реальном времени // 2007. URL: http://www.ld.ru/catalog/rts/pcr/realtime-pcr.html (дата обращения: 25.04.2011).
8. Ракова Е.Б. Современная структура кишечного микробиоценоза у детского населения Иркутской области // Автореферат диссертации канд. биол. наук — 2010, — 22 с.
9. Семенинский И.Ж. Молекулярные основы, принципы, алгоритм и возможности ПЦР — диагностики // Методическое пособие. — Иркутск. — 1999. — 23с.
10. Сидоренко А.В. Использование методов геносистематики в классификации и идентификации бактерий рода Bifidobacterium // Микробиология. — 2008. — Т. 77, №3. — С. 293‑302.
11. Хавкин А.И. Эволюция представлений о роли кишечной микрофлоры // 2005. URL: http://www.disbak.ru. (дата обращения: 06.04.2011).
12. Характеристика и использование бифидобактерий, выделенных от взрослых и детей. / Гончарова Г.И., Лянная А.М., Бевз Н.И [и др.] // Сб. МНИИЭМ. М., — 1990. — C. 48‑53.
13. Шульпекова Ю.О. О роли бифидобактерий // 2003. URL: http://www.kcn.ru/tat_ru/tet (дата обращения: 15.04.2011).
14. Arunachalam K.D. Role of bifidobacteria in nutrition, medicine and technology // Nutrit. Res. —1999. — V. 19. №10. P. — 1559‑1597.
15. Gueimonde M, Tolkko S, Korpimaki T. New Real-Time Quantitative PCR Procedure for Quantification of Bifidobacteria in Human Fecal Samples // Appl Environ Microbiol. — 2004. —V.70 (7). — P. 4165‑4169.
16. O'Sullivan Daniel J. Methods for Analysis of the Intestinal Microflora // Curr. Issues Intest. Microbiol. — 2000. — № 1(2). — Р. 39‑50.
дипломов


Оставить комментарий