Статья опубликована в рамках: XXVIII Международной научно-практической конференции «Инновации в науке» (Россия, г. Новосибирск, 27 декабря 2013 г.)
Наука: Химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
ИССЛЕДОВАНИЕ АНТИОКСИДАНТНОЙ АКТИВНОСТИ ОСАЛМИДА И ПАРАЦЕТАМОЛА КИНЕТИЧЕСКИМИ МЕТОДАМИ
Перевозкина Маргарита Геннадьевна
канд. хим. наук, старший преподаватель Государственного аграрного университета Северного Зауралья, РФ, г. Тюмень
STUDY OF OSALMIDE AND PARACETAMOL ANTIOXIDANT ACTIVITY BY KINETIC METHODS
Margarita Perevozkina
candidate of chemical sciences, Head teacher of State Agrarian University of Northern Transurals, Russia Tyumen
АННОТАЦИЯ
Изучены особенности антиоксидантного действия осалмида и парацетамола в процессе инициированного свободными радикалами и каталитического окисления липидных субстратов. Показано, что соединения в процессе окисления действуют по двум механизмам: реагируют с пероксильными радикалами с константой скорости реакции k7=6,86´104 (М×с)-1 (осалмид) и k7=4,00´104 (М×с)-1 (парацетамол), а также разрушают гидропероксиды (70—75 %) с образованием молекулярных продуктов. Установлена высокая антиоксидантная активность парацетамола в безводной инициируемой среде и низкая в водно-липидной катализируемой среде.
ABSTRACT
Peculiarities of osalmide and paracetamol antioxidant effect in the process of initiated by free radicals and catalytic oxydation of lipid substrates have been studied. It has been found that compounds in oxidation process act by two mechanisms: react with peroxy radicals with constant rate of reaction k7=6, 86´104 (М×с)-1 (osalmide) and k7=4, 00´104 (М×с)-1 (paracetamol), and also beat hydroperoxides (70—75 %) with molecular species formation. High antioxidant activity of paracetamol in anhydrous induced medium and low antioxidant activity in water-lipid catalyzed medium have been established.
Ключевые слова: антиоксиданты; a-токоферол; дибунол; осалмид; парацетамол; пероксидное окисление; антиоксидантная активность.
Keywords: antioxidants; a-tocopherol; dibunol; osalmide; paracetamol; peroxide oxydation; antioxidant activity.
Настоящая работа является продолжением наших исследований [5, 6, 8—12], посвященных тестированию антиоксидантных свойств органических соединений различной структуры (фенолов, аминов, серосодержащих соединений) кинетическими методами.
В последние годы в связи с универсальным механизмом регулирования проницаемости биомембран используют антиоксидантотерапию при лечении и профилактике различных патологий [3, 4, 13], при этом подбор антиоксидантов ведется, как правило, на основе данных об антиоксидантной активности соединений в безводном инициируемом свободными радикалами субстрате. Известно, что процессы окисления протекают в живой клетке в липидном бислое в водно-ионном окружении. Очевидно, что эффективность ингибиторов в биомембранах может существенно отличатся от данных в химическом эксперименте. Прогресс в области антиоксидантотерапии возможен только на основе предварительного отбора антиоксидантов (АО) с помощью моделей, приближенных к условиям биологической среды. Разработке такой кинетической модели были посвящены наши предыдущие работы [6, 12]. В результате были подобраны оптимальные условия тестирования АО в каталитическом окислении эфиров высших ненасыщенных жирных кислот в водно-липидной среде. Установлено, что каталитическое окисление липидов в мицеллах протекает в 1000 раз быстрее, чем при инициированном окислении в безводной среде. Показано, что зависимости антиоксидантных свойств органических соединений от структуры, установленные в условиях инициированного окисления углеводородов, существенно меняются в условиях каталитического окисления липидных субстратов.
Цель настоящей работы — тестирование антиоксидантной активности осалмида и парацетамола в процессе инициированного и каталитического окисления липидных субстратов в сравнении со стандартными антиоксидантами дибунолом и a-токоферолом.
МАТЕРИАЛЫ И МЕТОДЫ
Антирадикальную активность (АРА) соединений тестировали в системе инициированного окисления этилбензола хемилюминесцентным методом (ХЛ) [14]. Окисление инициировалось азо-бис-изо-бутиронитрилом (АИБН) при t=(60±0,2)0С. Скорость зарождения свободных радикалов определялась экспериментально с помощь реперного ингибитора – хромана С и составила 2,3´10-8 М´с-1. Для усиления свечения использовался люминофор 9,10- дибромантрацен в концентрации 5´10-4 М, не оказывающий влияния на кинетику окисления. Концентрация ингибитора составляла (1-5)´10-4 М. Стехиометрический коэффициент ингибирования f, показывающий число радикалов, гибнущих на одной молекуле антиоксиданта, оценивали по значению тангенса угла наклона зависимости периодов индукции от концентрации введенного ингибитора, либо по формуле:
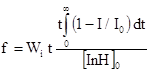 .
.
Антиоксидантную активность (АОА) изучали волюмометрическим методом в присутствии инертного растворителя хлорбензола в манометрических установках типа Варбурга при окислении модельного субстрата — метилолеата (МО) [7]. Процесс инициировали за счет термического разложения при t=(60±0,2)0С АИБН в концентрации 3×10-3 М, скорость инициирования в условиях эксперимента составляла 4,2×10-8 М×с-1. Кинетику каталитического окисление изучали волюмометрическим методом в модифицированной установке типа Варбурга при окислении этилолеата (ЭО), в присутствии триметилцетиламмоний бромида (ЦТМАБ) в качестве поверхностно-активного вещества (ПАВ) при концентрации 1 × 10-3 М в пробе, с добавками растворов хлорида меди (II) в конечной концентрации 2×10-3 М при t=(60±0,2)0С [12]. Соотношение липидов и воды составляло 1: 3, а общий объем пробы 4 мл. Графическим методом определяли величину периода индукции (ti), представляющей собой отрезок оси абсцисс, отсекаемый перпендикуляром, опущенным из точки пересечения касательных, проведенных к кинетической кривой. Эффективность торможения процесса окисления липидного субстрата определяли совокупностью реакций ингибитора и обозначали как антиоксидантную активность, количественно рассчитанную по формуле АОА= ti-tS /tS, где tS и ti — периоды индукции окисления субстрата в отсутствие и в присутствии исследуемого АО соответственно, сравнивали с действием ингибитора, принятого за стандарт, используя отношение ti / tреп, где tреп. — период индукции реперного (стандартного) ингибитора. Из наклона кинетических кривых (КК) определяли начальную (Wнач.) и максимальную (Wмах.) скорости окисления липидного субстрата с добавками АО. Скорость инициирования определяли уравнением Wi = f [InH] / ti, где f — стехиометрический коэффициент ингибирования, [InH] — концентрация ингибитора, ti — период индукции. В качестве стандартных ингибиторов использовали a-токоферол и дибунол, при этом концентрации АО были сравнимыми. Кинетику накопления гидропероксидов изучали методом обратной йодометрии при аутоокислении линолевой кислоты (ЛК) при t=(60±0,2)0С в среде хлорбензола.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
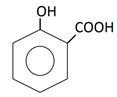
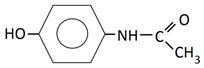
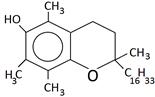
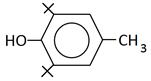
В медицине парацетамол используется как противовоспалительное, жаропонижающее и обезболивающее средство. Известно, что парацетамол ингибирует фермент циклооксигеназу и тормозит образование простагландинов, участвующих в механизме возникновения гиперальгезии и повышенной температуры. Салициловую кислоту используют как антисептическое средство. Осалмид, производный салициловой кислоты и пара-аминофенола, применяется как желчегонное средство. Формулы изучаемых соединений представлены в таблице 1.
Таблица 1.
Химические формулы изучаемых антиоксидантов
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Методом хемилюминесценции в группе исследуемых соединений была оценена величина константы скорости реакции k7 фенолов с пероксильными радикалами [7]: RO2·+InH ![]() ROOH + In·, где InH — ингибитор окисления, In• — радикал ингибитора, RO2• — пероксильный радикал. Стехиометрический фактор ингибирования f, показывающий количество свободных радикалов, реагирующих с молекулой ингибитора, для большинства изучаемых соединений был близок 2—2,5 (табл. 2). При исследовании кинетики изменения интенсивности ХЛ в присутствии исследуемых соединений было установлено, что все АО оказывают ингибирующее действие на процесс окисления модельного субстрата. Показано, что наибольшую активность в реакции с пероксильными радикалами проявлял осалмид, константа скорости реакции k7 которого обусловлена акцепторным характером заместителя в пара-положении, наличием p-р-сопряжения между амино-группой и фенолом. АРА осалмида складывается из активности двух гидроксильных групп, в парацетамоле донорный заместитель содержится в пара-положении. Фенол и салициловая кислота в реакции с пероксильными радикалами проявляли низкую активность, значения k7 для указанных соединений были сопоставимы между собой (табл. 2). Сравнение констант скорости реакции k7 исследуемых соединений и a-токоферола показывает, что основной природный АО более активен в реакции с пероксильными радикалами в 360 раз.
ROOH + In·, где InH — ингибитор окисления, In• — радикал ингибитора, RO2• — пероксильный радикал. Стехиометрический фактор ингибирования f, показывающий количество свободных радикалов, реагирующих с молекулой ингибитора, для большинства изучаемых соединений был близок 2—2,5 (табл. 2). При исследовании кинетики изменения интенсивности ХЛ в присутствии исследуемых соединений было установлено, что все АО оказывают ингибирующее действие на процесс окисления модельного субстрата. Показано, что наибольшую активность в реакции с пероксильными радикалами проявлял осалмид, константа скорости реакции k7 которого обусловлена акцепторным характером заместителя в пара-положении, наличием p-р-сопряжения между амино-группой и фенолом. АРА осалмида складывается из активности двух гидроксильных групп, в парацетамоле донорный заместитель содержится в пара-положении. Фенол и салициловая кислота в реакции с пероксильными радикалами проявляли низкую активность, значения k7 для указанных соединений были сопоставимы между собой (табл. 2). Сравнение констант скорости реакции k7 исследуемых соединений и a-токоферола показывает, что основной природный АО более активен в реакции с пероксильными радикалами в 360 раз.
Таблица 2.
Значения константы скорости реакции АО с пероксильными радикалами RO2● ; Wi=2,3×10-8 М×с-1; САО= 1´10-3 М; t=600
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Для сравнительного анализа антиоксидантного действия исследуемых и реперных ингибиторов были определены периоды индукции, начальные и максимальные скорости окисления. Процесс инициировали посредством термического радикального распада АИБН по реакции:
![]()

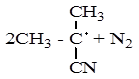
Радикал инициатора (Ri·) конкурентно взаимодействовал с липидным субстратом по реакции:
Ri· + RH ®RiH + R·
Далее радикалы липидного субстрата (R·) взаимодействовали с кислородом по реакциям:
R· + O2 ® RO2·
RO2· + RH ® ROOH + R·
ROOH ® RO· + OH·
В присутствии ингибиторов возможны следующие реакции:
RO2· + InH ![]() ROOH + In·
ROOH + In·
In· + RH ![]() R· + InH
R· + InH
RO2· + In·![]() молекулярные продукты
молекулярные продукты
ROOH + InH ![]() молекулярные продукты
молекулярные продукты
Ингибирующее действие указанных соединений тестировали в широком диапазоне концентраций (5,0´10-5 —2´10-3 М) в условиях инициированного окисления в среде хлорбензола. На рис. 1 приведены кинетические кривые окисления МО в присутствии равных концентраций различных АО. Показано, что исследуемые АО увеличивали периоды индукции окисления модельного субстрата МО. Видно, что наклон кинетических кривых по сравнению с контролем практически не изменялся для одних АО (фенол, салициловая кислота, дибунол, a-токоферол) и существенно снижался для осалмида и парацетамола. Для осалмида, парацетамола и дибунола наблюдалась линейная зависимость между периодом индукции и концентрацией. Для фенола и салициловой кислоты концентрационные зависимости имели экстремальный характер. С увеличением их количества эффективность АО постепенно снижалась. Из рис. 2 можно видеть, что при концентрациях свыше 1´10-3 М

Рисунок 1. Кинетические кривые поглощения метилолеата в среде хлорбензола в присутствии АО: 1 — контроль, 2 — фенол, 3 — салициловая кислота, 4 — a-токоферол, 5 — дибунол, 6 — осалмид, 7 — парацетамол. С АО = const = 2´10-4 М, Wi= 4,2´10-8 М-1´c-1, t = 600С.
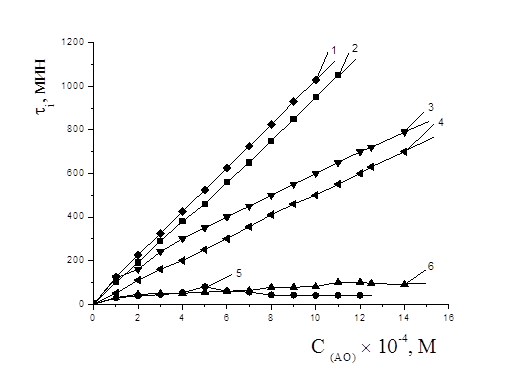
Рисунок 2. Зависимость периодов индукции от концентрации АО: 1 — парацетамол, 2 — дибунол, 3 — a-токоферол, 4 — осалмид, 5 — фенол, 6 — салициловая кислота. Wi= 4,2´10-8 М-1´c-1, субстрат окисления – метилолеат, среда — хлорбензол, t=60 0С
фенол и салициловая кислота как ингибиторы окисления малоэффективны. Следует отметить, что низкая ингибирующая активность салициловой кислоты связана также со слабыми взаимодействиями (внутримолекулярной водородной связью) между ОН-группой фенола и карбонилом –С=О кислоты, что мешает ОН-группе участвовать в реакции с пероксильными радикалами. Действие a-токоферола в изучаемом диапазоне концентраций описывалась линейной зависимостью (рис. 2).
Таблица 3.
Кинетические параметры инициированного окисления метилолеата в присутствии различных концентраций исследуемых антиоксидантов Wi= 4,2´10-8 М-1´c-1, t=60 0С
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
Кинетику окисления изучаемых соединений в условиях каталитического мицеллярного окисления этилолеата изучали в широком диапазоне концентраций (1,0´10-6 – 1´10-1 М).
В присутствии катализатора известны следующие реакции зарождения цепей [2]:
RH + Cu2+ ![]() R● + Cu1+ + H+
R● + Cu1+ + H+
ROOH + Cu1+ ![]() RO● + OH● + Cu2+
RO● + OH● + Cu2+
ROOH + Cu2+ ![]() RO2● + H+ + Cu1+
RO2● + H+ + Cu1+
Возможно участие катализатора в продолжении цепей :
RO2● + Cu2++ H2O ![]() RO● + Cu(OH)2
RO● + Cu(OH)2
RO● + RH ![]() R● + ROOH
R● + ROOH
В соответствии с механизмом окисления антиоксиданты могут участвовать в различных элементарных реакциях:
RO2· + InH ![]() ROOH + In·
ROOH + In·
In· + RH ![]() R· + InH
R· + InH
ROOH + InH ![]() молекулярные продукты
молекулярные продукты
Показано, что в водно-липидной среде дибунол проявлял себя как сильный ингибитор: наблюдался период полного торможения, период аутоускорения и достижение максимальной скорости окисления (рис. 3). Периоды индукции увеличивались пропорционально увеличению концентрации дибунола.
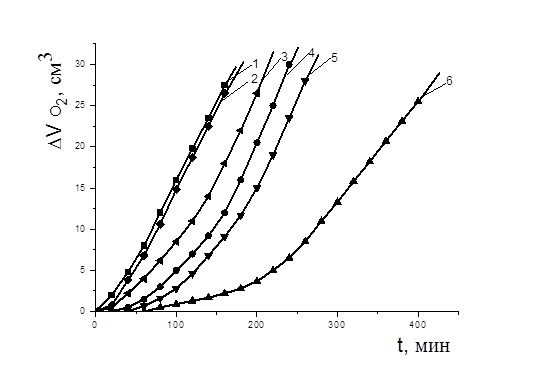
Рисунок 3. Кинетика окисления этилолеата в водно-липидной среде в присутствии добавок дибунола, М: 1 — контроль, 2 — 1×10-6, 3 — 2×10-5, 4 — 5×10-5, 5 — 1×10-4, 6 — 5×10-4; 2×10-3 М CuCl2, t=60 0С
По наклону прямой в координатах t,[InH] была рассчитана скорость инициирования в обеих системах, получены значения 4,2×10-8 и 6,7×10-5 М×с-1 в безводной и водно-липидной системе соответственно. Сравнение максимальных скоростей окисления липидов при t=(60±0,2)°С в гомогенной и гетерогенной системах, равных 8,0×10-7 и 1,4×10-4 М×с-1, соответствовало различию скоростей инициирования ~ в 1000 раз.

Рисунок 4. Кинетика окисления этилолеата в водно-липидной среде в присутствии добавок АО в концентрации 1×10-3 М: 1 — контроль; 2 — a-токоферол; 3 — салициловая кислота; 4 — фенол; 5 — парацетамол; 6 — осалмид; 2×10-3 М CuCl2, t=60 0 С
Между тем вопрос о роли a-токоферола в биомембранах далек от своего решения. Известен сложный механизм действия a-токоферола в безводных углеводородных и липидных субстратах, его участие не только в реакциях обрыва цепей, но и реакциях продолжения цепей и распаде гидропероксидов. Последние реакции приводят к снижению антиоксидантной активности a-токоферола. Анализ кинетических кривых окисления этилолеата с добавками АО показал существенные отличия механизма действия a-токоферола от дибунола в зависимости от концентраций. С увеличением концентрации a-токоферола наблюдалась инверсия антиоксидантного действия (табл. 4), при этом увеличивалась максимальная скорость окисления. Причиной ускорения процесса может быть комплексообразование OH-группы a-токоферола с катионами меди. В процессе окисления a-токоферол образует достаточно активные токофероксильные радикалы (In·), способные участвовать в побочных реакциях продолжения цепей с молекулами субстрата (RH) [1]:
In· + RH ![]() R· + InH
R· + InH
В результате этой реакции восстанавливается активная фенольная форма антиоксиданта, взаимодействующая в дальнейшем с пероксильными радикалами, ведущими цепи окисления:
RO2· + InH ![]() ROOH +In·
ROOH +In·

Рисунок 5. Кинетика окисления этилолеата в водно-липидной среде в присутствии добавок осалмида, М: 1 — контроль, 2×10-3; 2 — 1×10-4; 3 — 5×10-4; 4 — 1×10-3; 5 — 1×10-2; 2×10-3 М CuCl2, t=600 С
Осалмид проявлял более высокую антиоксидантную активность, чем фенол, салициловая кислота и парацетамол в соизмеримых концентрациях (рис. 4). На рис. 5 показаны типичные КК окисления этилолеата в водно-липидной среде в присутствии осалмида. Установлено, что все исследуемые концентрации осалмида уменьшали начальную и максимальную скорости окисления в 2—5 раз по сравнению с контролем (табл. 4). Кинетические кривые окисления этилолеата с добавками парацетамола представлены на рис. 6. В изученном диапазоне концентраций парацетамола наблюдалось отсутствие периода полного торможения, но отмечалось снижение начальной и максимальной скоростей окисления по сравнению с контролем в 3—5 раз (табл. 4). Такой характер КК для парацетамола предполагает подавление антиоксидантных свойств фенольного гидроксила за счет образование хелатных комплексов с катионами меди (II) и проявление ингибирующего эффекта только за счет аминогруппы.
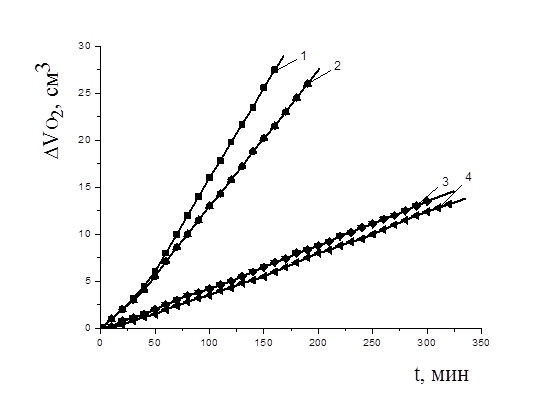
Рисунок 6. Кинетика окисления этилолеата в водно-липидной среде в присутствии добавок парацетамола, М: 1 — контроль, 2 — 1×10-4; 3 — 1×10-3; 4 — 1×10-2; 2×10-3 М CuCl2, t=600 С
На рис. 5. показаны зависимости периодов индукции антиоксидантов от их концентраций: наблюдалась экстремальная зависимость с максимумом в 5×10-4 М для a-токоферола, для салициловой кислоты максимум соответствовал концентрации 8×10-3 М (табл. 4), для осалмида, фенола и дибунола периоды индукции возрастали с увеличением концентрации соединения, периоды индукции парацетамола возрастали до 1×10-3 М и в дальнейшем практически не изменялись. Исходя из концентрационных зависимостей, получаем ряд уменьшения АОА активности: дибунол > осалмид > a-токоферол > парацетамол > фенол > салициловая кислота.
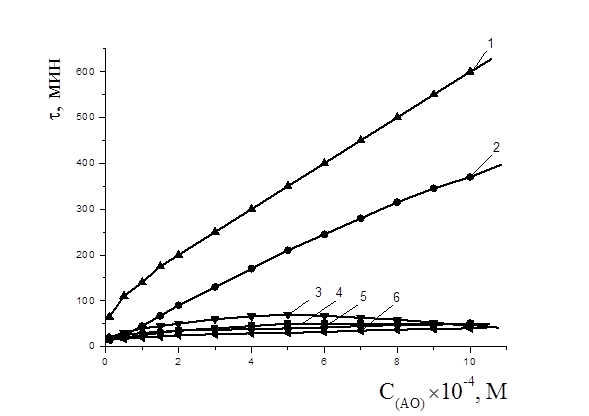
Рисунок 7. Зависимости периода индукции от концентрации антиоксидантов в водно-липидной среде: 1 — дибунол, 2 — осалмид, 3 — a-токоферол, 4 — фенол, 5 — парацетамол, 6 — салициловая кислота; 2×10-3 М CuCl2,субстрат окисления — этилолеат, 2×10-3 М CuCl2,t=60 0С
Таблица 4.
Кинетические параметры окисления этилолеата в водно-липидной среде в присутствии 2×10-3 М CuCl2 в зависимости от концентрации АО, t=60°С
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В работе была проанализирована закономерность изменения начальной (Wo2нач) и максимальной (Wo2max) скорости окисления в присутствии различных концентраций изучаемых АО. Установлено, что указанные кинетические параметры практически не изменялись с ростом концентрации дибунола и α-токоферола, но существенно уменьшались при введении осалмида и парацетамола (табл. 2, 3). По всей вероятности, выявленная закономерность связана с участием аминофенолов в реакциях нерадикального разрушения гидропероксидов. Были проведены эксперименты по прямому тестированию кинетики накопления гидропероксидов (ROOH) после введения в частично окисленную линолевую кислоту (ЛК) каждого из исследуемых АО (рис. 6). Из рис. видно, что влияние всех АО было однотипным: после внесения ингибитора в течение первого часа наблюдалось снижение концентрации гидропероксидов практически до исходного уровня, который в дальнейшем не возрастал в течение всего периода наблюдений (8 часов). В контроле гидропероксиды продолжали накапливаться. Установлено, что АО способствовали разрушению гидропероксидов на 70—75 %.

Рисунок 8. Кинетика накопления гидропероксидов при аутоокислении ЛК в присутствии равных концентраций АО: 1 — контроль, 2 — осалмид, 3 — парацетамол. Стрелкой показан ввод АО. С (АО)=2´10-4 M, t=600 C
По результатам антиоксидантной активности было выявлено наиболее эффективное соединение — осалмид. В Новосибирском институте органической химии (НИОХ) им. Н.Н. Ворожцова СО РАН на базе структуры осалмида была синтезирована группа N-замещенных амидов салициловой кислоты, имеющих в орто- положении экранирующие трет-бутильные заместители:

3-трет-бутил-N-(3¢,5¢-ди-трет-бутил-4¢-гидрокси-фенил)-2-гидрокси-5-этил-бензамид

N-[3-(3¢,5¢-ди-трет-бутил-4¢-гидрокси-фенил)-пропил]-2-гидрокси-бензамид
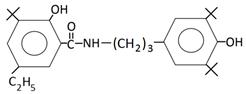
3-трет-бутил-N-[3-(3¢,5¢-ди-трет-бутил-4¢-гидрокси-фенил)-пропил]-2-гидрокси-5-этил-бензамид
Сравнительному тестированию ингибирующих свойств новых перспективных соединений с целью выявления среди них активных антиоксидантов будет посвящена отдельная работа. Полученные результаты могут служить методологической основой для оценки комплексного действия антиоксидантов, перспективных для стабилизации окисления пищевых и биологически активных липидов, лекарственных препаратов, косметических средств.
Примечание:
1. Получен ряд уменьшения константы скорости реакции АО с пероксильными радикалами k7: 3,60×106 М-1´с-1 (a-токоферол) > 6,86×104 М-1´с-1 (осалмид) > 4,00×104 М-1´с-1 (парацетамол) > 1,40×104 М-1´с-1 (дибунол) > 2,40×103 М-1´с-1 (фенол) > 2,30×103 М-1´с-1 (салициловая кислота).
2. Установлено, что осалмид и парацетамол в процессе окисления способны как эффективно уничтожать пероксильные радикалы, так и разрушать гидропероксиды молекулярным путем. Вероятно, что антирадикальная активность ингибиторов обусловлена присутствием в их химической структуре фенольного гидроксила, а способность разрушения гидропероксидов связана с наличием аминогруппы.
3. Показан идентичный механизм действия стационарного антиоксиданта дибунола при инициированном окислении безводных и катализируемых мицеллярных липидных субстратов.
4. Установлена слабая антиоксидантная активность a-токоферола при каталитическом окислении мицеллярных липидных субстратов.
5. Установлена высокая антиоксидантная активность парацетамола в безводной инициируемой свободными радикалами среде и низкая в водно-липидной катализируемой среде.
Список литературы:
1.Бурлакова Е.Б., Крашаков С.А., Храпова Н.Г. Кинетические особенности токоферолов как антиоксидантов. Черноголовка, 1992. — 56 с.
2.Владимиров Ю.А., Суслова Т.Б., Оленев В.И. Митохондрии. Транспорт электронов и преобразование энергии. М.: Наука, 1976. — 109 c.
3.Коган А.Х., Сыркин А.Л., Дриницина С.В. Кислородные свободнорадикальные процессы в патогенезе ишемической болезни сердца и перспективы применения антиоксиданта Q10 (убихинона) для их коррекции // Кардиология. — 1997. — № 12. — С. 62—70.
4.Козлов Ю.П. Свободные радикалы и их роль в нормальных и патологических процессах. М.: Изд-во МГУ, 1973. — 174 с.
5.Перевозкина М.Г., Тихонова В.В., Ушкалова В.Н. Каталитическое окисление липидных субстратов в присутствии фенолов и аминов // В сб.: Свободно-радикальное окисление липидов в эксперименте и клинике. Тюмень, Из-во Тюм.ГУ. 1997. — С. 90—104.
6.Перевозкина М.Г. Каталитическое окисление липидов в водных растворах в присутствии солей металлов переменной валентности // Матер. 35-й Всерос. науч. конф. «Актуальные проблемы теоретической, экспериментальной, клинической медицины и фармации». Тюмень. 2001. — С. 55—57.
7.Перевозкина М.Г. Кинетика и механизм ингибирующего действия производных фенозана, салициловой кислоты и их синергических смесей с α-токоферолом и фосфолипидами. Автор. канд. хим. наук. Тюмень. 2003. — 28 с.
8.Перевозкина М.Г. Кинетические модели для тестирования антиоксидантов // Естественные и математические науки в современном мире. Новосибирск. — 2013. — № 9. — С. 75—101.
9.Перевозкина М.Г. Метиллинолеатная кинетическая модель для тестирования антиоксидантных свойств капотена // Естественные и математические науки в современном мире. Новосибирск. — 2013. — № 9—10. — С. 189—204.
10.Перевозкина М.Г. Каталитическое окисление мицеллярных субстратов в присутствии адреналина и метилдофа // Естественные и математические науки в современном мире. Новосибирск. — 2013. — № 11. — С. 196—112.
11.Перевозкина М.Г. Тестирование антиоксидантной активности лекарственных препаратов различного фармакологического действия // В сб.: «Фармакология»: коллективная научная монография; [под ред. В.П. Волкова]. Новосибирск: Изд-во. «СибАК», 2013. — С. 73—127.
12. Ушкалова В.Н., Перевозкина М.Г., Барышников Э.В. Разработка способа тестирования средств антиоксидантотерапии // В сб.: Свободно-радикальное окисление липидов в эксперименте и клинике. Тюмень, Из-во Тюм.ГУ. 1997. — С. 77—82.
13. Шанин Ю.Н., Шанин В.Ю., Зиновьев Е.В. Антиоксидантная терапия в клинической практике. М.: Изд-во «Элби», 2009. — 128 с.
14. Шляпинтох В.Я., Карпухин О.Н., Постников Л.М. Хемилюминесцентные методы исследования медленных химических процессов, М.: Наука, 1966. — 300 с.
дипломов



Оставить комментарий