Статья опубликована в рамках: XXV Международной научно-практической конференции «Инновации в науке» (Россия, г. Новосибирск, 07 октября 2013 г.)
Наука: Медицина
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
ИСПОЛЬЗОВАНИЕ ИЛЕОЦЕКАЛЬНОГО СЕГМЕНТА КИШЕЧНИКА НА РЕКОНСТРУКТИВНОМ ЭТАПЕ ПОСЛЕ КОМБИНИРОВАННОЙ ГАСТРЭКТОМИИ
Бойко Валерий Владимирович
д-р мед. наук, профессор, директор ГУ «Институт общей и неотложной хирургии им В.Т. Зайцева Национальной академии медицинских наук Украины», г. Харьков
Лазирский Вячеслав Алексеевич
канд. мед. наук, ассистент кафедры хирургии № 1 Харьковского Национального медицинского университета, г. Харьков
E-mail:
USE OF THE CECUM ILEOCOLIC SEGMENT FOR THE UPPER GASTROINTESTINAL TRACT RECONSTRUCTION IN PATIENTS WITH COMPLICATED LOCALLY EXPANDED GASTRIC CANCER
Boyko Valeriy
doctor of medical science, professor, director of State institution “Zaycev V.T. institute of general and urgent surgery of National academy of medical sciences of Ukraine”, Kharkov
Lasirskiy Vyatceslav
candidate of medical science, Assistant professor of Surgery № 1 Kharkiv National Medical University, Kharkov
АННОТАЦИЯ
Цель: изучение результатов гастропластики илеоцекальным сегментом кишечника у больных местно-распространенным раком желудка. Методы: основная группа — 13 больных с илеоцекальной гастропластикой. Группа сравнения — 20 больных с концево-петлевым эзофагоеюноанастомозом. Результаты: Гастропластика илеоцекальным сегментом способствовала снижению числа постгастрэктомических синдромов возникших в отдаленные сроки у 2 больных (15,3 %) и у 10 (58,8 %) больных группы сравнения. Выводы: при лечении данной патологии целесообразна разработка и применение новых методов гастропластики.
ABSTRACT
Objective: To study the results of gastroplasty ileocecal segment of the intestine in patients with locally advanced gastric cancer . Methods: The study group — 13 patients with ileocecal gastroplasty . The comparison group — 20 patients with end — loop ezofagoeyunoanastomozom. Results: gastroplasty ileocecal segment has reduced the number postgastrektomicheskih syndromes occurred in the remote period in 2 patients (15,3 %) and in 10 (58,8 % ) patients of the comparison group. Conclusion: in the treatment of this pathology is suitable development and application of new methods of gastroplasty.
Ключевые слова: местно-распространенный рак желудка; гастропластика илеоцекальным сегментом кишечника.
Key words: locally expanded gastric cancer; gastroplastic by the ileocecum colonic segment.
Выбор метода реконструкции пищеварительного тракта после гастрэктомии является главным фактором, влияющим на частоту развития различных органических и функциональный расстройств пищеварения. По данным ряда авторов рефлюкс-эзофагит возникает у 21,0—52,4 % больных после гастрэктомии [1, 2, 4]. С целью предупреждения этих осложнений было разработано более 70 реконструктивных и пластических операций. Однако проблема выбора метода реконструкции при оказании неотложной онкохирургической помощи больным с местно-распространенным раком желудка (МРРЖ) остается актуальной [1, 3, 5]. Целью исследования был анализ опыта гастропластики илеоцекальным сегментом кишечника.
Материалы и методы. Нами исследованы результаты хирургического лечения 13 больных местно-распространенным раком желудка с 2009 по 2013 гг. в возрасте от 32 до 69 лет. Средний возраст составил 57,6 ± 6,7 лет. Из них мужчин — 10 (76,9 %), женщин — 3 (23,1 %). Всем больным на реконструктивном этапе после комбинированной гастрэктомии выполнена гастропластика илеоцекальным сегментом кишечника. Локализация опухоли и стадирование по классификации TNM приведены в табл. 1.
Таблица 1.
Локализация опухоли желудка и распределение больных основной группы по классификации TNM
|
№ п/п |
Локализация опухоли |
Количество больных |
Стадия TNM |
|
1. |
Кардиальный отдел желудка |
1 1 |
Т4N1M0G3 Т4N1M0G2 |
|
2. |
Тело желудка |
1 1 |
Т4N1M0G3 Т4N2M0G3 |
|
3. |
Выходной отдел желудка |
1 1 |
Т4N1M0G3 Т4N1M0G1 |
|
4. |
Субтотальное поражение желудка |
2 2 3 |
Т4N1M0G3 Т4N1M0G1 Т4N2M0G2 |
У 6 больных отмечено кровотечение из опухоли желудка: у 3 больных кровопотеря составила до 1000,0 мл (I степень); у 3 — до 1500,0 мл (II степень). У 2 больных выявлен стеноз выходного отдела желудка (у 1 компенсированный и у 1 субкомпенсированный).
В табл. 2 приведены данные о характере инвазии опухоли желудка в соседние органы и объем выполненных оперативных вмешательств у больных исследуемой группы.
Таблица 2.
Характер инвазии опухоли желудка и выполненных оперативных вмешательств у больных основной группы
|
№ п/п |
Характер инвазии опухоли желудка в соседние органы |
Количество больных |
Выполненные операции |
|
1. |
Распространение опухоли кардиального отдела желудка на абдоминальный и нижнегрудной отделы пищевода |
2 |
Комбинированная гастрэктомия D2 с резекцией нижнегрудного отдела пищевода из комбинированного абдоми-нального и правостороннего торакотомного доступа. |
|
2. |
Инвазия опухоли желудка в поперечно-ободочную кишку и ее брыжейку (рак тела и выходного отдела желудка) |
8 |
Комбинированная гастрэктомия D2 с резекцией правой половины толстой кишки и сохранением илеоцекального сегмента кишечника на сосудистой ножке (a. ileocolica). |
|
3. |
Рак тела желудка с инвазией в хвост поджелудочной железы и брыжейку поперечно-ободочной кишки |
2 |
Комбинированная гастрэктомия D2 с резекцией хвоста поджелудочной железы и в 1 случае спленэктомией, резекция правой половины толстой кишки с сохранением илеоцекального сегмента. |
|
4. |
Первично множественный рак (рак тела желудка с инвазией в головку поджелудочной железы и рак среднегрудного отдела пищевода) |
1 |
Комбинированная гастрэтомия D2 с плоскостной резекцией головки поджелудочной железы и экстирпацией пищевода из абдоминоцервикального доступа. |
В сроки от 1 до 24 месяцев динамическому функциональному обследованию было подвергнуто 11 больных основной группы и 17 — группы сравнения (начиная с 6мес. только выжившие пациенты), у которых помимо клинических, биохимических, иммунологических исследований, выполняли УЗИ, КТ, ФЭГДС, исследование пассажа бариевой взвеси по пищеварительному тракту. Электрогастрографию выполняли с помощью микропроцессорного электрогастрографа ЭГГ-МПО1 (Украина). У всех больных выполняли биопсию из тонко и толстокишечной части трансплантата с последующим гистологическим исследованием. С целью изучения жирового обмена и оценки всасывания в кишечнике проводились копрологическое исследование и изучение липидов сыворотки крови. Для сопоставления изучаемых показателей нами сформирована группа сравнения, в которую вошло 20 больных с раком желудка, перенесших комбинированную гастрэктомию с формированием петлевого эзофагоеюноанастомоза на длинной петле с брауновским межкишечным анастомозом и заглушкой приводящей петли по А.А. Шалимову. В эту группу вошли 13 (65,0 %) мужчин и 7 (35,0 %) женщин в возрасте 59,3 ± 9,7 лет. Обе группы по изучаемым показателям сопоставимы. Локализация опухоли и характер выполненных операций в группе представлены в табл. 3.
Таблица 3.
Локализация опухоли и характер выполненных оперативных вмешательств в группе сравнения
|
№ п/п |
Локализация опухоли |
Количество больных |
Объем операции |
|
1. |
Опухоль тела желудка с инвазией в тело и/или хвост поджелудочной железы |
7 |
Комбинированная гастрэктомия с резекцией тела и/или хвоста поджелудочной железы, спленэктомия |
|
2. |
Опухоль кардиального отдела желудка с распространением на абдоминальный отдел пищевода |
3 |
Гастрэктомия с резекцией абдоминального и нижне-грудного отдела пищевода по Савиных |
|
3. |
Опухоль кардиального отдела желудка с инвазией в III сегмент печени |
2 |
Комбинированная гастрэктомия с резекцией III сегмента печени |
|
4. |
Опухоль выходного отдела желудка с инвазией в поперечно-ободочную кишку и ее брыжейку |
6 |
Комбинированная гастрэктомия с резекцией поперечно-ободочной кишки (в 2 случаях с трансверзостомией) |
|
5. |
Субтотальное поражение желудка с инвазией в голову поджелудочной железы и гепатодуоденальную связку |
2 |
Комбинированная гастрэктомия с панкреатодуоденальной резекцией и резекцией гепатодуоденальной связки с формированием эзофаго-илеоанастомоза по Ру |
У всех больных группы сравнения исключая 2 пациентов с комбинированной гастрэктомией и панкреатодуоденальной резекцией сформированы петлевые эзофагоеюноанастомозы на длинной петле по Шлаттеру (Schlatter).
Результаты. В основной группе продолжающееся кровотечение из изъязвленной опухоли желудка отмечено у 2 (15,0 %) больных. В обоих случаях достигнут эндоскопический гемостаз: путем орошения 5 % раствором Ε-аминокапроновой кислоты — 1 больной, еще в одном случае — эндоскопический инъекционный гемостаз. Всем больным проводилась консервативная гемостатическая терапия и предоперационная подготовка, включая переливание эритроцитарной массы и белковых препаратов (свежезамороженной плазмы и 20 % раствора альбумина). У 4 больных до операции перелита эритроцитарная масса с целью коррекции острой анемии: у 3 — от 500,0 до 600,0 мл, у 1 — 960,0 мл.
Наиболее частым поводом к выполнению гастропластики илеоцекальным сегментом кишечника явилось распространение опухоли желудка на поперечно-ободочную кишку и ее брыжейку (8 случаев) и прорастание опухоли желудка в дистальную часть поджелудочной железы и брыжейку толстой кишки в области a. colica media (2 больных). Данная клиническая ситуация требовала помимо гастрэктомии выполнения резекции толстой кишки. Особенностью нашей операции является выполнение комбинированной гастрэктомии с резекцией правой половины толстой кишки с сохранением илеоцекального сегмента на питающей сосудистой ножке (a. ileocolica) с последующим его перемещением в желудочную позицию после аппендэктомии.
Гастропластика осуществлялась путем формирования эзофагоилеоанастомоза (у 2 больных «конец в конец» и у 8 — «конец в бок») и цекодуоденоанастомоза (у 2 больных «конец в конец» и у 8 — терминолатеральный). Формирование анастомозов по типу конец в бок, по нашему мнению, предпочтительнее, поскольку облегчает формирование анастомозов различных по диаметру отделов пищеварительного тракта. Кроме того при необходимости «низкой» резекции желудка с оставлением короткой культи двенадцатиперстной кишки формирование анастомоза с ней технически затруднено. Схема операции и ее окончательный вид представлены на рис. 1.
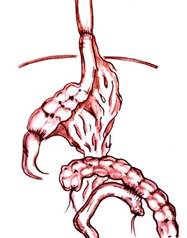 А)
А) 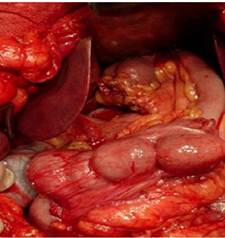 Б)
Б)
Рисунок 1. Схема (А) и окончательный вид (Б) гастропластики илеоцекальным сегментом кишечника
Данные периоперационного периода представлены в табл. 4
Таблица 4.
Периоперационные результаты
|
Показатель |
Основная группа |
Группа сравнения |
|
Время операции, мин |
233 ± 25,3 |
201 ± 20,5 |
|
Интраоперационная кровопотеря, мл |
715, 5 ± 326,5 |
439,4 ± 172,3 |
|
Периоперационная трансфузия, мл |
505,7 ± 206,3 |
289,1 ± 104,2 |
|
Послеоперационный койко-день |
19,3 ± 6,1 |
13,9 ± 4,2 |
Из приведенных данных видно, что выполнение гастропластики илеоцекальным сегментом сопровождается незначительным увеличением времени операции, кровопотери и объема гемотрансфузии. Ведение послеоперационного периода у больных основной группы не отличалось от такового после стандартной гастрэктомии. Энтеральное питание начинали с 2—4 суток после операции.
Данные о характере и количестве осложнений приведены в таблице 5.
Таблица 5.
Характер ранних п/о осложнений в основной и группе сравнения
|
№ п/п |
Осложнения |
Основная группа |
Группа сравнения |
|
1. |
Двухсторонний плеврит |
2 |
1 |
|
2. |
Несостоятельность эзофагоилеоанастомоза |
1 (1) |
- |
|
3. |
Панкреатический свищ |
1 |
1 |
|
4. |
Анастомозит |
– |
1 |
|
5. |
Тромбоз воротной вены |
– |
1 (1) |
|
6. |
Пневмония |
1 |
– |
|
7. |
О. сердечно-сосудистая недостаточность |
1 (1) |
– |
|
8. |
Панкреонекроз и перитонит |
|
1 (1) |
|
9. |
Недостаточность культи дуоденум |
– |
1 |
|
|
ВСЕГО |
6 (2) |
6 (2) |
Примечание — в скобках указаны летальные исходы
В основной группе процентное соотношение осложнений несколько выше (46,1 %), чем в группе сравнения(30,0 %), что, однако не носит статистически достоверный характер.
В раннем послеоперационном периоде умерло 2 (15,3 %) больных основной группы и 2 (10,0 %) — группы сравнения. Причиной летального исхода явилась несостоятельность шейного эзофагоилеоанастомоза у больного после гастрэктомии с экстирпацией пищевода и пластикой илеоцекальным сегментом, развившаяся на 7 сутки после операции. Несостоятельность привела к формированию пищеводнотрахеального свища, двухсторонней пневмонии и плеврита. Еще 1 больной основной группы после комбинированной гастрэктомии и резекции пищевода (среднегрудного отдела) умер от сердечной слабости. В группе сравнения у 1 больного после комбинированной гастрэктомии с ПДР и резекцией гепатодуоденальной связки развился тромбоз воротной вены, вследствие полиорганной недостаточности больной скончался. Еще у 1 больного развился панкреонекроз культи поджелудочной железы с образованием левостороннего поддиафрагмального абсцесса с переходом в разлитой фибринозно-гнойный перитонит.
При рентгенологическом исследовании в сроки от 21-го дня после операции до 12 месяцев у больных основной группы выявлено порционное поступление бариевой взвеси в двенадцатиперстную кишку с отсутствием рефлюкса контрастного вещества в тонкокишечную часть трансплантата и пищевод в положении Тренделенбурга (рис. 2).
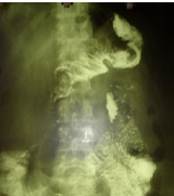
Рисунок 2. Б-я В. Отсутствие рефлюкса контраста в положении Тренделенбурга (24 сутки после гастропластики)
Кишечный резервуар заполнялся в течение 3—7 минут, в среднем (4,5 ± 1,2) мин. Первые порции контрастного вещества эвакуировались из толстокишечной части трансплантата через 5—8 минут, в среднем (7 ± 1,2) мин. Отмечено ритмичное, порционное поступление контраста в двенадцатиперстную кишку.
В сроки до 3 месяцев нами выявлен ускоренный пассаж бария по кишечнику у больных, перенесших гастропластику илеоцекальным сегментом. Среднее время продвижения контрастной массы до прямой кишки составило 6 ± 1,2 часов, что сопровождалось учащением стула до 4 раз в сутки. У двух больных отмечена стойкая диарея до 5—6 раз в сутки в сроки до 4 месяцев. Проводимая консервативная терапия (диета, ферментные препараты, иммодиум) у 10 больных сопровождалась нормализацией скорости пассажа бария, стула и показателей копрограммы.
Через 6 месяцев после операции отмечено более замедленное продвижение контрастного вещества из резервуара в двенадцатиперстную кишку, которое колебалось от 10 до 15 мин, в среднем (12,3 ± 1,9) мин.
Эндоскопическое исследование проведено нами у 10 больных основной и 12 больных группы сравнения в сроки от 1 до 12 месяцев. Видеоэндоскопия выполнялась аппаратом Olimpus (EVIS EXERA ІІ) GIF — H180 (Япония). Ни у одного больного основной группы не выявлен дуодено-илеоэзофагальный рефлюкс. Слизистая пищевода и тонкокишечной части трансплантата розовая, без признаков воспаления. Илеоцекальный клапан сомкнут, легко расправляется при инсуфляции воздуха (рис. 3). Слепая кишка макроскопически без признаков воспаления. Отмечается активная перистальтика тонко- и толстокишечной части трансплантата.
![Описание: C:\Мои документы\Хождение по мукам 2 (ДД)\Фото- видео и рентгенограммы\Фото ФГДС илео-цекальный трансплантат\илеоцекальный переход\Зверев[(005401)20-40-17].JPG](/sites/default/files/files/2013_10_07_Innovation/7_Boyko.files/image004.jpg)
Рисунок 6. Б-й З., 60 лет. Эндофотограмма зоны илеоцекального клапана через 3 месяца после гастропластики илеоцекальным сегментом
Через 3 мес. при гистологическом исследовании выявлена умеренная лимфо-плазмоцитарная инфильтрация слизистой слепой кишки, выявлены фрагменты пейеровых бляшек в слизистой тонкой кишки трансплантата. В слизистой нижней трети пищевода воспаление отсутствует.
При эндоскопическом исследовании через 6 месяцев у 6 (35,2 %) больных группы сравнения выявлен рефлюкс эзофагит. Через 12 месяцев у 5 (29,4 %) больных выявлен дистальный эрозивно-язвенный эзофагит, не поддающийся консервативной терапии с развитием стриктуры эзофагоеюноанастомоза у 3 больных. Следует отметить, что у 2 больных эзофагоеюноанастомоз был сформирован при помощи циркулярного сшивающего аппарата. После верификации доброкачественного характера стриктуры всем больным проводилась эндоскопическая баллонная дилатация зоны анастомоза. У 2 (11,7 %) больных (аппаратный шов анастомоза) вследствие неэффективности лечения выполнена реконструкция эзофагоеюноанастомоза.
С целью оценки пищеварения и усвоения жиров у всех больных основной и группы сравнения проведено копрологическое исследование. Исследование проводилось на фоне диеты Шмидта в сроки от 1 до 12 месяцев. Количественная оценка результатов исследования выражалась традиционно числом плюсов. Через 1 месяц у 8 (61,5 %) больных основной группы выявлена стеаторея всех трех типов. Так, у всех больных выявлен нейтральный жир (стеаторея I типа), что характерно для внешнесекреторной недостаточности поджелудочной железы. Кроме того, наличие жирных кислот и мылов (++) указывало на стеаторею II и III типов соответственно. Повышение содержания мылов указывало на нарушение всасывания жиров, что связано с ускоренным пассажем пищи по кишечнику. Учитывая полученные данные, нами проводилась коррекция цекального и панкреатического кишечных синдромов путем назначения ферментных препаратов, эубиотиков, иммодиума и диеты.
Через 3 месяца только у 2 больных основной группы, перенесших резекцию поджелудочной железы выявлен нейтральный жир (+) что, однако, не сопровождалось жалобами либо клиническими проявлениями. Слизь отсутствовала у всех больных, количество перевариваемой растительной клетчатки, а также неизмененных мышечных волокон соответствовало норме (+ –). В более отдаленные срои (от 6 до 12 месяцев) только у 2 больных основной группы выявлена стеаторея I и II типов.
У больных группы сравнения через 1 месяц выявлена стеаторея всех трех типов: липолитическая (I тип) — у 7 (41,1 %) больных, холелитическая — у 6 (35,2 %), энтеральная — у 2 (11,7 %) пациентов. В отдаленные сроки, начиная с 6 месяцев, отмечено уменьшение II типа стеатореи при практически неизменном уровне стеатореи I типа и увеличением количества больных с энтеральной стеатореей (III тип). Так, в группе сравнения через 12 месяцев из 12 обследованных больных стеаторея I типа выявлена у 5 (41,6 %) больных, II типа — у 2 (16,6 %), III типа — у 5 (41,6 %) больных.
Отдаленные результаты в сроки от 1 месяца приведены в табл. 6.
Таблица 6.
Характер осложнений в отдаленном периоде у больных обеих групп
|
Осложнение |
Основная группа |
Группа сравнения |
|
Рефлюкс-эзофагит |
- |
5 |
|
Стриктура эзофагоеюноанастомоза |
- |
3 |
|
Демпинг-синдром |
- |
1 |
|
Синдром приводящей петли |
- |
1 |
|
Агастральная астения |
1 |
- |
|
Спаечная кишечная непроходимость |
1 |
- |
|
ВСЕГО |
2 (15,3 %) |
10 (58,8 %) |
Преобладали функциональные осложнения у больных группы сравнения.
У всех больных обеих групп в послеоперационном периоде проведено не менее 3 курсов химиотерапии в сроки от 1 до 12 месяцев. Базовыми препаратами являлись фторурацил и цисплатина.
В сроки от 6 до 12 мес. из 11 выживших больных основной группы умерли 3 (27,3 %) больных. Еще трое умерли в сроки от 12 до 24 месяцев. В группе сравнения медиана выживаемости составила 18,6 месяцев (таблица 7).
Таблица 7.
Результаты хирургического лечения в обеих группах больных (умершие в послеоперационном периоде исключены)
|
Характер инвазии опухоли желудка |
Количество больных |
Количество наблюдаемых больных |
Медиана выживаемости |
||
|
Основная группа Пищевод |
6 месяцев |
12 месяцев |
24 месяца |
||
|
1 |
1 |
0 |
0 |
- |
|
|
Толстая кишка |
8 |
8 |
7 |
4 |
- |
|
Поджелудочная железа |
2 |
2 |
1 |
0 |
13,7 |
|
ВСЕГО |
11 |
11 |
8 |
5 |
- |
|
Группа сравнения Поджелудочная железа |
6 |
6 |
4 |
2 |
16,2 |
|
Пищевод |
3 |
3 |
1 |
0 |
10,7 |
|
Печень |
2 |
2 |
2 |
1 |
18,9 |
|
Толстая кишка |
6 |
6 |
5 |
2 |
22,9 |
|
ВСЕГО |
17 |
17 |
12 |
6 |
18,6 |
Медиана выживаемости в основной группе не достигнута, поскольку исследование носит проспективный характер и 4 больных с илеоцекальной гастропластикой после комбинированной гастрэктомии и резекции толстой кишки на момент написания статьи живы.
Обсуждение. Одним из наиболее частых вариантов распространения опухоли желудка является инвазия в толстую кишку [1, 2]. В наших наблюдениях данный вариант распространения опухоли желудка встречается наиболее часто (32,4 %). В данной клинической ситуации необходимость выполнения гастрэктомии и резекции толстой кишки привела нас к мысли выполнения гастропластики илеоцекальным сегментом. Выполнение гастропластики илеоцекальным сегментом кишечника позволяет избежать возникновения целого ряда функциональных постгастрэктомических расстройств и протезировать моторную, порционно-эвакуаторную и резервуарную функции желудка. Наличие илеоцекального клапана, а также изоперистальтическая реконструкция с включением в процесс пищеварения двенадцатиперстной кишки создают анатомически выгодные условия для функционирования трансплантата, перемещенного в желудочную позицию.
Выполнение данного вида реконструкции требовало незначительного увеличения продолжительности операции и не сопровождалось увеличением интраоперационных показателей. У больных основной группы не отмечено увеличения ни ранних послеоперационных осложнений, ни летальности, связанных с выполнением гастропластики илеоцекальным сегментом. Несостоятельность эзофагоилеоанастомоза на шее с летальным исходом, по-видимому, связана с обширным объемом операции при распространенном опухолевом процессе и недостаточным кровоснабжением дистальной части трансплантата на шее.
Ни у одного больного основной группы нами не выявлено клинических признаков рефлюкс-эзофагита, что, однако встречается с различной частотой при других видах гастропластики [1, 3, 5].
У 8 (40,0 %) больных с петлевым эзофагоеюноанастомозом в отдаленном периоде выявлен рефлюкс-эзофагит приведший у 3 больных к развитию стриктуры анастомоза. Эндоскопическая баллонная дилятация была эффективна у 1 больного. У 2 больных (аппаратный шов анастомоза) выполнена реконструкция эзофагоеюноанастомоза ручным швом.
Выводы.
1.Гастропластика илеоцекальным сегментом не сопровождается увеличением травматичности, времени операции и увеличением послеоперационных осложнений, а в ситуации инвазии опухоли в поперечноободочную кишку может быть рекомендована как метод выбора.
2.Илеоцекальная гастропластика обеспечивает реконструкцию верхних отделов пищеварительного тракта с формированием резервуара, содержащего естественный клапанный механизм, и включением в процесс пищеварения двенадцатиперстной кишки.
3.Гастропластика илеоцекальным сегментом кишечника обеспечивает снижение количества функциональных постгастрэтомических расстройств с 58,8 % до 15,3 % в отдаленном послеоперационном периоде.
Список литературы.
- Бондарь В.Г. Комбинированное вмешательство по поводу местнораспространенного рака дистального отдела желудка / В.Г. Бондарь // Клінічна хірургія. — 2004. — № 1. — С. 24—26
- Диагностика и лечение распространенного рака желудка / М.С. Громов, Д.А. Александров, А.А. Кулаков [и др.] // Хирургия — 2003. — № 4. — С. 20—23.
- Ершов В.В. Применение методики Ру при гастрэктомии и эзофагэктомии // Вестник хирургии им. И.И. Грекова. — 2002, — № 161(5) — С. 71—75.
- Острые желудочно-кишечные кровотечения опухолевой этиологии / А.П. Михайлов, А.М. Данилов, А.Н. Напалков [и др.] // Вестник хирургии. — № 4. — 2006. — С. 79—81.
- Радикальное хирургическое лечение рака желудка, осложненного профузным кровотечением / С.А. Поликарпов, А.Н. Лисицкий, Н.Н. Иров [и др.] // Хирургия — 2008. — № 7. — С. 24—26.
дипломов


Оставить комментарий