Статья опубликована в рамках: XXIX Международной научно-практической конференции «Инновации в науке» (Россия, г. Новосибирск, 29 января 2014 г.)
Наука: Медицина
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
СТРЕССИНДУЦИРОВАННЫЕ ИЗМЕНЕНИЯ ФУНКЦИОНАЛЬНОГО СОСТОЯНИЯ КАРДИОМИОЦИТОВ КРЫС
Игрунова Ксения Николаевна
д-р мед. наук, НМАПО имени П.Л. Шупика, руководитель ЦНИЛ, Украина г. Киев
Зозуля Иван Савович
д-р мед. наук, НМАПО имени П.Л. Шупика, проректор по научной работе, Украина г. Киев
Ватлицов Денис Владимирович
канд. биол. наук, НМАПО имени П.Л. Шупика, ст.н.с. ЦНИЛ, Украина г. Киев
Русецкая Наталия Витальевна
канд. биол. наук, НМАПО имени П.Л. Шупика, н.с., Украина г. Киев
Андрияш Виктория Васильевна
НМАПО имени П.Л Шупика, инженер1 кат., Украина г. Киев
Терещук Анна Владимировна
студент кафедры промышленной биотехнологии факультета биотехнологии и биотехники, НТУУ «КПИ», Украина г. Киев
E-mail: cndl@yandex.ru
STRESS-INDUCED CHANGES IN THE FUNCTIONAL STATE OF RAT CARDIOMYOCYTES
Igrunova Ksenia Nikolaevna
dSc, NMAPE named after P.L. Shupyk, Head of CSRL, Ukraine Kiev
Zozulja Ivan Savovich
dSc, NMAPE named after P.L. Shupyk, Vice-Rector for research, Ukraine Kiev
Vatlitsov Denys Vladimirovich
phD, NMAPE named after P.L. Shupyk, senior researcher of CSRL, Ukraine Kiev
Rusetskaya Nataliya Vital’evna
phD, NMAPE named after P.L. Shupyk, researcher, Ukraine Kiev
Andiyash Victoriya Victorovna
NMAPE named after P.L. Shupyk, I cat. engineer, Ukraine Kiev
Tereschuk Anna Vladimirovna
NTU of Ukraine «KPI», student of industrial biotechnology department of faculty of biotechnology and biotechnics, Ukraine Kiev
АННОТАЦИЯ
В настоящее время установлено важное значение стресса и апоптоза в регуляции работы ССС. Целью работы являлось моделирование сердечной патологии, а также изучение влияния стресса на развитие патологичных состояний. Исследования клеточной регуляции проводилось на проточном цитометре. В статье показано влияние разных типов стресса на развитие патологии сердечной мышцы у экспериментальных животных, с помощью определения количества апоптических клеток. Выявлено, что степень накопления необратимых изменений в кардиомиоцитах зависит от вида стресса.
ABSTRACT
It has established the important role of stress and apoptosis in regulation of the cardiovascular system for present days. The aim of the study was to model of heart disease, as well as studying the effects of stress on the development of pathology. Study of cellular regulation was performed on the flow cytometer. The paper shows the effect of different types of stress on the development of pathology of rat cardiomyocyte, by determining the number of dead cells. It was shown that the extent of permanent changes in cardiomyocytes depends of the type of stress.
Ключевые слова: кардиомиоциты; стресс; апоптоз; некроз; пролиферация.
Keywords: cardiomyocyte; stress; apoptosis; necrosis; proliferation.
Введение. Заболевания сердечно-сосудистой системы занимают первое место в мире среди других болезней по распространенности и смертности. Внезапность развития летальных проявлений таких заболеваний обусловлена длительным накоплением повреждений в органах и тканях за счет апоптической (клинически не проявляемой) гибели клеток органа до уровня критического снижения его функциональных возможностей, что характерно для действия факторов стресса.
В настоящее время установлено важное значение апоптоза, который играет решающую роль в эффективности деятельности сердечно сосудистой системы, а стрессорная нагрузка приводит к дифференцированному изменению уровня апоптоза различных клеток организма. Апоптоз, привлек к себе внимание кардиологов, как потенциальный патогенетический фактор при различных сердечно-сосудистых заболеваниях, поскольку, среди всех известных механизмов развития болезней сердца, этот вариант смерти кардиомиоцитов (КМЦ) является наиболее высокорегулируемым при разработке методов терапевтического воздействия [2, с. 610].
Большое количество исследований показывают, что стресс разной этиологии и продолжительности (острый или хронический) может иметь дифференцированное влияние на функционирование организма и если кратковременный острый стресс стимулирует, то хронический стресс отрицательно сказывается практически на всех системах организма. Было показано, что иммунные показатели в результате стрессорного влияния изменяются опосредованно через гипоталамо-гипофизарно-надпочечниковую систему, а также вегетативную (симпатическую и парасимпатическую) нервную систему [3, с. 95].
Таким образом, вопрос изучения взаимосвязи между стрессорной нагрузкой и развитием патологий сердечно-сосудистой системы весьма актуален на сегодняшний день.
Цель. Смоделировать развитие сердечной патологии на экспериментальных животных, а также изучить влияние разных типов стресса как фактора развитие патологичных состояний сердечной мышцы экспериментальных животных (крыс).
Материалы и методы. Исследование функционального состояние клеток миокарда проводилось на белых беспородных самцах крыс (n=60) весом 200—250 г. Животные содержались на стандартном рационе вивария. Все процедуры проводились соответственно международным правилам гуманного отношения к животным.
За основу психо-эмоционального напряжения было выбрана сенсорно контактная модель изучения агресивности и исследования влияния психо-эмоционального стресорного напряжения крыс, как фактора развития патологичных состояний міокарда [4, с. 287]
Перед началом стрессирования у всех экспериментальных животных были проведены лабораторные исследования крови.
Экспериментальных животных ежедневно высаживали попарно в темные биксы, каждый день сменяя им партнеров, которые были иммобилизованы. Дополнительно крыс, которые находились в пеналах погружали в воду t +5 oC, постепенно увеличивая время пребывания, после чего их же погружали в воду t 42 oC с целью формирования экстремальной нагрузки на серце с помощью психо-эмоционального напряжения и физического истощения (1 группа). Животные группы 2, ежедневно подвергались только психо-эмоциональным нагрузкам. Третья группа животных подвергалась только иммобилизационной и температурной нагрузке без психо-эмоционального комонента. Последняя группа животных (группа 4), являлась контрольной и не подвергалась действию стрессорных факторов. Стрессорная нагрузка увеличивалась постепенно на протяжении всего исследования длительностью 112 суток.
Состояние кардиомиоцитов оценивали по показателям апоптоза, некроза и изменений митохондриального мембранного потенциала. Для определения уровня апоптоза анексиновим методом и изучения мембранного потенциала митохондрий, готовили суспензию кардиомиоцитов в буферном растворе на механическом ресуспендизаторе BD Medimachine (Becton Dickinson, США) с использованием набора для определения апоптоза Annexin V-FITC Apoptosis detection Kit I (BD Bioscience Pharmingen, США).
Изменения митохондального мембранного потенциала клеточной суспензии оценивали, используя методику с флуорохромами родамином 123 (“Fluka”) и пропидий йодидом (“Sigma”) [54, с. 240—242]. Предложенный метод позволяет определить в исследуемом образце: жизнеспособные клетки, некротические и апоптические клетки.
Клеточный цикл, а, следовательно, и пролиферативную активность оценивали путем определения клеточного цикла суспензии кардиомицитов с использованием флуоресцентного зонда пропидий йодид (“Sigma”) [5, с. 89—90; 1, с. 33].
Исследование уровня апоптоза анексиновим методом, изменений митохондриального мембранного потенциала и клеточного цикла проводили на проточном цитометре PAS ( Partec, Германия ).
Статистическую обработку проводили с использованием программы Statistica, применяли t-критерий Стьюдента и описательную статистику. Доверительные интервалы средних значений определяли путем подсчета стандартной ошибки. Различия считали статистически значимыми при р <0,05.
Результаты
Было выявлено, что кардиомиоциты подопытных крыс характеризуются низкой пролиферативной активностью не зависимо от типа стрессового напряжения. Но все же, было зафиксировано незначительное статистически достоверное (р<0,05) снижение пролиферации кардиомиоцитов у животных второй группы, в сравнении с животными других групп. Увеличение количества клеток, которые находились в G1 фазе до 61,59±2,61 %, у животных второй группы и дало возможность сделать заключение, что психо-эмоциональная нагрузка снижала пролиферативную активность клеток, что в дальнейшем может приводить к сердечной недостаточности, поскольку репарационные возможности органа снижаются (Рис. 1).
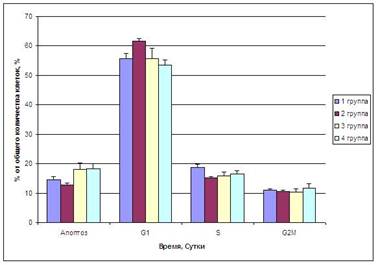
Рисунок 1. Распределение кардиомиоцитов крыс по стадиям клеточного цикла под влиянием разных типов стресорной нагрузки
Изучение распределения клеток по типу клеточной гибели, при действии экспериментальной стресорной нагрузки проводилось в два этапа: по мембранным маркерам (раняя и поздняя стадии апоптоза) и по изменениям митохондриального потенциала (апоптоз и некроз), внутриклеточный запуск гибели клетки.
Изучение транслокации фосфатидилсерина и изменение проницаемости цитоплазматической мембраны выявило статистически значимое (р<0,05) снижение сумарного апоптоза кардиомиоцитов с 84,87±4,84 % в контрольной группе (группа 4) до 52,59±8,98 % в 1 группе животных (рис. 2.). При этом в других экспериментальных групах наблюдалось, статистически не достоверное снижение количества кардиомиоцитов с признаками апоптоза.
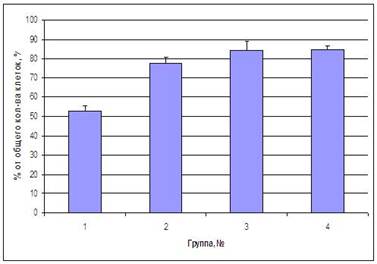
Рисунок 2. Изменения уровня сумарного апоптоза КМЦ экспериментальных животных по результатам исследования мембранных маркеров под влиянием разных типов стресорной нагрузки
Исследование ранней и поздней стадии апоптоза, показало статистически значимое (р<0,05) снижение уровня апоптических клеток на ранней стадии в 1 группе (28,51±3,84 %) в сравнении с контрольными показателями 73,21±11,15 %, в других группах статистически достоверных изменений выявлено не было (рис. 3.).
Исследование поздней энергозависимой стадии спонтанного апоптоза выявило статистически достоверное (р<0,05) увеличение данного показателя в первой (24,08±9,51 %) и снижение до 6,7±2,12 % во второй группе в сравнении с контрольными значениями 11,67±6,76 % (рис. 4. ).
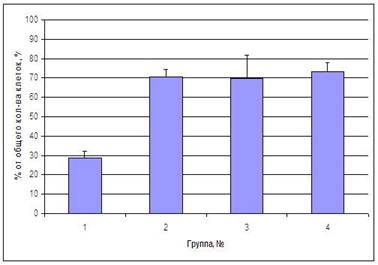
Рисунок 3. Изменения уровня КМЦ на ранней стадии апоптоза экспериментальных животных по результатам исследования мембранных маркеров под влиянием разных типов стрессорного напряжения

Рисунок 4. Изменение количества КМЦ на поздней стадии апоптоза экспериментальных животных по результатам исследования мембранных маркеров под влиянием разных типов стрессорного напряжения
Похожая тенденция, в изменении уровня апоптических клеток, наблюдалась и при изучении изменений митохондриального мембранного потенциала КМЦ. В первой группе значение соответствовало 23,42±1,92 %, во второй 15,58±2,76 %, в третей 18,04±1,00 %, а в четвертой 15,76±1,60 % (рис. 5.).

Рисунок 5. Изменения уровня апоптоза КМЦ по результатам исследования изменений митохондриального мембранного потенциала экспериментальных животных под влиянием разных типов стрессорной нагрузки
Исследование изменений количества некротических КМЦ в зависимости от типа стрессорного напряжения показало значительное статистически достоверное (р<0.05) увеличение таких клеток в основной группе до 4,89±2,02 % в сравнении с контрольной 0,68±0,17 %. В других группах уровень некроза оставался на уровне контрольного значения (рис. 6.).
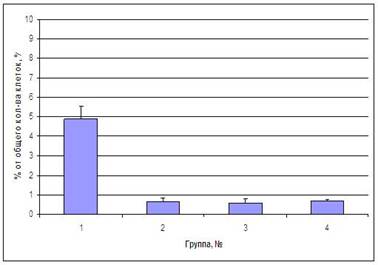
Рисунок 6. Изменение уровня некроза КМЦ экспериментальных животных под влиянием разных типов стрессорной нагрузки
Таким образом, было показано, что длительная иммобилизация в сочетании с гипо- и гипертермическим шоком на фоне психо-эмоциональной стрессорной нагрузки приводит к накоплению необратимых изменений в кардиомиоцитах экспериментальных животных о чем свидетельствует увеличение количества кардиомиоцитов, идентифицируемых на поздней стадии апоптоза и некроза. Поздняя стадия апоптоза является необратимой, поэтому увеличение клеток именно на этой стадии указывает на массовую гибель КМЦ. Также было выявлено почти десятикратное увеличение количества некротических клеток в образцах тканей сердца крыс первой группы, что указывает на рост риска развития дисфункции органа и как следствие — смерти. Поскольку увеличение некротического поражения вызывает увеличение нагрузки на весь организм, а в органе развиваются воспалительные процессы с лавинно подобным увеличением очага поражения.
Выше изложенный материал указывает на значимую роль психо-эмоционального и иммобилизационного стресса на рост рисков развития патологий сердца, что отражалось в росте количества поврежденных кардиомиоцитов. А поскольку современная жизнь несет в себе большое количество психо-эмоциональных стрессорных факторов и, в большинстве случаев, современный человек ведет гиподинамический и гипокинетический образ жизни, что и приводит к росту заболеваний ССС, увеличению внезапной сердечной смерти в современной цивилизации.
Список литературы:
1.Королева О.С. Биомаркеры в кардиологии: регистрация внутрисосудистого воспаления/ О.С. Королева, Д.А. Затейщиков// Фарматека. — 2007. — № 8. — C. 30—36.
2.Don’t lose heart-therapeutic value of apoptosis prevention in the treatment of cardiovascular disease / J.L.V. Reeve, A.M. Duffy, T.O’Brien, A. Samali // J. Cell. Mol. Med. — 2005. — Vol. 9. — P. 609—622.
3.Hussain D. Stress immunity and health: research findings and implications/ D. Hussain // International Journal of Psychosocial Rehabilitation. — 2011 — Vol. 15, — № 1. — P. 94—100.
4.Kudryavtseva N.N. A sensory contact model for the study of aggressive and submissive behavior in male mice / N.N. Kudryavtseva // Aggressive behavior — Vol. 17. — 1991. — P. 285—291.
5.Flow cytometry: a practical approach 3rd edition /University of Oxford ; edited by Michael G. Ormerod. Oxford: Oxford Univ. Press, 2000. — 276 p.
дипломов


Оставить комментарий