Статья опубликована в рамках: XXII Международной научно-практической конференции «Инновации в науке» (Россия, г. Новосибирск, 15 июля 2013 г.)
Наука: Сельскохозяйственные науки
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
ОЦЕНКА МИКРОБИОЦЕНОЗА ПРИ ПРОМЫШЛЕННОМ ВОСПРОИЗВОДСТВЕ РЫБ
Байкенова Айымжан Ислямовна
младший научный сотрудник научно-исследовательской лаборатории биотехнологии и экспериментальной биологии ТОО «БиоПромСервис» РК г. Астана
E-mail: b.aiymjan@mail.ru
Браздылова Нина Сергеевна
старший научный сотрудник лаборатории аквакультуры ТОО «Казахский НИИ рыбного хозяйства» РК г. Алмата
Садыков Азамат Мухамедьярович
заведующий научно-исследовательской лабораторией биотехнологии и экспериментальной биологии
E-mail: aza_sadykov@mail.ru
Балтабеков Арман Аллажарович
старший научный сотрудник научно-исследовательской лаборатории биотехнологии и экспериментальной биологии
ТОО «БиоПромСервис» РК г. Астана
E-mail: arman_82.03@mail.ru
Койшыбаева Сая Кашкинбаевна
заведующая лабораторией аквакультуры ТОО «Казахский НИИ рыбного хозяйства» РК г. Алмата
E-mail: saya.kk@mail.ru
ASSESSMENT IN THE INDUSTRIAL MICROBIOCENOSIS FISH REPRODUKION
Baikenova Aiymzhan
junior Researcher, Research Laboratory of Experimental Biology and Biotechnology, Kazakhstan, Astana LLP "BioPromServis",
Brazdylova Nina Sergeevna
senior Researcher, Laboratory of Aquaculture Kazakhstan Almaty LLP "Kazakh Research Institute of Fisheries"
Sadykov Azamat Muhamedyarovich
head of the Research Laboratory of Experimental Biology and Biotechnology
Kazakhstan, Astana LLP "BioPromServis"
Baltabekov Arman Allazharovich
senior researcher at the Research Laboratory of Experimental Biology and Biotechnology, Kazakhstan, Astana LLP "BioPromServis"
Koyshibaeva Saya
head of Laboratory of Aquaculture, Almaty
АННОТАЦИЯ
В современным состоянием экосистемы Казахстанской аквакультуры и присутствием в ней растворенных и взвешенных органических веществ природного и антропогенного происхождения, особую актуальность приобретают исследования по оценке эколого-микробиологического риска для воспроизводства рыбных ресурсов [6, с. 216].
Учитывая слабую изученность микрофлоры рыб и воды в хозяйствах, подобные исследования водоемов представляют научный и практический интерес в экологии и микробиологии, но и в других областях естественных наук [7, с. 469; 4, c. 489].
ABSTRACT
Due to the current state of the ecosystem Kazakhstan aquaculture and the presence of dissolved and suspended organic substances of natural and anthropogenic, enhanced the importance of research on the environmental and microbiological risk to the reproduction of fish resources [6, р. 216].
Given the insufficient study of microflora of fish and water in the farms, such studies even one of these reservoirs are of scientific and practical interest in ecology and microbiology [7, р. 469; 4, р. 489].
Ключевые слова: аквакультура; рыбные ресурсы;, микробиологические исследования; микрофлора рыб и воды.
Key say: аquaculture; fish resources; microbiological researches; microflorae of fishes and water.
Актуальность
Каждый водоем в естественном состоянии заселен микроорганизмами, занимающими различные экологические ниши. Среди основных групп бактерий выделяются гетеротрофные, которые участвуют в самоочищении водных экосистем, потребляя органические вещества [1, с. 217]. Загрязнение водоема оказывает непосредственное влияние на аборигенную водную микрофлору и микробиоценоз рыб, изменяя их количественное и качественное соотношение. В этих условиях бактериальные показатели приобретают неоценимое индикаторное значение, позволяя выявить различные источники и виды антропогенного воздействия [7, с. 16; 4, с. 467].
Техногенное и антропогенное воздействие на биосферу вызывает сложные процессы, ведущие к деградации экосистем, среди которых особое значение имеет нарушение эволюционно сложившихся микробиоценозов воды, почвы и других компонентов окружающей среды. Поэтому загрязнение водоемов, в том числе микробное, несет в себе угрозу распространения заболеваний и снижения эффективности воспроизводства коммерческого поголовья рыб [2, с. 284].
Заболевания рыб могут наносить большой ущерб рыбоводству, поэтому для успешного разведения рыбы, получения высокой продуктивности важно знать принципы создания благоприятных условий для роста и развития [5, с. 225; 8, с. 15].
Рыбы заболевают в результате нарушения условий содержания и кормления, а также при попадании паразитарных организмов, поэтому при выращивании осетровых рыб необходимо строгое выполнение комплекса ветеринарных и рыбоводных мероприятии, обеспечивающих надлежащую санитарную культуру и сохранение выращиваемой рыбы [9, с. 467; 10, с. 97].
В индустриальном рыбоводстве, направленном на достижение максимального роста рыбы за минимальный промежуток времени, применяются высокопитательные корма, что, при ухудшении условий содержания, создает благоприятные условья для развития условно- патогенной микрофлоры. Применяемые при этом химические препараты, особенно антибиотики, приводят к микробиологической стерилизации организма рыбы, снижению общей резистентности и, как следствие, возникновению неспецифичных инфекционных заболеваний [9, с. 7].
Возбудителями ряда инфекционных болезней рыб являются условно-патогенные микробы, которые в качестве нормальной флоры заселяют кожные покровы тела и слизистые оболочки. К ним, в частности, относятся бактерии рода Aeromonas, Pseudomonas, Streptocоccus, представители семейства Enterobacteriacea и т. д. Слизистые оболочки относятся к естественным защитным барьерам, но при неблагоприятных условиях содержания рыб нарушается проницаемость слизистой кишечника и населяющие ее бактерии проникают во внутренние органы, начинают активно размножаться, вызывая всевозможные негативные явления, как во внутренних органах, так и в самом кишечнике [11, с. 41].
Влияние этих факторов усугубляется весьма значимой зависимостью рыб от качества среды обитания. Отрицательное воздействие вынуждает организм рыб направлять часть своих сил на адаптацию к подобным условиям, что приводит к усилению напряженности иммунитета, ухудшению здоровья, снижению темпа роста и выживаемости [12, с. 115].
В этой связи актуальное значение имеет оценка микробиологического состава окружающей среды воспроизводимых рыб и их слизистых оболочек, которые являются основным барьером инвазии инфекции. В данной статье описаны качественные и количественные характеристики патогенной и условно патогенной микрофлоры внешних покровов и мест обитания рыб [13, с. 28].
Материалы и методы
Чилик — пруды, разновозрастная, старшая группа (от 2 до 6 лет), весовой предел: от 9—115 гр., рост: от 9,3—19,7 см., вид исследуемых рыб: русский осетр, сибирский осетр, судак.
Капчагай — бассейны, одомашненные формы, весовой предел: от 64—93,7 гр., рост: от 25,6—30,6 см., вид исследуемых рыб: стерляди (сеголетки), РОЛО (русский осетр + гибрид Ленский осетр).
В ходе работы был проведен отбор проб из водных резервуаров и водоемов при различных способах содержания рыб, взяты клинические пробы с поверхности жаберных крышек, ротовой полости и анального отверстия у рыб семейства осетровых.
Из различных субстратов отбирали по 1 мл (г) образца, после чего их помещали в пробирки с 9 мл изотонического раствора NaCl, перемешивали и оставляли на 10—15 мин при комнатной температуре. Затем делали разведения, для чего в 9 последующих пробирок для каждого источника с 9 мл изотонического раствора NaCl вносили по 1 мл из предыдущей пробирки, получая, таким образом, во 2 пробирке разведение в 10-2 степени, в 3 пробирке — 10-3 и так далее до получения разведения в 10-6 степени. После разведения проб проводили посев 1 капли суспензии на элективные и дифференциальные среды параллельно на 2 чашки Петри. После инкубации при температуре 37°С в течение 48 ч, подсчитывали среднее число колоний с обеих чашек.
Для выявления различных групп микроорганизмов весь материал высевали на дифференцированные питательные среды. Культивировали культуры в течение 16, 24 и 36 часов в термостате при 30ºС, 37ºС и 42ºС. В исследованиях использовали хромогенные среды с красителями, для более точной идентификаций культур использовали среды Эндо, Левина, МПА, МРС, среду с азидом Na и т. д.
По результатам культуральной характеристики отдельные изоляты бактерий были сгруппированы, так как обладали некоторой схожестью формы, размера и цвета колоний. Далее была проведена микроскопия полученных изолятов [14, с. 567—575].
Из прудов выращиваемых рыб, проводили отбор проб воды для исследования микробиоценоза. Количественный посев воды делали на плотные питательные среды: эритрит-агар — для определения общего микробного числа (ОМЧ) и среду Эндо — для выделения и определения энтеробактерий, аэромонад и НФЩ. Метод для определения общего числа микроорганизмов воде основан, на посеве не менее двух объемов по 1 мл из каждой пробы, культивировании посевов и последующим подсчете выросших колонии. После тщательного перемешивания пробы воды в стерильные чашки Петри под приоткрытую крышку вносили по 1 мл. После внесения воды в каждую чашку (диаметром 90—100) наливали 8—12 мл расплавленного и остуженного до 45—49°С питательного агара. После застывания агар чашки с посевами помещали в термостат вверх дном и инкубировали при 37 (+/–1) °С в течение 24(+/–2) часов.
При учете результатов подсчитывали все выросшие на чашки колонии, наблюдаемые при увеличении в 2 раза. Учитывали только те чашки, на которых выросло не более 300 изолированных колоний. Количество колоний на обеих чашках суммировали и делили на два. Результат выражали числом КОЕ в 1 мл исследуемой пробы.
Для более точной идентификации проводили малый ряд биохимического анализа, где была проведена оценка образования сероводорода, выделение газа, ферментация глюкозы до кислоты. Феноменом образования сероводорода являлось потемнение среды до темно-черного цвета. Пузыри служили знаком образованием газа. Определением ферментации глюкозы до кислоты служило изменение цвета среды от светло-розового до темно-малинового цвета.
Результаты
В результате проведенных работ в основном исследуемые культуры были представлены Грамм положительными палочками, кокками, различающимися по длине, толщине и характеру расположения (Рисунок 1).

а) б)


в) г)
Рисунок 1. Микроскопия полученных изолятов
Выделенные изоляты отличались различной ферментативной активностью (рисунок 2).


Рисунок 2. Первичная идентификация выделенных изолятов
Как мы видем из рисунка 2, представители рода Enterobacteriaceae могут ферментировать глюкозу до кислоты, не кислотоустойчивы, образуют газ, а представители рода Escherichia образуют желтый косяк и желтый столбик, а так же образует газ.
Характеристика уровня бактериальной обсемененности (ОМЧ) и микробиоценоз воды приведены в таблице 1.
Таблица 1.
Исходные показатели ОМЧ и микробиоценоз воды рыбоводных прудов
|
№ п/п |
Наименования |
Микробиологические показатели |
||||
|
Общее количество бактерий, 106 кл /см2 (кл /мл) |
Количество сапрофитных бактерий, 103 кл /см2 (кл /мл) |
|||||
|
Норма |
Пробы |
Норма |
Пробы |
|||
|
1 |
1ЛВЗ7 |
1,1—3,0 |
1,8 |
5,1—10,0 |
5,7 |
|
|
2 |
2ПВЗ7 |
1,1—3,0 |
1,6 |
5,1—10,0 |
4,9 |
|
|
3 |
3ВКЗ6 |
1,1—3,0 |
1,45 |
5,1—10,0 |
5,6 |
|
В ходе исследований установлено, что качественный состав микробиоценоза поверхности рыб представлен 7 семействами (Pseudomonadaceae, Enterobacteriaceae, Micrococcaceae, Listeriaceae, Vibrionaceae, Bacillaceae, Neisseriaceae), 4 родами (Pseudomonas, Micrococcus, Bacillus, Listeria) (рисунок 3).
Микробный пейзаж воды и рыб был представлен микроорганизмами следующих таксонов: Pseudomonas — 10 %, семейство Enterobacteriacea (Citrobacter — 27 %, E.Coli — 1 %), кокковые формы — 10 %, Bacillus — 10 %, грибы — 9 %.

Рисунок 3. Микробный пейзаж воды и рыб
Во все периоды отбора проб преобладали представители семейства рода Pseudomonas. Максимальный коэффициент Симпсона (С), который составляет от 0,25 до 1 (таблица 2).
Таблица 2.
Показатель бактериальных таксонов по «коэффициенту Симпсона» (C) из 2-х мест отбора проб (А-анальное, Ж-жаберное, С-слизистое)
|
Таксон |
"Коэффициент Симпсона" |
||||||
|
Чилик |
Капчагай |
||||||
|
А |
Ж |
С |
А |
Ж |
С |
|
|
|
Род. Enterobacteriaceae |
– |
0,044 |
0,04 |
– |
0,003 |
0,028 |
|
|
Род Bacillus |
– |
– |
– |
0,11 |
– |
– |
|
|
Род Pseudomonas |
0,184 |
0,1 |
0,01 |
0,25 |
0,498 |
0,6 |
|
Таблица 3.
Характеристика микробного состава при различных технологиях выращивание рыб
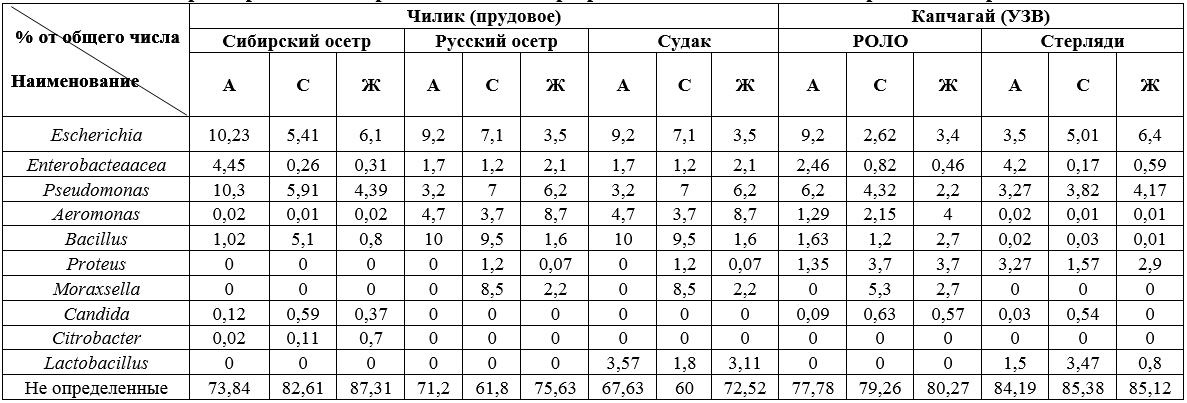
Примечание:
1 А — анальное отверстие рыб
2 С — слизистая поверхность рыб
3 Ж — жаберное отверстие рыб
4 РОЛО — Русский осетр + Ленский осетр
5 УЗВ — установки замкнутого водоснабжения
Сравнительные данные микробного пейзажа по 2 местам отбора проб были выбраны: Чилик прудовое выращивание, Капчагай бассейновое выращивание рыб.
Согласно полученным данным, при прудовом выращивании рыб наблюдаются повышенные показатели общего микробного числа, в особенности представителей таких родов как: Escherichia, Pseudomonas, Aeromonas, Bacillus, Citrobacter. Это можно связать с использованием артезианской воды и фильтрующих систем препятствующих накоплению органических загрязнений и более низкой температуры воды в системе.
В целом полученные результаты соответствуют тому, что известно в литературе. По данным ряда авторов в составе микрофлоры рыб часто встречаются условно-патогенные микроорганизмы, среди которых представители семейств Pseudomonadaceae (род Pseudomonas), Vibrionaceae (род Aeromonas) и Enterobacteriaceae. На коже и жабрах распространены бактерии родов Aeromonas, Pseudomonas, Citrobacter, Proteus, Enterobacter, Escherichia.
Выводы
Микробиоценотические сообщества входят в структурную цепь водных экосистем, выполняя важную роль в процессе самоочищения водоемов. Формирование, динамика развития бактериальных структур и их взаимоотношения с другими организмами (рыбой) способствуют изменению динамического равновесия в водоемах. Наши исследования в этой области соотносятся с работами отечественных и зарубежных авторов. Накопление большого количества органических веществ в воде приводит к росту бактериоценозов, изменению их качественных и количественных характеристик и формированию определенных групп бактерий. Микробные сообщества выступают чувствительными индикаторами состояния экосистем.
В ходе работы нами был изучен качественный состав аутомикрофлоры промысловых рыб, а так же общее количество микроорганизмов.
Исходя из полученных данных, мы считаем, что подобный видовой набор служит сигналом в экосистеме. Несмотря на то, что псевдомонады относятся к представителям нормальной микрофлоры рыб (Конев, 1996), при определенных условиях может послужить неблагоприятным сигналом.
Для индикации экологических последствий изменения характеристик пресноводных водоемов необходимо иметь сведения о качественном и количественном составе соответствующей микрофлоры и ее функциональной активности в среде обитания. Наряду с этим, актуальным остается изучение характера самоочистительной способности водоёмов для разработки мероприятий по предотвращению угрозы их локального эвтрофирования и изменения эпизоотического статуса.
Микробиологический мониторинг позволяет выявлять неблагополучные хозяйства, уделять больше внимания санитарному состоянию водоемов и чаще проводить обследования объектов воспроизводства, а также своевременно разрабатывать практические рекомендации по предупреждению заболеваний рыб.
Список литературы:
- Агентствo Республики Казахстан по статистике. Сельское, лесное и рыбное хозяйство Казахстана. Статистический сборник, 2011. [Электронный ресурс] — Режим доступа. — URL: http://www.stat.gov.kz
- Балакирев Е.И., Судакова Н.В., Кузьмина П.Н. Предварительные результаты по исследованию качественного и количественного состава микрофлоры кишечника русского осетра при использовании препаратов пробиотического действия. Астрахань.. 2006, 223—226 с.
- Зуевский С.Е., Запорожченко Н.С., Бычкова Л.И., Филиппова О.П. / Использование пробиотиков при выращивании личинок и молоди осетровых рыб в замкнутых установках на рыбоводных фермах в Республике Корея, ФГУП ВНИРО, 2008.
- Матишов Г.Г., Пономарёва Е.Н., Журавлёва Н.Г., Григорьев В.А., Лужняк В.А. Практическая аквакультура. Ростов-н/Д.: изд. ЮНЦ РАН, 2011, 284 с.
- Сидорова Н.А., Паршуков А.Н. Разнообразие условно-патогенной микрофлоры в рыбоводных хозяйствах Карелии. Хранение и переработка сельхозсырья. 2010. № 6., 14—16 с.
- Смаилов А.А. Сельское, лесное и рыбное хозяйство Казахстана. Статистический сборник . Астана., 2011. 214—219 с.
- Юхименко JI.H., Койдан Г.С. Современное состояние проблемы аэромоноза рыб. Сб. избран, трудов ВНИИПРХ: кн.1- Т. 1-й. — Дмитров. 2002. 467—468 с.
- Юхименко JI.H., Койдан Г.С. Современное состояние проблемы аэромоноза рыб. Сб. избран, трудов ВНИИПРХ: кн.1- Т. 1-й. — Дмитров. 2002. — 467—468 с.
- Sommerset I, Krossоy B, Biering E, Frost P. Vaccines for fish in aquaculture. Intervet Norbio AS Expert Rev Vaccines. 2005, Bergen, Norway. Feb № 4 (1): 89—101 р.
- Chaucheyras-Durand F, Durand H. Probiotics in animal nutrition and health. Lallemand Animal Nutrition, Blagnac, France 2010 Mar; 1(1): 3—9 р.
- Abdul Kader Mohideen M.M., T. Selva Mohan, S. Peer Mohamed and M.I. Zahir Hussain. Effect of Probiotic Bacteria on the Growth rate of Fresh Water Fish, Catla catla. International Journal of Biological Technology (2010):1(2): 113—117 р.
- Stuart B. Levy, M.D., Laura McMurry., Aquaculture also involved in antibiotic resistance at Tufts. Centre for Adaptation Genetics and Drug Resistance. Animal feed news journal, 28 Nov 2011.
- Jorge Olmos, Leonel Ochoa, Jesus Paniagua-Michel, and Rosalia Contreras. Functional Feed Assessment on Litopenaeus vannamei Using 100% Fish Meal Replacement by Soybean Meal. High Levels of Complex Carbohydrates and Bacillus Probiotic Strains. Mar Drugs., 2011., № 9 (6). — Published online 2011 June 17 — 119—1132 р.
- Bergey’s Manual of Determinative Bacteriyology. 9th Edition. 567—574 р.
дипломов


Оставить комментарий