Статья опубликована в рамках: XXII Международной научно-практической конференции «Инновации в науке» (Россия, г. Новосибирск, 15 июля 2013 г.)
Наука: Химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
КАТАЛИТИЧЕСКАЯ АКТИВНОСТЬ КОМПЛЕКСОВ CO(II) В РЕАКЦИЯХ С ПЕРОКСИДОМ ВОДОРОДА
Логинова Ольга Николаевна
канд. хим. наук, доцент кафедры физической и коллоидной химии Алтайского государственного университета, г. Барнаул.
E-mail: lon
Бедарева Вера Александровна
студент Алтайского государственного университета, г. Барнаул
THE CATALYTIC ACTIVITY OF COMPLEX IONS OF CO (II) IN THE REACTION OF HYDROGEN PEROXIDE
Loginova Olga
candidate of Science, assistant Professor of the Department of physical and colloid chemistry of Altai State University, Barnaul
Bedariova Vera
student Altai state University, Barnaul
АННОТАЦИЯ
Изучена каталитическая активность комплексных ионов Сo (II) в реакции разложения пероксида водорода. Установлено, что скорость исследуемой реакции существенным образом зависит от строения кислородсодержащего лиганда. Выдвинуто предположение, что изменение скорости указанной реакции связано с изменением скорости обмена лигандами в данном комплексном ионе и константами устойчивости комплекса.
ABSTRACT
The catalytic activity of complex ions of Co (II) in the reaction of hydrogen peroxide decomposition was investigated. It is found that the rate of the reaction significantly depends from the structure of the oxygen containing ligand. It is suggested that the change of rate of this reaction due to a change of the rate of ligands exchange in this complex ion and stability constants of the complex.
Ключевые слова: константы устойчивости, кинетика реакций, каталитическая активность.
Keywords: stability constants, the kinetics of the reactions, the catalytic activity.
Данная работа посвящена изучению влияния каталитической активности комплексов Co(II) на разложение пероксида водорода в водном растворе. Для количественного сравнения каталитическую активность определяли по скорости разложения пероксида водорода в одинаковых условиях (рН=12) для разбавленных растворов кислородсодержащих комплексов кобальта волюмометрическим методом (табл. 1). Константу скорости разложения (табл.2) вычисляли по уравнению первого порядка. Экспериментальные данные по кинетике разложения H2O2 различными комплексами Co(II) в соотношении металл: лиганд (1:1) представлены в табл. 1.
Таблица 1.
Кинетика разложения H2O2 в присутствии комплексов кобальта (II) при соотношении металл: лиганд (1:1); концентраця иона кобальта — 4,6×10-4 моль/л; концентрация пероксида водорода — 0,42 моль/л
|
Кислота |
Строение кислоты |
Катализатор |
Время от начала реакции, мин |
Объем O2, мл |
|
Щавелевая |
HOOCCOOH |
Оксалат кобальта (II) |
10 |
21 |
|
Малоновая |
HOOCCH2COOH |
Малонат кобальта (II) |
10 |
15,6 |
|
Янтарная |
HOOC(CH2)2COOH |
Cукцинат кобальта (II) |
10 |
11 |
|
Глутаровая |
HOOC(CH2)3COOH |
Глутарат кобальта (II) |
10 |
11,5 |
|
Винная |
HOOCCH(OH)CH(OH)COOH |
Тартрат кобальта (II) |
10 |
11,7 |
|
|
|
Гидроксид кобальта (II) |
10 |
26,6 |
Таблица 2.
Константы скорости разложения пероксида водорода и константы устойчивости [1] комплексов кобальта (II)
|
Название комплексов кобальта (II) |
k, мин-1 |
lg Kуст |
|
Гидроксид кобальта |
0,025 ± 0,005 |
1,80 |
|
Оксалат кобальта |
0,018 ± 0,005 |
1,27 |
|
Малонат кобальта |
0,014 ± 0,004 |
2,87 |
|
Сукцинат кобальта |
0,0097 ± 0,0005 |
4,16 |
|
Глутарат кобальта |
0,0092 ± 0,0004 |
4,34 |
|
Тартрат кобальта |
0,0091 ± 0,0004 |
4,25 |
В водном растворе лабильный ион Co (II) находится в виде гексааквокомплекса типа [M(H2O)6]n+ [2]. По данным Оргела Л. [3] в лабильных комплексах процесс обмена воды происходит через семикоординационный комплекс металл — ион, т. е. по схеме:
[M(H2O)6]n+ + H2O* = [MH2O* (H2O)6)]n+ = [MH2O* (H2O)5]n++ H2O,
в то время как для инертных комплексов свойственна другая схема:
[M(H2O)6]n+ = [M(H2O)5]n+ + H2O,[M(H2O)5]n+ + H2O* = [MH2O * (H2O)5]n+.
Понятно, что если переход шестикоординационного к пятикоординационному резко замедляет процесс обмена лигандов, то маловероятно наличие в растворе иона металла, несвязанного с лигандом (Mn+), и в растворе существует его аквакомплекс [M(H2O6)]n+ или другие координационные соединения. Проводя исследования при различных соотношении металл: лиганд, пришли к выводу, что наибольшей каталитической активностью обладает комплекс состава 1:1, а кислотный остаток карбоновой кислоты не оказывает каталитического действия на разложение пероксида водорода. Каталитическая активность комплекса связана с его строением. Комплексные соединения должны быть построены так, чтобы их молекулы имели «реакционное пространство», обеспечивающее образование промежуточных соединений. Поэтому наиболее благоприятной является структура комплекса, когда во внутренней сфере находится один лиганд двухосновной карбоновой кислоты. Именно этот механизм действия, насколько можно судить, объясняет наблюдаемые экспериментальные факты. В применении к реакции катализируемыми кислотами одного гомологического ряда справедливо уравнения Бренстеда:
kкат = G*Kдисα.
Распространяя соотношение Бренстеда на первые константы устойчивости комплексов кобальта (II) с органическими кислотами, предложили уравнение, связывающее константу скорости реакции с константой устойчивости соответствующего комплекса (таблица 2); т. к. реакция протекала в щелочной среде в корреляционное уравнение включили данные по гидроксиду кобальта.
kкат = G*Kустα lgkкат = lgG + αlgKуст .
Результаты расчетов представлены на рисунках 1,2.

Рисунок 1. Связь между константами скорости реакции разложения H2O2 и константы устойчивости комплексов Co (II) без учета гидроксида кобальта
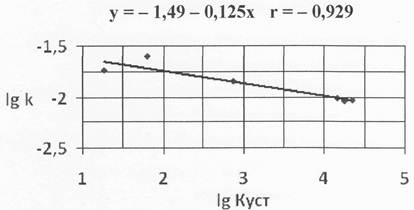
Рисунок 2. Связь между константами скорости реакции разложения H2O2 и константы устойчивости комплексов Co(II) с учетом гидроксида кобальта
Следует отметить хорошую корреляцию между константой скоростью разложения пероксида водорода и константами устойчивости комплексов.
Список литературы:
1.Лурье Ю.Ю. Справочник по аналитической химии. М.: Химия,1989. — 446 с.
2.Логинова О.Н., Шипунов Б.П., Сичкарёва О.Г., Сафронова Н.В. Влияние электромагнитного поля высокой частоты на кинетику разложения пероксида водорода при каталитическом воздействии ионов кобальта и меди // Известия АлтГУ, 2010. — № 3—1(67). — 163—166 с.
3.Оргел Л. Введение в химию переходных металлов. М.: Мир, 1964. — 102 с.
дипломов


Оставить комментарий