Статья опубликована в рамках: XXII Международной научно-практической конференции «Инновации в науке» (Россия, г. Новосибирск, 15 июля 2013 г.)
Наука: Химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
ТЕРМОДИНАМИЧЕСКОЕ ОПИСАНИЕ ИЗВЛЕЧЕНИЯ КАТИОНОВ РЗМ ИЗ ВОДНЫХ РАСТВОРОВ
Джевага Наталья Владимировна
канд. хим. наук, ассистент кафедры общей и физической химии Национального минерально-сырьевого университета «Горный», г. Санкт-Петербург
E-mail: dzhevaga331@mail.ru
Лобачева Ольга Леонидовна
канд. хим. наук, доцент кафедры общей и физической химии Национального минерально-сырьевого университета «Горный», г. Санкт-Петербург
THERMODYNAMIC SPECIFICATION REMOVING CATIONS OF REM FROM AQUEOUS SOLUTIONS
Dzhevaga Natalya Vladimirovna
candidate of chemical sciences, assistant of general and physical chemistry of National mineral resources university, Saint-Petersburg
Lobacheva Olga Leonidovna
candidate of chemical sciences, assistant Professor of general and physical chemistry of National mineral resources university, Saint-Petersburg
АННОТАЦИЯ
Целью работы было определение термодинамических параметров извлечения катионов гольмия из водных растворов его солей. На основе метода комбинированного кондуктометрического и потенциометрического титрования определены энергии Гиббса образования гидроксидов и гидроксокомплексов гольмия.
ABSTRACT
The purpose of the work was to determine the thermodynamic parameters of removing cations of holmium from water solutions of its salts. On the basis of the method of combined conductometric and potentiometric titration defined Gibbs energy of education hydroxides and hydroxocomplexes holmium.
Ключевые слова: ионная флотация, додецилсульфат натрия, редкоземельные элементы, извлечение, коэффициент распределения
Keywords: ion flotation, sodium dodecylsulfate, rare earth metals, removing, distribution coefficient.
В литературных источниках имеются различные взгляды на механизм протекания процесса ионной флотации. Форма извлекаемых в пену продуктов различна. Это могут быть средние соли, основные соли, гидроксиды [7]. В работе [1, с. 2007] установлено, что ионная флотация цветных металлов с применением анионных поверхностно-активных веществ протекает с образованием их основных солей. Из источника [3, с. 2012] известно, что при ионной флотации с поверхностно-активным веществом додецилсульфатом натрия (NaDS) редкоземельные металлы извлекаются в пену в виде смеси следующего состава: ![]() ,
, ![]() .
.
Определение энергий Гиббса образования гидроксидов редкоземельных элементов необходимо для расчета рН гидратообразования в водных растворах их солей [8]. На основе значений рН гидратообразования возможно прогнозирование условий извлечения и разделения катионов металлов методом ионной флотации, так как считается, что резкое возрастание степени извлечения происходит в области рН гидратообразования [4, с. 2243; 8].
Значения энергий Гиббса образования гидроксокатионов металлов в водных растворах позволяют рассчитать область значений рН, в которой протекает образование гидроксокомплексов. На этой основе возможны заключения о механизме протекания процесса ионной флотации.
Данные литературных источников по энергиям Гиббса образования гидроксидов и гидроксокомплексов лантаноидов имеют значительные расхождения (таблицы 1, 2).
Таблица 1.
Энергии Гиббса образования гидроксидов лантаноидов по данным литературы
|
Ln |
Eu |
Gd |
Tb |
Dy |
Ho |
|
[7] |
-1222,83 |
-1365,588 |
-1145,287 |
-1360,389 |
- |
|
[8] |
-1201,226 ± 4,602 |
-1284,739 ± 2,175 |
-1286,328 ± 2,175 |
-1280,722 ± 8,368 |
-1309,508 ± 2,384 |
|
[2] |
-1177 |
- |
- |
-1757 |
- |
|
[5] |
- 1180,6 |
- 1276,2 |
- 1281,1 |
- 1294,8 |
- 1297,4 |
Таблица 2.
Энергии Гиббса образования гидроксокомплексов лантаноидов из элементов ![]() по данным литературы
по данным литературы
|
Соединение |
|
[8] |
|
|
Eu(OH)2+ |
- 768,973 |
- 764,416±4,602 |
- 782,60±4,90 |
|
Gd(OH)2+ |
- 857,888 |
- 845,544±1,548 |
- 864,08±1,65 |
|
Tb(OH)2+ |
- 862,115 |
- 851,402±1,631 |
- 868,86±1,73 |
|
Dy(OH)2+ |
- 858,808 |
- 848,515±8,368 |
- 865,60±8,39 |
|
Ho(OH)2+ |
- 870,728 |
- 873,828±1,840 |
- 890,57±1,93 |
Неоднозначность литературных данных по термодинамическим характеристикам редкоземельных элементов предполагает уточнение величин энергий Гиббса образования гидроксидов и гидроксокомплексов лантаноидов.
Термодинамические характеристики (энергии Гиббса образования гидроксидов и гидроксокомплексов, рН гидратообразования и образования гидроксокомплексов) гидроксосоединений гольмия (III) были определены на основе метода комбинированного кондуктометрического и потенциометрического титрования раствором щелочи с последующим расчетом термодинамических величин.
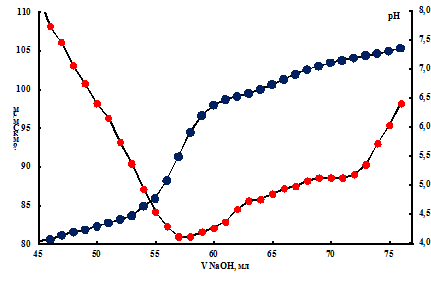
Рисунок 1. Зависимость удельной электропроводности и рН раствора Ho(NO3)3 от объема раствора NaOH
Энергию Гиббса образования гидроксида гольмия вычисляли по уравнению:
![]() (1)
(1)
Энергии Гиббса образования моногидроксокомплексов гольмия вычисляли по уравнению:
![]() (2)
(2)
В таблице 3 представлены энергии Гиббса образования ![]() и растворения
и растворения ![]() гиддроксидов гольмия (III), рН гидратообразования, энергии Гиббса образования моногидроксокомплексов из элементов
гиддроксидов гольмия (III), рН гидратообразования, энергии Гиббса образования моногидроксокомплексов из элементов ![]() и из ионов
и из ионов ![]() , а также значения рН1/2 комплексообразования.
, а также значения рН1/2 комплексообразования.
Таблица 3.
Результаты экспериментального определения термодинамических характеристик гидроксидов и гидроксокомплексов Ho
|
Соединение |
pН1/2 |
|
|
|
Ho(OH)2+ |
6,19±0,19 |
- 887,73±2,12 |
- 44,50±1,06 |
|
Соединение |
рНhydr |
|
|
|
Ho(OH)3 |
6,57±0,17 |
149,73±2,91 |
- 1307,64±3,44 |
По полученным экспериментальным данным значение энергии Гиббса образования гидроксида гольмия (III) — 1307,64 ± 3,44 кДж/моль в пределах погрешности определения согласуется с данными [8] — 1309,51 ± 2,38 кДж/моль.
Полученные значения энергий Гиббса комплексообразования на 7—11 кДж/моль ниже вычисленных по данным [7] и на 14—19 кДж/моль ниже соответствующих базе данных [8]. Следует отметить, что значения рН1/2 комплексообразования, рассчитанные по данным [8; 2, с. 231], равны соответственно 9,0 и 7,8 и противоречат меньшим величинам рН гидратообразования.
Согласно полученным в работе результатам, образование гидроксокомплексов гольмия (III) протекает при рН ниже рН гидратообразования и предшествует осаждению гидроксидов. Достоверность полученных значений обусловлена использованием низких концентраций и метода комбинированного потенциометрического и кондуктометрического титрования.
Список литературы:
1.Воронин Н.Н., Демидов В.Д., Черкасов А.Е. Пенная флотоэкстракция тяжелых металлов из растворов. ЖПХ. 1992. Т. 65. № 9. — С. 2005—2012.
2.Лидин Р.А., Андреева А.А., Молочко А.В. Справочник. Константы неорган. в-в. — М.: Изд. «Двора». 2006. — 285 с.
3.Чиркст Д.Э., Лобачева О.Л., Джевага Н.В. Термодинамика образования гидроксидов и гидроксокомплексов лантана и гольмия. ЖФХ. 2011. Т. 85. № 11. — С. 2011—2014.
4.Чиркст Д.Э., Лобачева О.Л., Берлинский И.В. Энергия Гиббса образования гидроксидов лантаноидов и иттрия. ЖФХ. 2010. Т. 84. № 12, — С. 2241—2244.
5.Электронный ресурс. База данных ТКВ. Параметры и определения Режим доступа. — URL: // http://www.chem.msu.su
6.Diakonov I.I., Ragnarsdottir K.V., Tegirov B.R. Standard thermodynamic properties and heat capacity equations of rare earth hydroxides: II. Ce(III)-, Pr-, Sm-, Eu(III)-, Gd-, Tb-, Dy-, Ho-, Er-, Tm-, Yb-, and Y-hydroxides. Comparison of thermochemical and solubility data. Chemical Geology. 1998. № 151 (1—4). — P. 327—347
7.Lobacheva O.L., Dzhevaga N.V., Chirkst D.E. Thermodynamics and ion flotation of lanthanides. Journal of materials science and engineering A 1. 2011. — P. 1—4.
8.HSC Chemistry Outo Kumpu Research OY (ver. 4.1.), Pori, Finland
дипломов


Оставить комментарий