Статья опубликована в рамках: XVII Международной научно-практической конференции «Инновации в науке» (Россия, г. Новосибирск, 25 февраля 2013 г.)
Наука: Медицина
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
ИЗМЕНЕНИЕ ФРАКЦИЙ ГЕМОГЛОБИНА В ЗАВИСИМОСТИ ОТ СТАДИИ КАНЦЕРОГЕНЕЗА
Садвакас Айман Садвакасовна
научный сотрудник Научно-образовательной лаборатории
Казахского Национального Медицинского Университета
им. С.Д. Асфендиярова,
г. Алматы
E-mail: aiman.sadvakas@gmail.com
CHANGE OF FRACTIONS OF HEMOGLOBIN DEPENDING ON A CARCENOGENESIS STAGE
Sadvakas Aiman
Research associate of Scientific and educational laboratory
of Kazakh National Medical University named after S. Asfendiyarov, Almaty
АННОТАЦИЯ
Целью работы было определение изменений спектра производных гемоглобина в зависимости от стадии протекания канцерогенеза у 50 онкологических больных. Проводился анализ крови на анализаторе газов и кислотно-щелочного состояния. В результате исследования были получены данные об изменении фракций гемоглобина в зависимости от стадии канцерогенеза. При I и II стадии канцерогенеза результатом ответа на тканевую гипоксию является снижение сродства гемоглобина к кислороду. В прогрессировании канцерогенеза происходят конформационные изменения в структуре гемоглобина с дисбалансом его фракций.
ABSTRACT
The purpose of work was definition of changes in a range of derivatives hemoglobin depending on a stage of course in carcinogenesis at 50 oncologic patients. The blood analysis was carried out on the analyzer of gases and an acid-base condition. As a result of research data were obtained on change of fractions in hemoglobin depending on a carcinogenesis stage. At I and the II stage of carcinogenesis result of the answer to a fabric hypoxia is decrease in affinity of hemoglobin to oxygen. There are conformational changes in hemoglobin structure to an imbalance of its fractions in progressing of carcinogenesis.
Ключевые слова: фракции гемоглобина; канцерогенез; перекисное окисление липидов; разобщение окислительного фосфорилирования; тканевая гипоксия; оксидативный стресс.
Keywords: hemoglobin fractions; carcinogenesis; peroxide oxidation of lipids; dissociation of oxidizing phosphorylation; fabric hypoxia; oxidative stress.
Важную роль в формировании физико-химических представлений о злокачественном росте сыграла гипотеза академика Н.М. Эммануэля о свободнорадикальной природе процессов в основе развития злокачественной опухоли (1977). В настоящий момент подробно изучены вопросы о состоянии перекисного окисления липидов (ПОЛ) и антиоксидантной системы в опухолевых и немалигнизированных тканях на различных моделях канцерогенеза. Работами Д.Б. Кормана, Е.Б. Бурлаковой, Л.А. Островской, Н.П. Пальминой (2008) было показано значение свободных радикалов не только на этапе канцерогенеза, но и при дальнейшем опухолевом росте, а также роль ПОЛ в качестве одного из механизмов, с помощью которого реализуется реакция организма на возникновение и развитие опухоли.
Свободные радикалы образуются как побочные продукты окислительного метаболизма вследствие одно-, двух- или трехэлектронного восстановления кислорода:
HbO2 + NO2- → MetHb + O22- + NO2
HbO2 + NO2• → MetHb + O2NOO-
O2NOO- + O22- → NO2 + 2O22-
O2- + NO2 → 1O2 + NO2
В свою очередь супероксидный ион-радикал (О2ˉ) и синглетный кислород (1О2) могут инициировать образование активных форм кислорода (АФК):
![]()
АФК, такие как синглетный кислород, супероксидный ион-радикал гидропероксидный радикал, гидроксил-радикал и перекись водорода более сильные окислители, чем молекулярный О2, поэтому их считают высокотоксическими продуктами, которые занимают ведущее место в патогенезе воспалительных процессов, канцерогенеза, а также ряда других заболеваний в механизме деструкции мембран через перекисное окисление липидов.
Перекиси липидов вызывают дестабилизацию мембран, в частности митохондрий и лизосом, что приводит к нарушению фосфорилирования. При этом аэробный путь образования аденозинтрифосфата (АТФ) в митохондриях становится ущербным, что подтверждается прогрессивным уменьшением содержания АТФ в тканях у животных со злокачественными новообразованиями (было показано в работах Морозкиной Т.С. 1979, 1989).
Выход в общий кровоток и распространение по всему организму АФК, продуктов ПОЛ, ингибиторов дыхания, изоферментов гексокиназы и других веществ, продуцируемых неоплазмой, с одной стороны и транспорт различных антиоксидантов, глюкозы, липидов, азотистых соединений в неоплазму — с другой, изменяют метаболизм в этих тканях по типу опухолевого. Одни факторы (антиоксиданты) в порядке защиты мобилизуются организмом для подавления опухолевого процесса, другие же (липиды, глюкоза, азотистые соединения) напротив, захватываются неоплазмой для поддержания своего роста.
Перестройка энергетики остается одним из универсальных изменений обмена опухолей разного гистогенеза и этиологии. Согласно известной концепции (Warburg, 1930, 1957), ослабление клеточного дыхания, разобщение окислительного фосфорилирования считаются первым этапом возникновения неоплазм. Главной особенностью набора дыхательных ферментов в опухолевых митохондриях является низкое содержание никотинамидадениндинуклеотида (НАД) в 3—4 раза ниже нормы, пониженное содержание цитохрома С, цитохрома А и цитохромоксидазы. Разобщение дыхания и фосфорилирования в процессе канцерогенеза приводит в первую очередь к энергетическому голоданию клетки и преобладанию процессов распада над процессами синтеза, к дедифференциации клетки, что является одним из важнейших проявлений малигнизации.
Активация свободнорадикального окисления, при котором органические вещества подвергаются неферментативному окислению молекулярным кислородом, приводит к возникновению тканевой гипоксии. При тканевой гипоксии присутствие множества митохондрий в эритроцитах несовместимо с функцией переноса этими клетками кислорода из-за неизбежной конкуренции за кислород между митохондриями и армадой молекул гемоглобина и, следовательно, нереализуемости в составе таких эритроцитов «гемоглобинового» механизма депонирования и транспорта кислорода. Нарушение механизма транспортировки и доставки гемоглобином кислорода к тканям отражается также на функциональной активности его производных. При этом каждая фракция гемоглобина изменяет свою специфику, адаптивная ценность которой разнообразна в зависимости от участия сосудистого русла тканей и микроусловий организма.
Специфическая функция гемоглобина как переносчика кислорода тесно связана с его молекулярной структурой. Гемоглобин состоит из белковой (глобин) и железосодержащей (гем) частей. На 1 молекулу глобина приходится 4 молекулы гема (рис. 1). Атом железа в геме координирован с четырьмя атомами азота пиррольных колец пропорфирина IX, а также с атомом азота имидазольного кольца остатка гистидина, входящего в состав полипептидных цепей глобиновой части гемоглобина. Эта координационная связь с гистидином называется «проксимальной» (приближенной). Другая (шестая) координационная связь называется «дистальной» (удаленной).
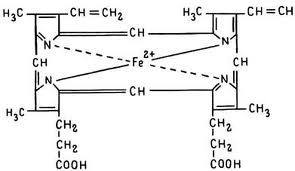
Рисунок 1. Одна молекула гемоглобина
По лигандам, присоединяемым именно по дистальной связи, различают формы гемоглобина. Если с ней координируется кислород, то такая форма гемоглобина называется оксигемоглобин (HbO2), а если она свободна, то это — дезоксигемоглобин (НHb). Кислород в HbO2 может заменяться другими нейтральными лигандами, такими как СO, NO и алкилизоцианидами. Эти формы соответственно называются — карбоксигемоглобин (HbСО), нитрозогемоглобин (Hb NO). Железо (II) в гемоглобине довольно быстро окисляется до трехвалентного (III) состояния — гемоглобин, который имеет такой гем называется метгемоглобин (MetHb). Эта форма почти не связывается с О2, СO, NO, но вместо этих лиганд с железом MetHb связываются CN-, SCN-, HS- и другие. Образованные формы, соответственно называются — метгемоглобинцианид (MetHbCN), метгемоглобинрозанид (MetHbSCN), метгемоглобинсульфид (MetHbHS).
При взаимодействии ионов NO2- с оксигемоглобином, последний переходит в окисленную форму. Однако образование Нb-NO комплексов в течение первых 1—3 часов не происходит. Была предложена гипотеза, согласно которой при взаимодействии гемоглобина с ионами NO2- происходит образование комплекса с перераспределением электронной плотности, осуществляемой таким образом, что оксигемоглобин переходит в квазиокисленное состояние. Предлагается два возможных направления по спонтанному и индуцированному окислению оксигемоглобина: к лигандсвязанному кислороду и к белку глобину. Причиной того, что нитритные ионы не могут акцептировать электрон с оксигемоглобина, по-видимому, является наличие связанного с гемом иона кислорода, который препятствует осуществлению контакта между донорской орбиталью гема и акцепторной орбиталью NO2-. Однако после диссоциации оксигемоглобина происходит распад NO2- и образование NO, который прочно связывается с гемоглобином. Уменьшение сродства гемоглобина к кислороду, например, при подкислении, приводит к более быстрому восстановлению NO2- в NO и, следовательно, способствует образованию прочных комплексов гемоглобин — NO. Все это снижает кислородтранспортную функцию гемоглобина.
Развитие неопластического процесса в организме носит системный характер, степень выраженности которого зависит от стадии опухолевого процесса. Поэтому данная работа посвящена изучению и выяснению состояния фракций гемоглобина при различных стадиях канцерогенеза у 50 онкологических больных, разделенных на 2 группы: 15 человек с I и II стадией, 35 человек — с III стадией. 1 группа включает больных с I и II стадией рака легких, желудка, предстательной железы, молочных желез и кожи; 2 группа — с III стадией рака легких, желудка, пищевода, тонкого и толстого кишечника, поджелудочной железы, печени, желчного протока, почки, надпочечника, мочевого пузыря, яичников, маточной трубы. У обследованных больных гистологически были определены следующие морфологические формы рака: аденокарцинома, внутри-протоковый рак, плоскоклеточный рак, базальноклеточный рак, хромофильный рак почки, гепатобластома, мезенхимальная хондросаркома, остеогенная саркома, медуллярный рак. У 15 больных с I и II стадией исследовалась капиллярная кровь на анализаторе газов Cobas B 221(Roche, Германия); у 35 больных анализировалась артериальная кровь на анализаторе газов крови ABL 800 Flex (Radiometer, Дания).
В таблице 1 представлены данные полученных результатов после статистической обработки.
Таблица 1.
|
Параметрыв исследованных группах с I и II стадией n = 15 с III стадией n = 35 |
Основные показатели |
|||
|
M ± m |
±σ |
t |
p |
|
|
1. Индекс сатурации - sO2 при I и II стадии при III стадии |
94,69±0,6 97,87±0,28 |
2,28 1,7 |
4,81 |
0,001 |
|
2. Оксигемоглобин -O2Hb при I и II стадии при III стадии |
91,62±0,56 95,38±0,29 |
2,12 1,74 |
5,96 |
0,001 |
|
3. Карбоксигемоглобин – COHb при I и II стадии при III стадии |
2,62±0,47 1,48±0,17 |
1,79 1,05 |
2,32 |
0,05 |
|
4. Дезоксигемоглобин –HHb при I и II стадии при III стадии |
5,14±0,64 2,08±0,27 |
2,4 1,6 |
4,43 |
0,001 |
|
5. Метилированный гемоглобин — MetHb при I и II стадии при III стадии |
0,56±0,016 0,994±0,047 |
0,06 0,28 |
8,85 |
0,001 |
|
6. Концентрация гемоглобина в эритроците – МСНС при I и II стадии при III стадии |
34,56±0,22 33,48±0,36 |
0,85 2,13 |
2,57 |
0,05 |
|
7. Гемоглобин HGB при I и II стадии при III стадии |
130±4,47 106,17±3,90 |
16,75 23,08 |
4,04 |
0,01 |
При проведении расчетов учитывался объем малой и большой выборки. Высчитывались следующие параметры: средняя арифметическая М по формуле M = ![]() для каждого ряда (где x — переменное значение), затем определялось среднее отклонение по формуле σ =
для каждого ряда (где x — переменное значение), затем определялось среднее отклонение по формуле σ = ![]() для выборки n = 15 и σ =
для выборки n = 15 и σ = ![]() для выборки n = 35. Затем определялась стандартная ошибка
для выборки n = 35. Затем определялась стандартная ошибка ![]() для выборки n = 15 и
для выборки n = 15 и ![]() для выборки n = 35. Затем высчитывался коэффициент t по формуле t =
для выборки n = 35. Затем высчитывался коэффициент t по формуле t = ![]() . По таблице значений коэффициентов Стьюдента t определялась доверительная вероятность р.
. По таблице значений коэффициентов Стьюдента t определялась доверительная вероятность р.
В результате исследования были получены достоверные данные, подтверждающие повреждение дыхательной функции гемоглобина в виде дисбаланса его фракций в зависимости от выраженности оксидативного стресса и стадии протекания канцерогенеза: при I и II стадии снижаются показатели оксигемоглобина O2Hb и индекса сатурации sO2 (показывающего степень насыщения крови кислородом), повышается содержание дезоксигемоглобина HHb; при III стадии повышаются показатели карбоксигемоглобина COHb, дезоксигемоглобина HHb и метгемоглобина MetHb. В начальных I и II стадиях канцерогенеза снижение сродства гемоглобина к кислороду говорит об образовании прочных комплексов гемоглобина с радикалом NO2. Образовавшийся комплекс перераспределяет электронную плотность так, что оксигемоглобин переходит в квазиокисленное состояние. Снижение оксигемоглобина O2Hb (окисленного) сопровождается повышением фракции дезоксигемоглобина HHb (восстановленного) согласно порядку окислительно-восстановительных реакций. Снижение концентрации гемоглобина в эритроците (МСНС) характеризует снижение кинетических параметров взаимодействия гемоглобина с кислородом. Указанные выше изменения при I и II стадии характеризуют развитие (возможно начальные стадии) оксидативного стресса в организме.
При III стадии канцерогенеза повышение метформы гемоглобина MetHb говорит о его интенсивном участии в процессе активации ПОЛ в связи с тем, метгемоглобинредуктазная система рассматривается как компонент антиокислительной системы эритроцитов. Восстановление метгемоглобина в физиологических условиях, при которых ежедневно окисляется около 3 % гемоглобина, практически полностью осуществляется НАДН-зависимой метгемоглобинредуктазой. Повышение концентрации MetHb говорит о том, что в качестве источника никотинамидадениндинуклеотида (НАДН) используется гликолитический процесс. Указанный механизм гликолитического процесса характеризует разобщение процессов окисления и фосфорилирования и выражает глубину оксидативного стресса.
Повышение MetHb характеризует состояние метгемоглобинемии, при которой не только часть гемов выключается из транспорта кислорода, но и оставшийся оксигемоглобин имеет искаженную гиперболическую кривую диссоциации и отдает тканям меньше кислорода. Повышение карбоксипроизводного гемоглобина COHb, не способного переносить кислород, усугубляет течение тканевой гипоксии. Полученные параметры при III стадии канцерогенеза характеризуют конформационные изменения в структуре гемоглобина в связи с глубокими нарушениями тканевого дыхания и изменениями в митохондриальном и микросомальном окислении.
В заключение можно сделать следующий вывод. Проведенные исследования позволяют рассматривать фракции гемоглобина как показатели развития оксидативного стресса при канцерогенезе и использовать их в виде новых критериев в диагностике начальных стадий рака.
Список литературы:
1. Барабой В.А., Сутковой Д.А. Окислительно-антиоксидантный гомеостаз в норме и патологии. Киев: Чернобыльинтеринформ, 1997. — 220 с.
2. Владимиров Ю.А., Арчаков А.И. Перекисное окисление липидов в биологических мембранах. М.: Наука, 1972. — 252 с.
3. Козлов Ю.П. Свободные радикалы и их роль в нормальных и патологических процессах. М.: Издательство МГУ , 1973. — 173 с.
4. Корман Д.Б., Бурлакова Е.Б., Островская Л.А., Пальмина Н.П. Химиотерапия сверхмалыми дозами противоопухолевых препаратов — новая стратегия лекарственного лечения злокачественных опухолей. Материалы конгресса XII Российского онкологического конгресса 18—20 ноября 2008 г. с. 107—109.
5. Лю Б.Н. Старение, возрастные патологии и канцерогенез. Алматы: КазПТУ, 2003. — 376 с.
6. Морозкина Т.С. Механизм избирательного радио и химиопротекторного действия антиоксидантного комплекса витаминов «АК» на нормальные ткани. Акт. вопросы молек. эволюции и биохимии: материалы республ. конф., посвященной 75 летию со дня основания каф. общей химии БГМУ / под ред. Е.В. Барковского. Минск: БГМУ, 2006. — с. 113—116.
дипломов


Оставить комментарий