Статья опубликована в рамках: XLV Международной научно-практической конференции «Инновации в науке» (Россия, г. Новосибирск, 27 мая 2015 г.)
Наука: Биология
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
Статья опубликована в рамках:
Выходные данные сборника:
ПОЛУЧЕНИЕ КАЛЛУСНЫХ КУЛЬТУР PULSATILLA TAURICA И ИХ ЦИТОЛОГИЧЕСКИЙ АНАЛИЗ
Сидякин Андрей Иванович
канд. биол. наук., ассистент кафедры ботаники и физиологии растений и биотехнологий Таврической академии ФГАОУ ВО Крымского федерального университета им. В. И. Вернадского, РФ, Республика Крым, г. Симферополь
E -mail: acid2302@mail.ru
Мустафаева Ульвие Юнусовна
студент 4-го курса кафедры органической и биологической химии Таврической академии ФГАОУ ВО Крымского федерального университета им. В.И. Вернадского, РФ, Республика Крым, г. Симферополь
E -mail: ulvie21_mustafaeva@mail.ru
OBTAINING CALLUS CULTURE OF PULSATILLA TAURICA AND THEIR CYTOLOGICAL ANALYSIS
Sidyakin Andrey
PhD, Assistant of the Department of Botany and Plant Physiology and Biotechnology of Taurida Academy Crimean Federal V. I. Vernadsky University, Russia, Republic of Crimea, Simferopol
Mustafayeva Ulvie
fourth-year student of the Department of Organic and Biological Chemistry of Taurida Academy Crimean Federal V.I. Vernadsky University, Russia, Republic of Crimea, Simferopol
Исследование выполнено при финансовой поддержке в рамках научного проекта № 14-44-01587 код Конкурса_р_юг_а.
АННОТАЦИЯ
Цель работы — исследование особенности получения каллусной культуры редкого растения Pulsatilla taurica и ее цитологический анализ. В работе использованы стандартные методы, принятые в работах по биотехнологии и культуре тканей растений. В результате исследований получены каллусные культуры редкого эндемичного растения Pulsatilla taurica. Проведеный цитоморфологический анализ, полученных каллусных культур свидетельствует о том, что в них могут накапливаться тритерпеновые сапонины. Это открывает возможности исследования химического состава данного редкого и охраняемого вида растений.
ABSTRACT
The aim is to study features of obtaining callus culture of rare plant Pulsatilla taurica and their cytological analysis. The standard methods adopted in biotechnology and plant tissue cultures were used. The callus cultures of rare endemic plant Pulsatilla taurica were obtained. Cytological analysis was established low degree of cytological heterogeneity obtained callus cultures. Cytological composition of these callus cultures indicates that they can accumulate triterpene saponins. It makes possible studying of chemical composition of the rare and endangered plant species.
Ключевые слова: культура каллусных тканей in vitro; Pulsatilla taurica.
Keywords: in vitro cell callus culture; Pulsatilla taurica.
Введение. В связи с ограниченностью природного растительного лекарственного сырья представляется перспективной разработка биотехнологических способов получения биологически активных веществ из биомассы культивируемых клеток in vitro. В последние десятилетия значительно увеличилось количество работ, направленных на оптимизацию условий получения и всестороннее исследование каллусных и суспензионных культур клеток растений, синтезирующих и накапливающих вещества вторичного метаболизма разнообразной химической природы, что открывает новые возможности для изучения особенностей химического состава как широко встречающихся, так и редких (исчезающих, находящихся под охраной) видов растений.
Гликозиды в качестве биологически активных соединений с широким спектром фармакологического действия вызывают интерес к изучению особенностей их накопления в клеточных культурах растений. Гликозиды были обнаружены в культивируемых in vitro тканях целого ряда видов. При этом удалось показать, что в каллусных и суспензионных культурах могут накапливаться гликозиды, аналогичные гликозидам интактных растений [2, 4, 6, 7, 9—11, 14]. Установленные факты дают основание предполагать, что гликозиды могут быть обнаружены в культивируемых клетках и других, не исследованных в этом отношении видов.
Растения рода Pulsatilla (прострел, сем. Ranunculaceae) по данным научной литературы содержат тритерпеновые сапонины, обладающие широким спектром фармакологического действия [13]. В Крыму произрастает сон-трава крымcкая (прострел крымский, Pulsatilla taurica Juz.) — растение, имеющее природоохранный статус, и запрещенное к сбору как редкое эндемичное растение, что обуславливает актуальность проведения исследований по получению каллусных культур данного вида с целью изучения его химического состава без нанесения ущерба природным популяциям.
В связи с этим целью настоящей работы являлось получение каллусных культур Pulsatilla taurica и их цитологический анализ.
Экспериментальная часть работы проводилась на базе кафедры ботаники и физиологии растений и биотехнологий Таврической академии ФГАОУ ВО Крымского федерального университета имени В.И. Вернадского и лаборатории биотехнологий ООО Крымбио в 2014 году.
Материалы и методы исследования. Сбор растительного материала производили с соблюдением принципов биологической этики. Для проведения исследований использовали экспланты вегетативных органов растений P. taurica (высечки листьев) из коллекции растений сем. Лютиковых Ботанического сада КФУ им. В.И. Вернадского и семена P. taurica, собранные в период полной зрелости (конец июня 2013 г.) популяции, локализованной на северном макросклоне горы Чатыр-Даг.
В качестве инициальных эксплантов использовали высечки листьев проростков и ювенильных растений, полученных в культуре in vitro из семян, и высечки листьев от растений в фазу плодоношения (май 2014) Ботанического сада КФУ.
При введении в культуру использовались стандартные методики, принятые в работах по биотехнологии [11]. Исходный материал ступенчато стерилизовали: 1 % KMnO4 (40 минут); 70 % этанол (1 минута) и 3 % H2O2 (5 минут). Экспланты после стерилизации помещали на поверхность модифицированных питательных сред Мурасиге и Скуга [12]. Для культивирования использовали пробирки (16×150 мм). В одну пробирку помещали, как правило, 1 эксплант. На каждый вариант питательной среды было высажено по 30 эксплантов определенного типа в трёхкратной повторности. Экспланты культивировали на свету или в темноте при температуре 20—240 С. Полученный первичный каллус переносили на свежие питательные среды и в дальнейшем культивировали при той же температуре, освещенности 5—10 тыс. люкс и 16-часовом фотопериоде или в темноте. Для субкультивирования использовали оптимальные для индукции каллусообразования среды. Цикл выращивания культур составлял 70—90 суток.
Цитоморфологический анализ полученных каллусных культур проводили на давленых препаратах после фиксации уксусным алкоголем (спирт-уксусная кислота 3:1), мацерированных в 1н соляной кислоте (выдерживали материал 10—40 минут при температуре 600С), окрашенных 0,5 % ацетокармином или 0,2 % метиленовым синим или раствором Люголя (на 300 мл дистилированной воды 2 г йодида калия (KI), 1 г кристаллического йода), по методикам, изложенным в работе Барыкиной и соавторов [1]. Полученные экспериментальные данные анализировали с применением общепринятых методов математической статистики.
Результаты и их обсуждение. Получение субкультур высших растений, несмотря на кажущуюся в некоторых случаях легкость — процесс сложный и многоэтапный. Он предполагает адаптацию клеток к резко изменившимся условиям существования и формирование новой биологической системы, в которой клетки, выполнявшие в организме лишь некоторые, определенные функции, приобретают свойства отдельных организмов, способных к автономному развитию. При этом в ряде случаев перед исследователями встает задача коррекции созданных условий культивирования, определение удачной системы, в которой полученные при дедифференциации специализированные клетки будут обладать способностью к неограниченному росту и видоспецифичному синтезу вторичных метаболитов [3].
В ходе проведения эксперимента нами было опробовано десять различных модификаций стандартной среды Мурасиге и Скуга (МС), характеризующихся различным уровнем содержания регуляторов роста с ауксиновым (2,4-дихлорфеноксиуксусная кислота (2,4-Д), α-нафтилуксусная кислота (НУК), индолил-3-уксусная кислота (ИУК), индолил-3-масляная кислота (ИМК)) и цитокининовым типом действия (6-бензиламинопурин (БАП)) (табл. 1).
Как показали проведенные исследования, индукция каллусогенеза и образование, а так же рост каллусной ткани на вводимых в культуру эксплантах отмечены только в двух вариантах модифицированных питательных сред Мурасиге и Скуга: на среде № 2, содержащей 0,1 мг/л 2,4-Д и 0,01 мл/л БАП, и на среде № 6, дополненной 3,0 мг/л 2,4-Д и 1,0 мг/л БАП. Во всех остальных вариантах питательных сред каллусообразования отмечено не было, что может быть связано с тем, что P. taurica является эфемероидным растением, отличающимся сравнительно коротким вегетационным периодом (с апреля по июнь). Следует так же отметить, что в основном образование каллуса проходило только на высечках листьев, полученных от проростков (сеянцев) растений из семян P. taurica в культуре in vitro.
Каллусные культуры (рис. 1.) характеризовались следующими морфологическими особенностями: медленный прирост каллуса (цикл роста в среднем составляет 75—90 суток). Каллус плотной структуры, слабо рыхлый, в первые недели светлоокрашенный, затем темневший, при культивировании на свету не зеленевший. При визуальном анализе признаки морфогенеза выявлены не были. Каллус отличался гомогенностью структуры и при пассировании на свежие среды сохранял невысокую скорость роста, плотную, гетерогенную структуру и по мере достижения стационарной фазы приобретал более темную окраску.
Таблица 1.
Влияние состава модификации питательной среды Мурасиге и Скуга на частоту каллусообразования в культуре in vitro P. taurica
|
Вариант |
Тип и концентрация фитогормонов, мг/л |
Частота каллусообразования, % |
||||
|
2,4-Д |
НУК |
ИУК |
ИМК |
БАП |
||
|
1 |
0 |
0 |
0 |
0 |
0 |
0 |
|
2 |
0,1 |
- |
- |
- |
0,01 |
1,11 |
|
3 |
- |
0,1 |
0 |
0 |
0 |
|
|
4 |
- |
- |
3,0 |
- |
1,0 |
0 |
|
5 |
- |
3,0 |
|
|
0 |
|
|
6 |
3,0 |
- |
- |
- |
3,33 |
|
|
7 |
4,0 |
- |
- |
- |
0 |
|
|
8 |
5,0 |
- |
- |
- |
0 |
|
|
9 |
6,0 |
- |
- |
- |
2,0 |
0 |
|
10 |
3,0 |
3,0 |
- |
- |
1,0 |
0 |
Для более полной характеристики полученных каллусных культур и определения направленности их цитодеффиренциации, пролиферации и морфогенеза проводили анализ цитологической структуры на давленых препаратах после их окрашивания ацетокармином.
Как показали проведенные исследования, каллусные культуры P. taurica состояли из двух основных типов клеток: меристематического типа (меристемоподобных) и паренхимного типа (паренхимоподобных). Клетки меристематического типа сравнительно мелкие, с невысоким ядерно-плазменным соотношением, часто с интенсивно окрашивавшимися ядерными красителями ядрами и плохо поддававшимися окраске клеточными оболочками (рис. 2.). Паренхимоподобные клетки — более крупные, с высоким ядерно-плазменным соотношением, часто с плохо окрашивавшимися ядрами, и хорошо прокрашивавшимися клеточными оболочками (рис. 2.).

Рисунок 1. Начальные этапы каллусообразования и морфология каллусов, полученных в культуре in vitro P. taurica: а — начальные этапы каллусообразования; б — внешний вид каллуса, полученного из высечек листьев сеянцев; в — морфология каллусной ткани первого пассажа (8 недель культивирования)
Как было показано ранее в наших работах [2; 8], направленность пролиферации каллусной культуры может быть описана по показателям цитоморфологической характеристики исследуемых культур, поэтому на препаратах, приготовленных из определенной навески каллуса определяли количественный состав клеточной популяции, характеризующий особенность цитологии каллусных культур: количество клеток меристематического и паренхимного типов. Среди последних подсчитывали количество клеток определенной формы и их процентное содержание от общего количества в популяции каллусных клеток.
При цитоморфологических исследованиях каллусных культур P. taurica среди паренхимных клеток в составе каллусов можно было выделить следующие морфологическое группы клеток: паренхимные каллусные клетки округлой формы, паренхимные, паренхимные каллусные клетки вытянутой и/или червеобразно-удлинненной формы, гигантские паренхимные каллусные клетки, клетки неправильной формы (специализация по форме клеток, рис. 3, а-г). Кроме указанных морфологических групп каллусных клеток нами выделена отдельная группа каллусных клеток, выполняющих запасающую функцию (специализация по функциональному назначению клеток, рис. 3, д — эпибласты). Клетки, свидетельствующие о начале морфогенеза или гистогенеза (гистологические элементы, напоминающие гистологические элементы ксилемы) не выявлены.
Согласно проведенным исследованиям каллусная культура P. taurica первого пассажа, выращивавшаяся на среде Мурасиге и Скуга в течение 8 недель, характеризовалась следующим цитоморфологическим составом: основную массу полученной каллусной ткани составляли округлые паренхимоподобные клетки (45,5 %), около 40 % в данном каллусе приходилось на долю клеток, выполняющих запасающую функцию. Значительную часть от состава клеточной популяции составляло количество вытянутых и червеобразных клеток (14,0 %), и в небольших количествах встречались гигантские клетки и клетки неправильной формы. Такая цитологическая (цитоморфологическа) картина характерна для каллусных культур представителей сем. Ranunculaceae первых пассажей [2], и свидетельствует как о низком уровне цитологическо гетерогенности полученной культуры тканей P. taurica, так и о возможности дальнейшего изучения ее химического состава (с целью обнаружения тритерпеновых сапонинов). В наших работах было показано, что общий уровень биосинтетической активности каллусов сопряжен с уровнем клеточной дифференциации каллуса, а наличие в клеточной популяции определенных количеств клеток-эпибластов является маркером жизнеспособности каллуса и его способности к биосинтезу тритерпеновых гликозидов [8].
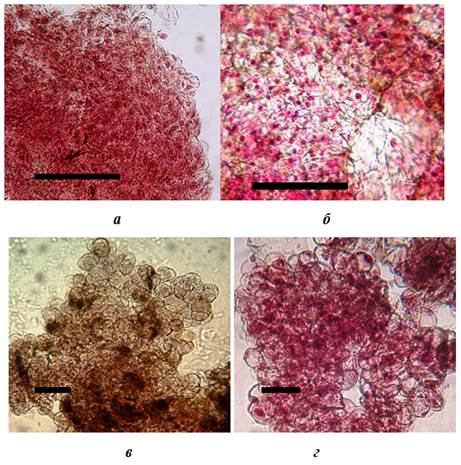
Рисунок 2. Основные типы клеток каллусных культур P. taurica : а — меристематический бугорок, состоящий из меристематичексих клеток (б); в , г — паренхимоподобные клетки (длинна масштабной линейки 100 мкм)
Заключение и выводы. Таким образом, в результате проведенных исследований морфогенетических потенций эксплантов и изучения индуцирующего действия состава питательных сред впервые определены условия получения жизнеспособных каллусов редкого эндемичного растения Крыма Pulsatilla taurica. Изложенные результаты исследований подтверждают ранее известные факты о возможности получении каллусных культур сапонинсодержащих растений, а проведенный цитоморфологический анализ

Рисунок 3. Основные морфологические группы паренхимных клеток каллусных культур P. taurica : а — округлые; б — вытянутые и червеобразные; в — гигантские; г — неправильной формы; д — запасающие клетки (эпибласты), после окрашивания раствором Люголя крахмал окрашен в красно-фиолетовый цвет (длинна масштабной линейки 100 мкм)

Рисунок 4. Цитоморфологическая характеристика каллусной культуры P. taurica (8 недель культивирования на питательной среде Мурасиге и Скуга, дополненной 3,0 мг/л 2,4-Д и 1,0 мг/л БАП)
полученной каллусной культуры свидетельствует о потенциальной возможности изучения состава тритерпеновых сапонинов данного редкого исчезающего растения на примере его культуры каллусной ткани. В дальнейшем планируется работа по исследованию химического состава каллусной культуры данного вида, что позволит расширить спектр исследований, вовлекая растения с природоохранным статусом без нанесения какого-либо ущерба природным популяциям и с соблюдением правил этики в биологических исследованиях.
Список литературы:
1.Барыкина Р.П. Справочник по ботанической микротехнике. Основы и методы / [Р.П. Барыкина, Т.Д. Веселова, А.Г. Девятов и др.]. М.: Изд-во МГУ, 2004. — 312 с.
2.Бугара А.М. Получение каллусных культур Ломоноса виноградолистного (Clematis vitalba L.) и их анализ на содержание тритерпеновых гликозидов / А.М. Бугара, С.И. Чмелева, А.И. Сидякин // Экосистемы Крыма, их оптимизация и охрана (тематич. сб. науч. тр.): [ред. колл. В.Г. Мишнев и др.]. – Симферополь, — 2006. — Вып. 16. — С. 36—41.
3.Бутенко Р.Г. Биология клеток высших растений in vitro и биотехнологии на их основе: учеб. пособие. / Р.Г. Бутенко М.: ФБК-ПРЕСС, 1999. — 160 с.
4.Васильева И.С. Стероидные гликозиды из культуры клеток диоскореи, их метаболизм и биологическая активность / И.С. Васильева, В.А. Пасешниченко // Успехи биологической химии. — 2000. — Т. 40. — С. 153—204.
5.Калинин Ф.Л. Методы культуры тканей в физиологии и биохимии растений / Ф.Л. Калинин, В.В. Сарнацкая, В.Е. Полищук. Киев: Наукова думка, 1980. — 488 с.
6.Карночук Р.А. Синтез сапонинов в культуре ткани Atrаgene sibirica L. / Р.А. Карночук, В.Ю. Дорофеев, И.В. Шимова и др. // 4-тый съезд общества физиологов растений России в рамках Международной конференции «Физиология растений — наука 3-го тысячелетия»: 4—9 октября 1999 г.: тез. докл. М., — 1999. — Т. 2. — С. 556.
7.Карпов П.А. Возможность использования культуры тканей Yucca macrocarpa Englem. для получения стероидных гликозидов / П.А. Карпов // Доп. Нац. АН України. — 2000. — № 9. — С. 180—185.
8.Сидякин А.И. Взаимосвязь между цитоморфологическими параметрами каллусных культур ломоноса виноградолистного и накоплением в них тритерпеновых гликозидов / А.И. Сидякин, А.М. Бугара, Л.М. Теплицкая, и др. // Actual problems of applied genetics, breeding and biotechnology of plants: november 3—6, 2009: abstr. Yalta, Ukraine. — C. 156.
9.Сидякин А.И. Использование математического планирования эксперимента при оптимизации питательных сред для культивирования каллусных тканей в культуре in vitro ломоноса виноградолистного / А.И. Сидякин // Материалы XXXIX научной конференции профессорско-преподавательского состава, аспирантов и студентов «Дни науки ТНУ им. В.И. Вернадского»: 20—23 апреля 2010 г., Симферополь: тез. докл. Симферополь: ДИАЙПИ, 2010. — С. 41—42.
10.Сидякин А.И. Оптимизация состава питательных сред для индукции каллусообразования в культуре in vitro вегетативных органов ломоноса виноградолистного / А.И. Сидякин, А.М. Бугара, О.Н. Белова // Ученые записки Таврического национального университета им. В.И. Вернадского. Серия «Биология, химия». — 2009. — Т. 22(61), — № 1. — С. 71—77.
11.Чайко А.Л. Культура клеток женьшеня японского Panax japoninicus (var. repens) C.A. Mey: получение каллусной и суспензионной культур, оптимизация роста и анализ панаксозидов / А.Л. Чайко, О.В. Решетняк, И.Е. Куличенко // Биотехнология. — 1999. — Т. 14, — № 6. — С. 51—55.
12.Murashige T.A revised medium for rapid growth and bioassays with tobacco tissue cultures / T. Murashige, F. Skoog // Phisiol. plant. — 1962. — Bd. 15, — № 13. — Р. 473—497.
13.Wei Li. Isolation of nematicidal triterpenoid saponins from Pulsatilla koreana root and their activities against Meloidogyne incognita / Wei Li, Ya Nan Sun, Xi Tao Yan // Molecules. — 2013. — V. 18, Is. № 5. — P. 5306—5316.
14.Zheng Yugou. Studies on the callus cultures of Ginkgo biloba L. and the identification of the ginkgolides / Yugou Zheng, Yu Rongmin, Yao Xinsheng et al. // Sheniang yao ke daxue xuebato = J. Sheyang. Pharm Univ. — 1999. — V. 16, — № 1. — P. 10—15.
дипломов


Оставить комментарий