Статья опубликована в рамках: XLV Международной научно-практической конференции «Инновации в науке» (Россия, г. Новосибирск, 27 мая 2015 г.)
Наука: Химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
Статья опубликована в рамках:
Выходные данные сборника:
РАСШИРЕНИЕ АССОРТИМЕНТА БИОАНТИОКСИДАНТОВ ИЗ ЧИСЛА ТРАДИЦИОННЫХ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ: ОСАЛМИД, ПАРАЦЕТАМОЛ, КАПОТЕН
Перевозкина Маргарита Геннадьевна
канд. хим. наук, доцент Государственного аграрного университета Северного Зауралья, РФ, г. Тюмень
EXPANSION OF ASSORTMENT OF BIOANTIOXIDANTS FROM NUMBER OF TRADITIONAL MEDICINAL PREPARATIONS : OSALMID, PARACETAMOL, CAPOTEN
Margarita Perevozkina
candidate of Chemical Sciences, associate Professor of State Agrarian University of Northern Trans-urals, Russia, Tyumen
АННОТАЦИЯ
Приведены результаты оценки антиоксидантной активности традиционных лекарственных препаратов: осалмида, парацетамола и капотена (каптоприла) в сравнении со стандартными антиоксидантами дибунолом и a-токоферолом в водно-липидных катализируемых субстратах. Установлено, что осалмид и парацетамол в процессе окисления способны эффективно уничтожать пероксидные радикалы. Показано, что осалмид, парацетамол и капотен в процессе окисления разрушают гидропероксиды с образованием молекулярных продуктов. Антиоксидантные свойства осалмида, парацетамола и капотена защищены патентами на изобретение.
ABSTRACT
The results of evaluation of the antioxidant activity of traditional medicines: osalmid, paracetamol and capoten (captopril) in comparison with standard antioxidants dibunol and a-tocopherol in water-catalyzed lipid substrates. It was established that osalmid and paracetamol in the oxidation process can effectively destroy peroxy radicals. It is shown that osalmid, paracetamol and capoten in the oxidation process will destroy the hydroperoxides with the formation of molecular products. The antioxidant properties of osalmid, paracetamol and capoten are protected by patents for invention.
Ключевые слова: антиоксиданты; a-токоферол; дибунол; осалмид; парацетамол; капотен (каптоприл).
Keywords: antioxidants; a-tocopherol; dibunol; osalmid; paracetamol; capoten (captopril).
Антиоксиданты (АО) нашли широкое практическое применение в химии и химической технологии, пищевой промышленности, фармации. В результате многочисленных исследований установлен свободнорадикальный механизм развития большинства патологий. Выявлен универсальный механизм регулирования интенсивности перекисного окисления липидов биомембран при помощи биоантиоксидантов [1; 2; 3; 4; 7]. В настоящее время малотоксичные ингибиторы процессов окисления используются в качестве радиозащитных и противоопухолевых препаратов, внедряются в антиоксидантотерапию при лечении многих патологий от воспалительных процессов до сердечно-сосудистых заболеваний, как адаптогены при стрессах и неблагоприятных воздействиях окружающей среды. Таким образом, антиоксиданты, присутствующие в лекарственном или косметическом препарате, являются не только действующим началом этих средств, но могут значительно тормозить их окисление в процессе длительного хранения, способствуя сохранению легкоокисляемых биологически активных компонентов в нативном состоянии.
Цель исследования — тестирование антиоксидантной активности ряда лекарственный препаратов при окислении водно-липидных катализируемых субстратов в сравнении со стандартными антиоксидантами: дибунолом и a-токоферолом.
Материалы и методы
Антиоксидантную активность (АОА) изучали манометрическим методом поглощения кислорода в модифицированной установке типа Варбурга при окислении этилолеата (ЭО), метиллинолеата (МЛ) в присутствии поверхностно-активного вещества (ПАВ) 1×10-3 М цетилтриметиламмоний бромида (ЦТМАБ) с добавками 2×10-3 М хлорида меди (II) в пробе при t=(60±0,2)0С. Соотношение липидов и воды составляло 1: 3, а общий объем пробы 4 мл. Разработанная нами кинетическая модель тестирования антиоксидантов, подбор концентраций катализатора и ПАВ описывается в работе [5]. В качестве критериев оценки антиоксидантных свойств соединений использовали – периоды индукции (t), начальные и максимальные скорости окисления (Wнач., Wmax.). Скорость инициирования определяли уравнением Wi=f[InH]/ti, где f — стехиометрический коэффициент ингибирования, [InH] — концентрация ингибитора (дибунола), ti — период индукции. Антирадикальную активность (АРА) соединений тестировали в системе инициированного окисления этилбензола хемилюминесцентным методом (ХЛ) по известной методике [8]. Окисление инициировалось АИБН при t=(60±0,2)0С, Wi=2,3×10-8 М×с-1 [6]. Кинетику накопления гидропероксидов изучали при аутоокислении линолевой кислоты (ЛК) и метилолеата (МО) методом обратного йодометрического титрования в среде хлорбензола, t=(60±0,2) 0С.
Результаты и их обсуждение
В настоящем работе приведены результаты исследования кинетики каталитического окисления липидных субстратов в водно-липидной среде в присутствии традиционных лекарственных препаратов в зависимости от структуры, без учета спектра их фармакологического действия.
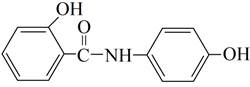
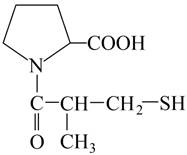
Парацетамол используется в медицинской практике как противовоспалительное, жаропонижающее и обезболивающее средство. Осалмид применяется как желчегонное средство. Капотен (каптоприл) применяют при лечении легкой и умеренной гипертонии, а также при тяжелых формах сердечно-сосудистых заболеваний. Формулы изучаемых соединений представлены в таблице 1.
Таблица 1.
Химические формулы изучаемых антиоксидантов
|
Название АО |
Формула |
|
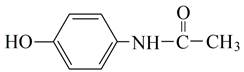
Парацетамол (N-(4-гидроксифенил)ацетамид) |
|
|
Осалмид (2-гидрокси-N-(4-гидроксифенил)бензамид) |
|
|
Капотен (каптоприл) (1-[(2S)-3-меркапто-2-метилпропионил]-L-пролин) |
|
|
a-Токоферол (2,5,7,8-тетраметил-2-(4,8,12-триметилтридецил)хроман-6-ол) |
|
|
Дибунол (1-гидрокси-2,6-ди-трет-бутил-4-метилбензол) |
|
АРА соединений тестировали в системе инициированного окисления этилбензола хемилюминесцентным методом по величине константы скорости реакции k7 с пероксидными радикалами [8]. RO2·+InH ![]() ROOH + In·, где InH — ингибитор окисления, In• — радикал ингибитора, RO2• — пероксидный радикал. Стехиометрический фактор ингибирования f, показывающий количество свободных радикалов, гибнущих на одной молекуле АО, для большинства изучаемых соединений был близок 2 (табл. 2). Наибольшую активность в реакции с пероксидными радикалами проявлял осалмид, константа скорости реакции k7 которого обусловлена акцепторным характером заместителя в пара-положении, p-р-сопряжением электронной плотности двух фенольных колец и амидной группы. Показано, что все исследуемые ингибиторы окисления уступают в АРА основному природному АО a-токоферолу.
ROOH + In·, где InH — ингибитор окисления, In• — радикал ингибитора, RO2• — пероксидный радикал. Стехиометрический фактор ингибирования f, показывающий количество свободных радикалов, гибнущих на одной молекуле АО, для большинства изучаемых соединений был близок 2 (табл. 2). Наибольшую активность в реакции с пероксидными радикалами проявлял осалмид, константа скорости реакции k7 которого обусловлена акцепторным характером заместителя в пара-положении, p-р-сопряжением электронной плотности двух фенольных колец и амидной группы. Показано, что все исследуемые ингибиторы окисления уступают в АРА основному природному АО a-токоферолу.
Таблица 2.
Значения константы скорости реакции антиоксидантов с пероксидными радикалами RO2●, Wi=2,3×10-8 М×с-1; САО= 1´10-3 М; t=600 С
|
Название АО |
K7´104, М-1´с-1 |
f |
|
Парацетамол |
4,00 |
2,4 |
|
Осалмид |
6,86 |
2,4 |
|
a-Токоферол |
360 |
2,0 |
|
Дибунол |
1,40 |
2,0 |
Процесс окисления является сложным и многостадийным, поэтому АОА соединений оценивали манометрическим методом по величине периодов индукции каталитического окисления этилолеата в широком диапазоне концентраций (1´10-6 – 1´10-1 М).
В присутствии катализатора известны следующие реакции зарождения и разветвления цепей:
Me(n +1)+ + RH + O2 ![]() Men+ + RO2● + H+
Men+ + RO2● + H+
RH + Cu 2+ ![]() R● + Cu1+ + H+
R● + Cu1+ + H+
ROOH + Cu 2+ ![]() RO2● + H+ + Cu1+
RO2● + H+ + Cu1+
ROOH + Cu 1+ ![]() RO● + OH- + Cu2+
RO● + OH- + Cu2+
Осалмид проявлял высокую антиоксидантную активность по сравнению с парацетамолом в соизмеримых концентрациях. На рис. 1 показаны типичные кинетические кривые (КК) окисления этилолеата в водно-липидной среде в присутствии осалмида: наблюдался период индукции, период аутоускорения и достижение максимальной скорости окисления.
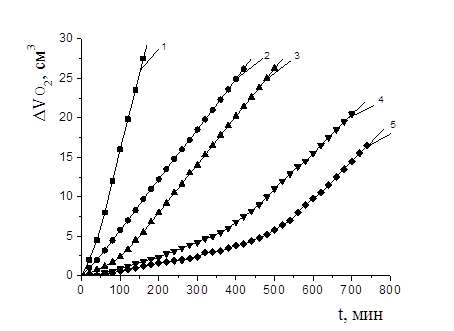
Рисунок 1. Кинетика окисления ЭО в водно-липидной среде в присутствии добавок осалмида, М: 1 — контроль, 2 — 1×10-4, 3 — 5×10-4, 4 — 1×10-3, 5 — 1×10-2; 2×10-3 М CuCl2, 1×10-3 М ЦТМАБ, t=600 С
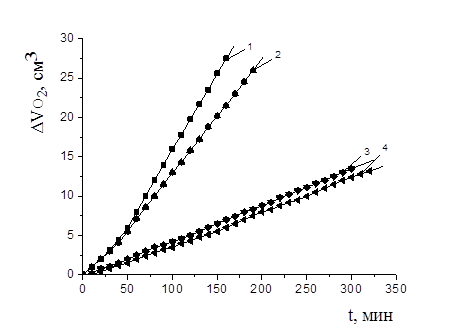
Рисунок 2. Кинетика окисления ЭО в водно-липидной среде в присутствии добавок парацетамола, М: 1 — контроль, 2 — 1×10-4, 3 — 1×10-3,4 — 1×10-2; 2×10-3 М CuCl2, 1×10-3 М ЦТМАБ, t=600 С
Установлено, что все исследуемые концентрации осалмида уменьшали начальную и максимальную скорости окисления в 2—5 раз по сравнению с контролем (табл. 3). КК окисления этилолеата с добавками парацетамола представлены на рис. 2. В изученном диапазоне концентраций парацетамола отсутствовал период полного торможения, но отмечалось снижение начальной и максимальной скоростей окисления по сравнению с контролем в 3—5 раз (табл. 3). КК парацетамола характеризуют подавление антиоксидантных свойств фенольного гидроксила за счет образование хелатных комплексов с катионами меди (II) и проявление ингибирующего эффекта только за счет свободной амидной группы.
Таблица 3.
Кинетические параметры окисления ЭО в водно-липидной среде в присутствии АО; 2×10-3 М CuCl2, 1×10-3 М ЦТМАБ, Wi =6,7×10-5 М×с-1, С (АО)=1×10-3 М, t=600С
|
Название АО |
ti , мин. |
Wнач.×10-5, М×с-1 |
Wmax .×10-5, М×с-1 |
Wmax . ЭO / Wmax . AO |
|
Контроль ЭО |
15 |
7,5 |
14,0 |
- |
|
Парацетамол |
40 |
2,5 |
3,1 |
4,5 |
|
Осалмид |
350 |
0,6 |
2,7 |
5,2 |
|
a-Токоферол |
45 |
4,3 |
16,8 |
0,8 |
|
Дибунол |
600 |
1,0 |
8,0 |
1,8 |
На рис. 3 приведены КК каталитического окисления метиллинолеата в водно-липидной среде в присутствии (1×10-6—1×10-1) М капотена. Показано, что все добавки соединения тормозили процесс окисления, степень и характер влияния зависели от концентрации. Низкие концентрации капотена (1×10-6—1×10-3) М пропорционально уменьшали начальную и максимальную скорости процесса. При концентрациях 1×10-3 М и выше происходило торможение начальных стадий процесса, увеличение периода индукции и достижение максимальной скорости процесса после выхода из периода индукции (табл. 4).

Рисунок 3. Кинетика окисления МЛ в водно-липидной среде в присутствии добавок капотена: 1 — контроль; 2 — 1×10-6 М; 3 — 1×10-5 М; 4 — 1×10-4 М; 5 — 1×10-3 М; 6 — 1×10-2 М; 7 — 1×10-1 М; 2×10-3 М CuCl2, 1×10-3 М ЦТМАБ, t=600 С
Снижение скорости окисления под влиянием капотена может быть обусловлено его конкурентным участием с катализатором в молекулярном распаде гидропероксидов:
ROOH + R 1SH ![]() M
M
ROOH + Cu2+ ![]() RO2· + H+ + Cu1+
RO2· + H+ + Cu1+
Торможение процесса окисления с последующим достижением максимальной скорости начиналось при соотношениях катализатора и капотена 1:1 и усиливалось при соотношениях 1:5 и 1:50. Очевидно, что в этих условиях происходит нейтрализация катализатора за счет его восстановления в Cu1+. При большом избытке капотена восстановление Cu2+ в Cu1+ происходит быстрее, наблюдается эффективное торможение процесса окисления:
R 1SH + Cu2+ ![]() R1S· + H+ + Cu1+
R1S· + H+ + Cu1+
Таблица 4.
Кинетические параметры окисления МЛ в водно-липидной среде в зависимости от концентрации капотена и стандартных антиоксидантов; 2×10-3 М CuCl2, 1×10-3 М ЦТМАБ, Wi =1,9×10-5 М×с-1, t=600 С
|
С( АО), М |
t, мин. |
Wнач.×10-5, М×с-1 |
Wmax .×10-4, М×с-1 |
[CuCl2] / [АО] |
|
Контроль МЛ |
5 |
14,4 |
2,6 |
- |
|
Капотен |
||||
|
1×10-6 |
8 |
7,6 |
1,6 |
2000 : 1 |
|
1×10-5 |
15 |
6,9 |
1,0 |
200 : 1 |
|
1×10-4 |
26 |
6,2 |
1,6 |
20 : 1 |
|
1×10-3 |
45 |
3,6 |
1,7 |
2 : 1 |
|
1×10-2 |
95 |
2,1 |
1,7 |
1 : 5 |
|
1×10-1 |
395 |
0,6 |
1,7 |
1 : 50 |
|
a-Токоферол |
||||
|
1×10-3 |
15 |
14,6 |
3,2 |
2 : 1 |
|
Дибунол |
||||
|
1×10-3 |
590 |
1,9 |
1,5 |
2 : 1 |
Для осалмида, капотена и дибунола наблюдалась положительная корреляционная связь между концентрацией и величиной ингибирующего эффекта. Анализ КК окисления этилолеата в водно-липидной катализируемой среде с добавками АО показал существенные отличия механизма действия a-токоферола от дибунола в зависимости от концентрации. Дибунол проявлял себя как сильный ингибитор: наблюдался период полного торможения, период аутоускорения и достижение максимальной скорости окисления. Установлено, что при каталитическом окислении водно-липидных субстратов с добавками a-токоферола свыше 1×10-3 М наблюдалась инверсия антиоксидантного действия, при этом увеличивалась максимальная скорость окисления (табл. 3, 4).

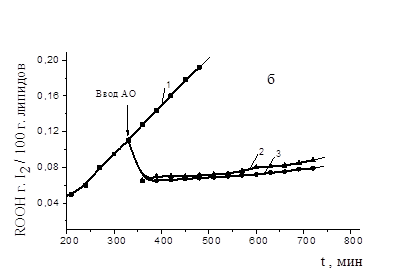
Рисунок 4. Кинетика накопления гидропероксидов при аутоокислении МО (а) и ЛК (б) в присутствии АО: 1 — контроль, 2 — капотен (а), осалмид (б), 3 — парацетамол. Стрелкой показан ввод АО. С (АО) = 2´ 10-4M, t=600 C
Причиной ускорения процесса могло быть комплексообразование OH-группы a-токоферола с катионами меди (II). В процессе окисления a-токоферол образует достаточно активные токофероксильные радикалы (In·) [2], способные участвовать в побочных реакциях продолжения цепей с молекулами субстрата:
RO 2· + InH ![]() ROOH + In·
ROOH + In·
In · + RH ![]() R· + InH
R· + InH
Были проведены эксперименты по прямому тестированию кинетики накопления гидропероксидов (ROOH) с введением в частично окисленный липидный субстрат каждого из исследуемых АО (время эксперимента 8 часов). Результаты представлены на рис. 4.
После ввода АО в течение первого часа наблюдалось снижение концентрации гидропероксидов практически до исходного уровня, в контрольном опыте гидропероксиды продолжали накапливаться. Можно полагать, что разрушение гидропероксидов происходит нерадикальным путем, поскольку вторичного инициирования процесса не наблюдалось. Установлено, что АО способствовали разрушению гидропероксидов на 50—75 %. Такой механизм действия характерен для серосодержащих соединений, аминов и амидов:
InH + ROOH ![]() M
M
Таким образом, различные фрагменты молекул исследуемых биоантиоксидантов действуют на процесс окисления по разным механизмам: фенольные гидроксилы уничтожают пероксидные радикалы, а амидные и тиольные группы разрушают гидропероксиды без образования свободных радикалов.
Выводы:
1. Установлено, что осалмид и парацетамол в процессе окисления способны эффективно уничтожать пероксидные радикалы.
2. Показано участие осалмида, парацетамола и капотена в процессе разрушения гидропероксидов молекулярным путем.
3. Установлено, что при каталитическом окислении водно-липидных субстратов с добавками a-токоферола свыше 1×10-3 М наблюдалась инверсия антиоксидантного действия, при этом увеличивалась максимальная скорость окисления.
4. Антиоксидантные свойства осалмида, парацетамола и капотена (каптоприла) защищены патентами на изобретение: RU 2545652 C1, 10.04.2015 Бюл. № 10; RU 2547421 C1, 10.04.2015 Бюл. № 10; RU 2544967 C1, 20.03.2015 Бюл. № 8. Изобретения относятся к получению состава, стабилизирующего процесс окисления липидов, липидосодержащих пищевых добавок, лечебно-косметических средств, лекарственных препаратов. Изобретения направлены на расширение ассортимента эффективных синтетических антиоксидантов, достижение высоких эффектов ингибирования при меньших концентрациях соединений.
Список литературы:
1.Арчаков А.И. Микросомальное окисление. М.: Наука, 1975. — 326 с.
2.Бурлакова Е.Б., Крашаков С.А., Храпова Н.Г. Роль токоферолов в пероксидном окислении липидов биомембран // Биологические мембраны. — 1998. — Т. 15, — № 2. — С. 137—167.
3.Губский Ю.А. Регуляция перекисного окисления липидов в биологических мембранах // Биохимия животных и человека. — 1978. — № 2. — С. 72—76.
4.Меньщикова Е.Б., Ланкин В.З., Кандалинцева Н.В. Фенольные антиоксиданты в биологии и медицине. Строение, свойства, механизмы действия. Saarbrücken. Deutschland: LAP LAMBERT Academic Publishing, 2012. — 488 с.
5.Перевозкина М.Г. Мицеллярное окисление липидов в присутствии солей металлов переменной валентности // Фундаментальные исследования. — 2014. — № 12 (8). — С. 1656—1662.
6.Перевозкина М.Г. Тестирование антиоксидантной активности полифункциональных соединений кинетическими методами. Монография. Новосибирск: Изд. СибАК, 2014. — 240 c.
7.Храпова Н.Г. Перекисное окисление липидов и системы, регулирующие его интенсивность // Биохимия липидов и их роль в обмене веществ. М.: Наука, 1981. — С. 147—154.
8.Шляпинтох В.Я., Капухин О.Н., Постников Л.М. и др. Хемилюминесцентные методы исследования медленных химических процессов. М.: Наука, 1966. — 300 с.
дипломов




Оставить комментарий