Статья опубликована в рамках: XLI Международной научно-практической конференции «Инновации в науке» (Россия, г. Новосибирск, 28 января 2015 г.)
Наука: Химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
Статья опубликована в рамках:
Выходные данные сборника:
ИССЛЕДОВАНИЕ КИНЕТИКИ ЖИДКОФАЗНОГО ФОРМИЛИРОВАНИЯ ГИДРАЗИДА ИЗОНИКОТИНОВОЙ КИСЛОТЫ
Джумадуллаева Света Абсадыковна
канд. хим. наук, доцент Международного казахско-турецкого университета имени А. Ясави, Республика Казахстан, г. Туркестан
E -mail: jumadullaeva_00@mail.ru
Суиндик Назерке Манасовна
студент Международного казахско-турецкого университета имени А. Ясави, Республика Казахстан, г. Туркестан
INVESTIGATION KINETICS OF LIQUID-PHASE FORMYLATION OF ISONICOTINIC ACID HYDRAZIDE
Dzhumadullaeva Sveta
candidate of chemical sciences, associate professor of Ahmet Yesevi International Kazakh Turkish University, Republic of Kazakhstan, Turkestan
Suindik Nazerke
student of Ahmet Yesevi International Kazakh Turkish University, Republic of Kazakhstan, Turkestan
АННОТАЦИЯ
Целью данной работы является изучение кинетики жидкофазного формилирования гидразида изоникотиновой кислоты в присутствии анионита АВ-17-8 (ОН). Показано, что реакция имеет первый порядок по гидразиду и формальдегиду. В интервале температур 343—363 К энергия активации процесса, найденная из аррениусовской зависимости равна 10,4 кДж/моль. На основании кинетических данных предложен вероятный механизм процесса.
ABSTRACT
The aim of this work is the study of the kinetics of liquid-phase formylation of isonicotinic acid hydrazide in the presence of the anion exchanger AV-17-8 (OH). It has been shown that the reaction is first order in hydrazide and formaldehyde. In the temperature range 343—363 K activation energy found from Arrhenius dependence is 10,4 kJ / mol. On the basis of kinetic data suggested a probable mechanism of the process.
Ключевые слова: гидразины; формилирование гидразида, формальдегид; кинетика; порядок реакции; механизм.
Keywords: hydrazine; formylation of hydrazide; formaldehyde; kinetics; reaction order; the mechanism
Замещенные органические гидразины находят широкое применение в самых различных областях народного хозяйства, в качестве физиологически активных веществ, мономеров и полупродуктов, регуляторов роста растений [2, с. 343]. Так, например, 1,1-метилен-бис-изоникониоилгидразин — метазид является важнейшим противотуберкулезным препаратом [4, с. 186].
Замещенные гидразины синтезируют из соответствующих кислот и их производных, получаемых главным образом жидкофазным окислением углеводородного сырья перманганатом калия или азотной кислотой. Существующая технология производства 1,1-метилен-бис-изоникотиноил-гидразина [4, с.186], базируется на шестистадийном процессе:
4-PyCH3 → 4-PyC(CH2OH)3 → 4-PyCOOH → 4-PyCOCl → 4-PyCOOC2H5 →
4-PyCONHNH2 → 4-PyCONHNHCH2NHNHCOPy
4-Пиколиновую фракцию превращают в смесь метилольных производных, затем окисляют азотной кислотой, полученную изоникотиновую кислоту с помощью тионилхлорида переводят в хлорангидрид, путем алкоголиза переходят к сложному эфиру; взаимодействием последнего с гидразингидратом получают гидразид изоникотиновой кислоты (ГИНК), осуществляя его формилирование получают 1,1-метилен-бис-изоникотиноилгидразин.
Более перспективным представляется сопряженный гидразинолиз 4-PyCN до 1,1-метилен-бис-изоникотиноилгидразина в присутствии ионитного катали-затора АВ-17-8(ОН).
4-PyCN + СН2О + N2Н4·Н2О → 4 –PyCONHNHCH2NHNHCOPy
Если допустить, что ГИНК является промежуточным продуктом при сопряженном гидразинолизе 4-цианпиридина до 1,1-метилен-бис-изонико-тиноилгидразина, то суммарный процесс можно представить следующей схемой последовательных реакций:
4-PyCH3 → 4-PyCONHNH2 → 4-PyCONHNHCH2NHNHCOPy
Кинетика гидразинолиза 4-PyCN до образования ГИНК ранее была исследована [1, с. 64], поэтому представлялось необходимым исследовать кинетику формилирования ГИНК до образования 1,1-метилен-бис-изонико-тиноилгидразина в присутствии анионита АВ-17-8(ОН).
В термостатированный при 90 ºС стеклянный реактор объемом 250 см3, снабженный механической мешалкой, термометром и обратным холодильником вносили 1,0—1,5 г (0,58—1,03 моль) гидразида изоникотиновой кислоты, 1,5—2,5 г (4,90—8,32 моль) формальдегида, 4,82 г воды и 2 г анионита АВ-17-8(ОН). Через каждые 10 минут отбирали пробы и анализировали фотоколориметрическим методом [3, с. 152].
В изученных условиях основным продуктом взаимодействия гидразида изоникотиновой кислоты с формальдегидом был 1,1-метилен-бис-изоникоти-ноилгидразин. За скоростью реакции следили по накоплению 1,1-метилен-бис-изоникотиноилгидразина в реакционной смеси. Изучение влияния температуры на ход процесса проводили в интервале 343—363 К, начальные концентрации гидразида (С ºГИНК) и формальдегида (Сº Ф-Д) изменяли в интервале 0,58-1,03 и 4,9—8,32 моль/л соответственно.
Наблюдаемые константы скорости реакции рассчитывали по кинетическому уравнению второго порядка [5, с. 87] по формуле:
![]()
где: a и b — начальные концентрации гидразида и формальдегида;
х — текущая концентрация продукта реакции (С ИГ);
k — константа скорости реакции.
Энергия активации (Еа) найдена по графику зависимости lg k от величины обратной абсолютной температуры (тангенс угла наклона этой прямой численно равен Еа ) [5, с. 101].
ИК-спектры исходных веществ и продукта реакции снимали на спектрометре "Jasco" IR-810 (Япония).
На рис. 1 приведены кинетические кривые формилирования ГИНК, полученные при различных начальных концентрациях гидразида 0,58; 0,72 и 1,03 моль/л. Экспериментальные кривые хорошо укладываются на прямые в координатах lg СИГ -τ, что свидетельствует о том, что реакция формилирования ГИНК имеет первый порядок по гидразиду и константа скорости остается неизменной:
k1=k2=k3=0,0022 л·моль-1·мин-1
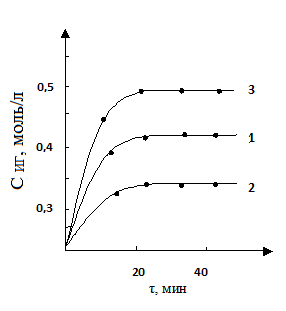
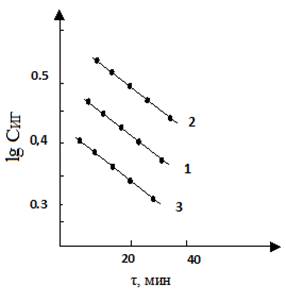
Рисунок 1. Кинетические кривые формилирования ГИНК при различных начальных концентрациях гидразида: Сº ГИНК 1 — 0,58; 2 — 0,72; 3 — 1,03 моль/л; Т-363К, Сº Ф-Д — 7,12 моль/л
При изучении влияния начальной концентрации второго компонента-формальдегида на протекание процесса выявлено, что реакция имеет также первый порядок по данному реагенту (рис. 2). Для начальных концентраций формальдегида 4,90; 7,12 и 8,32 моль/л значение констант скорости реакции составили:
k1=0,0025, k2=0,0022, k3=0,0043 л·моль-1·мин-1
Следовательно, кинетическое уравнение формилирования ГИНК можно представить в виде:
W=k·С ГИНК·С Ф-Д
Повышение температуры от 343 К до 353 К приводит к увеличению константы скорости реакции, однако дальнейшее повышение температуры процесса до 363 К приводит к уменьшению константы скорости реакции, по-видимому за счет протекания побочных процессов конденсации:
k1=0,00285, k2=0,0028, k3=0,0033, k4=0,0022 л·моль-1·мин-1
В изученном интервале температура (343—363 К) энергия активации процесса, найденная из аррениусовской зависимости, равна 10,4 кДж/моль.
В ИК-спектре ГИНК в области 1300—1700 см-1 наблюдаются полосы с частотами 1350,1675 см-1 , относящиеся к валентным колебаниям С-N и С=О групп. Полосы с частотами 1420,1560 и 1600 см-1 характеризуют скелетные колебания пиридинового кольца, а полоса с частотой 1630 см-1 обусловлена ножничными колебаниями NН2-группы.
В ИК-спектре полученного 1,1-метилен-бис-изоникотиноилгидразина наблюдаются сильные полосы поглощения с частотами 1100 и 1400 см-1, характеризуюшие соответственно валентные колебания N-N и С-N связей. Полосы с частотами 1420, 1460, 1570 и около 1600 см-1 относятся к скелетным колебаниям пиридинового кольца. Ряд полос в области 1380—1500 см-1 относится к деформационным колебаниям СН2 группы. Широкая полоса в области 1600—1700 см-1 соответствует деформационным колебаниям ОН групп воды.
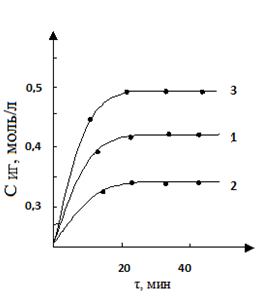
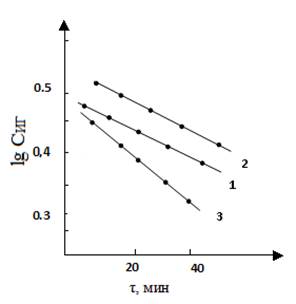
Рисунок 2. Кинетические кривые формилирования ГИНК при различных начальных концентрациях формальдегида: Сº Ф-Д 1 — 4,90; 2 — 7,12; 3 — 8,32 моль/л; Т-363 К, Сº ГИНК — 0,72 моль/л.
На основании кинетических исследований можно сделать некоторые выводы относительно механизма сопряженного гидразинолиза 4-цианпиридина до 1,1-метилен-бис-изоникотиноилгидразина: при взаимо-действии нитрила с водным гидразином и формальдегидом превалирующей реакцией является, по-видимому, присоединение к С≡N группе гидразина с образованием промежуточного гидразида, который далее под действием формальдегида превращается в 1,1-метилен-бис-изоникотиноилгидразин.
Список литературы:
1.Джумакаев К.Х., Джумадуллаева С.А., Ахметов К.М. В сб.: Каталитические реакции мономеров и полимеров. Чебоксары: ЧГУ, 1988. — 180 с.
2.Китаев Ю.П., Бузыкин Б.И. Гидразоны. М.: Наука,1974. — 406 с.
3.Коренман И.М. Фотометрический анализ. Методы определения органических соединений. М.: Химия. 1975. — 360 с.
4.Рубцов М.В., Байчиков А.Г. Синтетические химико-фармацевтические препараты. М.: Медицина, 1971. — 184 с.
5.Яцимирский К.Б. Кинетические методы анализа. М.: Химия, 1967. — 200 с.
дипломов


Оставить комментарий