Статья опубликована в рамках: XIII Международной научно-практической конференции «Инновации в науке» (Россия, г. Новосибирск, 17 октября 2012 г.)
Наука: Технические науки
Скачать книгу(-и): Сборник статей конференции, Сборник статей конференции часть II
- Условия публикаций
- Все статьи конференции
дипломов
ФИЗИКО-ХИМИЧЕСКОЕ ИЗУЧЕНИЕ ПРОЦЕССОВ ВЗАИМОДЕЙСТВИЯ ПЕРЕХОДНЫХ МЕТАЛЛОВ С 2,4 - БИС(ГИДРОКСИИМИНО)-6-МЕТИЛЦИКЛОГЕКСАН-1,3,5 – ТРИОНАТОМ НАТРИЯ
Ковальчукова Ольга Владимировна
д-р хим. наук, профессор кафедры общей химии
Российского университета дружбы народов, г. Москва
E-mail: okovalchukova@mail.ru
Нгуен Динь До
аспирант кафедры общей химии
Российского университета дружбы народов, г. Москва
E-mail: dondchem@gmail.com
Страшнова Светлана Болеславна
канд. хим. наук, доцент кафедры общей химии
Российского университета дружбы народов, г. Москва
E-mail: sstrashnova@mail.ru
PHYSICO-CHEMICAL STUDIES OF THE PROCESSES OF INTERACTION OF SOME TRANSITION METALS WITH SODIUM 2,4 - BIS(HYDROXYIMINO)-6-METHYLCYCLOHEXANE-1,3,5 – TRIONATE
Olga Kovalchukova
Doctor of Science, Professor of the Department of General Chemistry of the Peoples’ Friendship University of Russia, Moscow
Nguyen Dinh Do
Post Graduate Student of the Department of General Chemistry of the Peoples’ Friendship University of Russia, Moscow
Svetlana Strashnova
Candidate of Science, Assistant Professor of the Department of General Chemistry of the Peoples’ Friendship University of Russia, Moscow
АННОТАЦИЯ
Целью данной работы является определение условий образования комплексных соединений металлов с 2,4-бис(гидроксиимино)-6‑метилциклогексан-1, 3, 5-трионат анионом и изучение металлокомплексов совокупностью физико-химических методов анализа. Изучены процессы комплексообразования в растворах, определены состав комплексов и константы их образования. Получены линейные корреляции, связывающие устойчивость металлокомплексов с физическими и физико-химическими характеристиками ионов-комплексообразователей.
ABSTRACT
The background of the presented investigations was the determination of the conditions of complex formation of metals with 2,4-bis(hydroxyimino)-6-methylcyclohexane-1, 3, 5-trionate anions and the investigation of the metallic complexes by a set of physico-chemical methods. The processes of complex formation in solutions were studied, and the compositions of complexes and their formation constants were determined. Some linear correlations of the stabilities of the complexes and physical and physico-chemical characteristics of the metallic cations were obtained.
Ключевые слова: комплексные соединения; 2,4-бис (гидроксиимино)-6-метилциклогексан-1, 3, 5-трионат натрия; электронная спектроскопия; потенциометрия; константы образования; корреляции.
Keywords: complex compounds; sodium 2,4-bis(hydroxyimino)-6-methylcyclohexane-1, 3, 5-trionate; UV-VIS spectroscopy; potentiometry; formation constants; correlations.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований, грант № 10-03-00003-а.
Металлохелаты, имеющие координационный узел MNxOy, занимают особое положение, так как являются хорошими моделями для изучения проблемы конкурентной координации в химии комплексных соединений благодаря специфическому действию их окружения на стереохимию координационных полиэдров, модификацию физических и химических свойств и роль в биологически важных объектах. Оксимы с O,N-содержащими донорными группами являются классическим примером таких лигандов. До сих пор исследование процессов их комплексообразования с различными металлами является одним из наиболее перспективных направлений в химии. Для координированных оксимов из-за наличия в их молекулах трех C-, N- и O-реакционных центров и OH-группы, кислотность которой резко возрастает при координации, возможно, осуществление практически всех основных типов превращений, таких как нуклеофильные реакции оксимов в суперосновных средах и электрофильные реакции (взаимодействие координированных оксимов с электрофильными реагентами) [2].
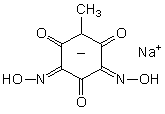
В настоящей работе в качестве объектов исследования были выбраны координационные соединения ряда переходных металлов с 2,4-бис(гидроксиимино)-6-метилциклогексан-1, 3, 5-трионатом натрия (NaL):
Экспериментальная часть
Электронные спектры поглощения записаны на спектрофотометре Varian Cary 50 Scan в видимой и ультрафиолетовой областях в этанольных и водных растворах при широком изменении pH. Точность измерений в среднем составляла ±20 см-1. Для определения состава комплексов в растворах и общей константы образования использовали метод спектрофотометрического титрования (метод насыщения) [1].
Регистрацию рН в процессе потенциометрического титрования проводили на лабораторном рН-метре-иономере с использованием стеклянного электрода. Расчет первой константы устойчивости проводили по формулам, представленным в работе [4].
Результаты и их обсуждение
Электронные спектры поглощения этанольных растворов NaL, представленные на рис. 1, характеризуются двумя основными полосами поглощения: 273 нм (lgε=4,03) и 380 нм (lgε=3,83). При добавлении в раствор соляной кислоты плечо исчезает и остаются две полосы поглощения, причем длинноволновая полоса несколько уменьшается по интенсивности и смещается гипсохромно: 273 нм (lgε=4.06) и 380 нм (lgε=3,82).
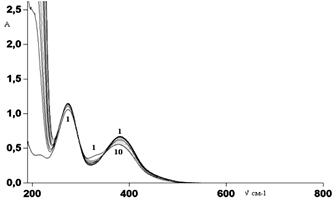
Рисунок 1. Электронные спектры поглощения при титровании раствора NaL (C=1·10-4 моль/л) раствором соляной кислоты (C=0,09 моль/л).) в интервале рН от 6,50 (кривая 1) до 1,55 (кривая 10)
В присутствии гидроксида натрия (рис. 2) в спектре соединения вместо двух полос появляется одна новая полоса со значительно большей интенсивностью: 329 нм (lgε=4.25). Такое изменение в спектре можно связать с ионизацией оксимной группы, которая сопровождается таутомерной перестройкой иона в нитрозо-таутомер:
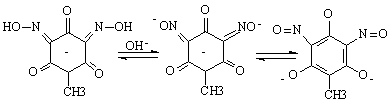
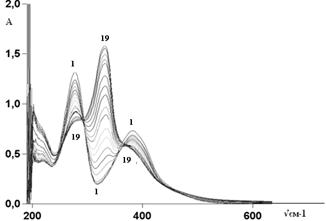
Рисунок 2. Электронные спектры поглощения при титровании раствора NaL (C=1·10-4 моль/л ) раствором гидроксида натрия (C=0,09 моль/л) в интервале рН от 6,78 (кривая 1) до 10,01(кривая 19)
Данное утверждение согласуется с результатами квантово-химических расчетов электронных спектров поглощения нитрозо- и гидроксиламино-таутомерных форм NaL [6].
Рисунок 3. Изменения в электронных спектрах поглощения водно-этанольных растворов NaL при постепенном добавлении раствора NiCl2 и кривая насыщения
Добавление к раствору NaL растворов солей металлов (рис. 3) приводит к изменениям в электронных спектрах поглощения, аналогичных для депротонирования лиганда, что указывает на перестройку гидроксилиминной формы в нитрозо-форму в процессе комплексообразования. Состав комплексов в растворе отвечает формуле ML. Кривые потенциометрического титрования смесей металл: лиганд (рис. 4) лежат ниже кривой титрования исходного лиганда, что также подтверждает его ионизацию в процессе комплексообразования.
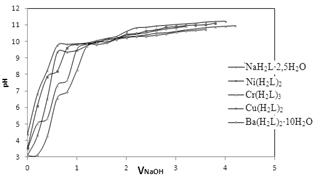
Рисунок 4. Кривые потенциометрического титрования NaL (0,01M) и смеси его с солями соответствующих металлов в соотношении 1:1.
Константы образования комплексов, рассчитанные независимыми методами, удовлетворительно согласуются между собой (табл. 1).
В литературе известно, что природа ионов-комплексообразователей в значительной мере влияет на параметры координационных соединений [5]. Установлено, что в зависимости от природы лиганда они могут иметь двоякий вид: изменяться монотонно или иметь экстремум. В последнем случае можно говорить об избирательности реакции комплексообразования. Для построения корреляционных зависимостей (рис. 5—10) нами были использованы такие физические характеристики катиона металла, как абсолютная электроотрицательность (c), ионный потенциал (rm/z,нм), средний потенциал ионизации (Ei,эВ), ионный радиус (r,нм), абсолютная жесткость,(η,эВ), электронность (ε,эВ). Как видно из рис. 5—10, корреляционные зависимости не имеют экстремумов, то есть изучаемые реакции комплексообразования не избирательны.
Таблица 1.
Состав комплексов NaL с катионами металлов(MLn) и значения их констант образования
|
Катион металла |
n |
β (спектрофотометрия) |
lgβ/n |
lg K1 (потенциометрия) |
|
Zn2+ |
1 |
7,77·1012 |
12,89 |
|
|
Ni2+ |
1 |
3,84·1011 |
11,58 |
11,49 |
|
Cu2+ |
1 |
7,22·1011 |
11,86 |
9,71 |
|
Co2+ |
1 |
1,90·1012 |
12,28 |
|
|
Cd2+ |
1 |
8,32·1010 |
10,92 |
|
|
Fe2+ |
1 |
1,37·1014 |
14,13 |
|
|
Pb2+ |
1 |
7,77·1013 |
13,89 |
|
|
Ba2+ |
1 |
1,13·1013 |
13,05 |
11,56 |
|
Fe3+ |
1 |
1,63·1016 |
16,21 |
|
|
Cr3+ |
1 |
7,02·1020 |
20,85 |
21,15 |
Рисунок 5. Зависимость величин lgβ/n комплексов NaL от величины электроотрицательности иона-комплексообразователя
Рисунок 6. Зависимость величин lgβ/n комплексов NaL от ионного потенциала иона-комплексообразователя
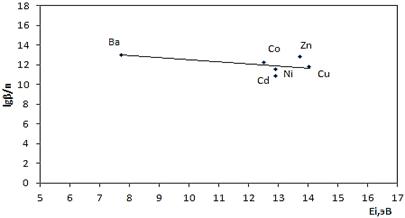
Рисунок 7. Зависимость величин lgβ/n комплексов NaL от среднего потенциала ионизации иона-комплексообразователя
Рисунок 8. Зависимость величин lgβ/n комплексов NaL от ионного радиуса иона-комплексообразователя
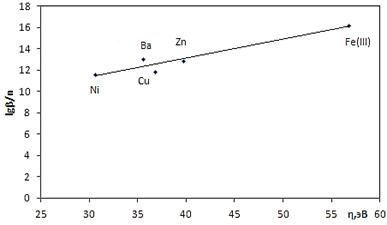
Рисунок 9. Зависимость величин lgβ/n комплексов NaL от абсолютной жесткости иона-комплексообразователя
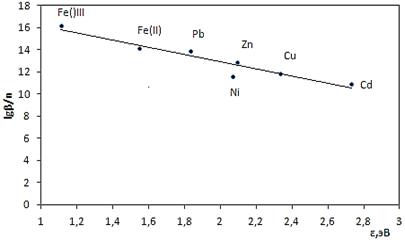
Рисунок 10. Зависимость величин lgβ/n комплексов NaL от величины электронности иона-комплексообразователя
Согласно теории жестко-мягких взаимодействий Пара и Пирсона [3], жестко-жесткие и мягко-мягкие взаимодействия приводят к сильному комплексообразованию и ковалентному типу связей в растворах, в то время как жестко-мягкие взаимодействия вызывают ионный тип связей и, следовательно, слабое или пренебрежительное взаимодействие в растворах. В связи с тем, что увеличение жесткости центрального иона приводит к увеличению константы образования металлокомплекса, можно предположить, что изучаемый органический анион имеет свойство жесткого основания Льюиса и основной вклад в комплексообразование вносят более жесткие карбонильные атомы кислорода.
Выводы
Изучены процессы комплексообразования 2,4-бис (гидроксиимино)-6-метилциклогексан-1, 3, 5-трионата натрия с переходными металлами в растворах, определены состав комплексов и константы их образования. Получены линейные корреляции, связывающие устойчивость металлокомплексов с физическими и физико-химическими характеристиками ионов-комплексообразователей. Определены спектральные критерии таутомерных форм органического аниона и характер донорных атомов в процессе комплексообразования.
Список литературы:
1.Бек М., Надьпал И. Исследование комплексообразования новейшими методами. Изд-во: « Мир». Москва. 1989. 549 с.
2.Гарновский Д.А., Кукушкин В.Ю. Металлопромотируемые реакции оксимов. // Успехи химии. — 2006. — Т. 75. — № 2. — С. 125—140.
3.Гарновский А.Д., Садименко А.П., Осипов О.А., Цинцадзе Г.В. Жестко-мягкое взаимодействие в координационной химии. Изд-во: «Рост. Госунив». Ростов-на-Дону. — 1986. — 250 с.
4.Россотти Ф., Россотти Х. Определение констант устойчивости и других констант равновесия в растворах. Изд-во: « Мир», Москва 1965. 345 с.
5.Brown P.L. Sylva R.N. Unified theory of metal ion complex formation constants. // J. Chem. Res. Miniprint. — 1987. — Р. 10110—10181.
6.Kovalchukova O.V., Shevelev S.A., Shakhnes A.H., et al. Some physic-chemical properties of products of chemical transformation of 2,4,6-trinitrotoluene. / In: Proceedings of the 13th Seminar on New Trends in Research of Energetic Materials. Part I. — 2011. — Pardoubice. — Р. 264—268.
дипломов


Оставить комментарий