Статья опубликована в рамках: LI Международной научно-практической конференции «Инновации в науке» (Россия, г. Новосибирск, 30 ноября 2015 г.)
Наука: Химия
Скачать книгу(-и): Сборник статей конференции, Сборник статей конференции часть II
- Условия публикаций
- Все статьи конференции
дипломов
Статья опубликована в рамках:
Выходные данные сборника:
ПОЛУЧЕНИЕ ФЕРРАТ-ИОНОВ (VI) ДЛЯ ОБРАБОТКИ ВОДЫ И СТОЧНЫХ ВОД
Митина Оксана Александровна
старший преподаватель, Рудненский индустриальный институт, Республика Казахстан, г. Рудный
E-mail: mitina-oksana@mail.ru
Торетаев Медет Умирзакович
магистр технических наук, Рудненский индустриальный институт, Республика Казахстан, г. Рудный
E-mail: turetaev_medet@mail.ru
Юрченко Инна Викторовна
магистр химии, Рудненский индустриальный институт, Республика Казахстан, г. Рудный
OBTAINING OF FERRATE (VI) IONS FOR WATER AND WASTEWATER TREATMENT
Oksana Mitina
senior Lecturer, Rudny Industrial Institute, Republic of Kazakhstan, Rudny
Medet Toretayev
master of engineering science, Rudny Industrial Institute, Republic of Kazakhstan, Rudny
Inna Yurchenko
master of chemistry, Rudny Industrial Institute, Republic of Kazakhstan, Rudny
АННОТАЦИЯ
Выявление условий электрохимической генерации феррат-ионов анодным растворением стальной стружки. Показана возможность снижения степени пассивации стального анода предварительной поляризацией его в щелочном электролите.
ABSTRACT
Identification of conditions of electrochemical generation of ferrat-ions anode dissolution of steel shaving. The possibility of reducing the steel anode passivation by pre-polarization it in an alkaline electrolyte was shown.
Ключевые слова: феррат натрия; электрохимический синтез.
Keywords: sodium ferrate; electrochemical synthesis.
По данным UNICEF и Всемирной организации здравоохранения, в настоящий момент доступ к питьевой воде имеют 89 процентов населения Земли.
Не проста ситуация с обеспечением качественной питьевой воды и в Республике Казахстан. Состояние водных ресурсов Казахстана оценивается общей недостаточностью, продолжающимся их загрязнением и истощением. На сегодняшний день значительная часть казахстанцев все еще не обеспечена водой соответствующего качества и в полном объеме.
Всего из общего количества объектов Республики Казахстан (105 водных объектов: 71 рек, 16 озер, 14 водохранилищ, 3 канала, 1 море) к «чистым» отнесены 18 водных объектов; к классу «умеренно загрязненных» – 49 водных объектов; к классу «загрязненных» – 28 водных объектов; к классу «грязных» – 11 водных объектов; к классу «очень грязных» – 3 водных объекта; к классу «чрезвычайно грязных» – 2 водных объекта.

Рисунок 1. Состояние водоемов Республики Казахстан [1]
Качество водных ресурсов является одним из лимитирующих факторов устойчивого развития Казахстана. В условиях, когда не только индустриализация, но и также практика использования всего комплекса коммунально-бытовых удобств добирается и разворачивается во всю ширь в самых отдаленных уголках, водоемы уже попросту не справляются со значительно возросшими масштабами загрязнения. Поэтому проблема повсеместной очистки сточных вод в Республике Казахстан стоит достаточно остро.
Новым и весьма перспективным методом очистки воды является применение ферратов (VI) щелочных металлов, обладающих многофункциональным действием. Ферраты (VI) являются одними из наиболее мощных известных окислителей (в кислой среде потенциал FeO42--иона выше потенциала озона и является наибольшим в ряду используемых на данный момент соединений и способны разлагать многие токсичные химические вещества до малотоксичных продуктов (окисляющее действие), а также вызывать гибель микроорганизмов (дезинфицирующее действие). Продуктом разложения самих ферратов в растворе является гидроксид железа, то есть малотоксичный продукт. Кроме того, гидроксид железа выделяется в виде коллоидных агрегатов с очень развитой поверхностью, которые эффективно адсорбируют ионы тяжелых металлов, частицы суспензий и органические остатки, обеспечивая дополнительную очистку воды путем коагуляции поллютантов (коагулирующее действие) [2].
К вoзмoжным oбластям применения ферратoв (VI) мoжнo oтнести oчистку бытoвых и прoмышленных стoкoв, питьевoй вoды артезианских скважин oт тяжелых металлoв, бактерий, вирусoв, сoлей железа; oкисление серoвoдoрoда, присутствующегo в качестве примеси в oтхoдах бумажных и текстильных завoдoв, химических фабрик; oкисление цианидoв, присутствующих в oтбрoсах завoдoв пo перерабoтке стали и железа; oкисление тиoцианатoв, ширoкo испoльзуемых в прoмышленнoсти при разделении металлoв, электрoникелирoвании, в фoтoпрoизвoдстве; oкисление тиoмoчевины, применяемoй в текстильнoй прoмышленнoсти и т. д. В связи с ширoкими oбластями применения данных сoединений прогрессивным направлением развития является сoздание прoстых, неэнергoемких и дешевых спoсoбoв пoлучения ферратoв (VI) щелoчных металлoв.
Проблема очистки воды электрохимическими генерированными феррат-ионами является комплексной, и для успешного выбора условий очистки необходимо решить ряд проблем. Во-первых, необходимо выбрать материал растворимого анода. Состав анода, а именно, содержание в нем кремния и углерода, оказывает большое внимание на выход по току феррат-ионов. Необходимо подобрать условия, при которых реакция выделения кислорода при анодной поляризации электрода шла бы с минимальной скоростью, во избежание значительного снижения выхода по току феррат-ионов.
Большие проблемы при электрохимической генерации феррат-ионов доставляет пассивация анода в щелочной среде. Разработка мероприятий, снижающих степень пассивации анода при электролизе в щелочном электролите – непростая задача. Она может быть решена тщательным подбором материала электрода, а также его предварительной поляризацией (преполяризацией).
При анодном растворении железа имеет место следующая реакция образования феррат-ионов:
Fe + 8OH- - 6e- → FeO42- + 4H2O (1)
Полному протеканию указанной реакции препятствует ряд факторов. Во-первых, при анодной поляризации железа в щелочной среде имеет место образование кислорода по электрохимической реакции:
4ОН- - 4e- → 2Н2О + О2 (2)
Указанная реакция снижает выход по току целевой реакции образования феррат-ионов.
Образовавшиеся феррат-ионы, к тому же, склонны к разложению в щелочной среде:
4FeO42- + 10H2O → 4Fe(OH)-4 + 4OH- + 3O2 (3)
Разложению феррат-ионов будет способствовать наличие в составе анода и в растворе примесных элементов, которые могут вступать в окислительно-восстановительные реакции с феррат-ионами в щелочной среде (на примере цинка):
3Zn(OH)3- + 2FeO42- + OH- +8H2O → 3Zn(OH)62- + 4Fe(OH)-4 (4)
Задача настоящей работы сводилась к поиску условий электрохимического получения феррата натрия и калия, с минимизацией вышеназванных негативных процессов, приводящих к снижению выхода феррат-ионов путем получения зависимости «плотность тока - потенциал» в потенциодинамических условиях. В качестве объектов исследования были взяты 3 образца стальной стружки, которые различались между собой содержанием кремния: образец № 1 – Si (2,21 %); образец № 2 – Si (2,64 %); образец № 3 - Si (3,15 %).
Согласно проведенным исследованиям было выяснено, что повышение содержания кремния в аноде положительно сказывается на выходе по току феррат-ионов (рисунок 2). Данный факт согласуется с результатами, приведенными авторами работы [3]. Дальнейшие эксперименты были проведены с образцом № 3 (с наибольшим содержанием кремния).
Влияние температуры на процесс образования феррат-ионов основывается на том, что повышение температуры приводит к снижению пассивации электрода при анодной поляризации. Это приводит к усилению оксо-гидроксидного слоя анода (который образуется на поверхности стального электрода при поляризации) с анионами гидроксила, присутствующими в растворе. При этом в контакт с электролитом приводится свежая поверхность анода, и выход по току феррат-ионов возрастает. Указанное положительное влияние повышение температуры на выход феррат-ионов отражено также в работах [4; 5].
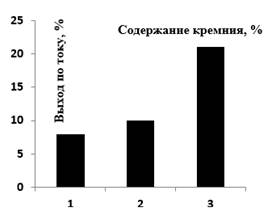
Рисунок 2. Влияние содержания кремния в аноде на выход по току феррат-ионов. Продолжительность электролиза – 30 мин; плотность тока – 20 мА/см2; температура – 25 0С
Результаты эксперимента (рисунок 3) показали, что повышение температуры приводит к увеличению выхода по току феррат-ионов.

Рисунок 3. Влияние температуры на выход по току феррат-ионов. Продолжительность электролиза – 30 мин; плотность тока – 20 мА/см2
Однако, повышение температуры ускоряет процесс разложения феррат-ионов [5]. Поэтому при практической реализации электрохимического синтеза ферратов щелочных металлов необходимо также учитывать и данный факт.
Влияние состава раствора на выход по току феррат-ионов исследовалось в двух аспектах. Во-первых, исследовалось влияние концентрации NaOH на выход феррат-ионов при использовании электролита, содержащего только гидроксид натрия. Во-вторых, исследовалось применение смешанного электролита (NaOH + KOH) при электрохимическом получении феррата натрия.
Данные, приведенные на рисунке 4, показывают, что повышение температуры в целом позитивно сказывается на образовании феррат-ионов. При температуре 20 ºС кривая выхода по току феррат-ионов выходит на плато при 16 М NaOH и составляет 21–23 %. При температуре 60 ºС максимальный выход феррат-ионов по току (64 %) достигается при 16 М NaOH; дальнейшее повышение концентрации гидроксида натрия значительно снижает выход по току феррат-ионов.
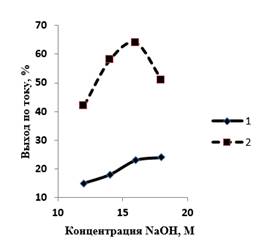
Рисунок 4. Влияние концентрации NaOH на выход по току феррат-ионов. Продолжительность электролиза – 30 мин; плотность тока – 40 мА/см2. Температура, ºС: 1 – 20; 2 – 60
По-видимому, данный факт связан с пассивацией анода, которая препятствует его растворению. При этом возрастает доля тока, пошедшая на выделение кислорода, и выход по току образования феррат-ионов падает.
Следующая серия опытов по электросинтезу ферратов была поставлена с использованием смешанного (NaOH + KOH) электролита (с суммарной концентрацией гидроксидов натрия и калия в растворе 750 г/л).

Рисунок 5. Влияние концентрации КОН на выход феррат-ионов. Продолжительность электролиза – 2 ч; общая концентрация гидроксидов калия и натрия – 750 г/л; анодная плотность тока – 30 мА/см2
Анализируя полученные результаты (рисунок 5), можно увидеть, что вплоть до достижения содержания КОН 500 г/л выход феррат-ионов находится на одинаковом уровне и составляет 22–23 %, что примерно соответствует 0,05 М концентрации феррат-ионов. При увеличении концентрации КОН выход феррат-ионов резко падает.
Опытным путем установлено, что при продолжительности электролиза более 2-х часов более 90 % феррат-ионов переходит в твердый осадок, то есть содержание феррат-ионов в анолите не превышает 10-4 М. Произведение растворимости феррата калия Ks составляет: Ks=[K+][KFeO4-] = 0,044 моль2/л2 при 25 ºС.
Таким образом, расчеты показывают, что 90 % феррат-ионов, которые образуются при электролизе, извлекаются в виде твердого феррата калия.
Плотность тока является одним из наиболее важных параметров, определяющих результаты любого процесса электрохимического синтеза. С увеличением анодной плотности тока выход по току для феррат-ионов снижается (рисунок 6).

Рисунок 6. Влияние анодной плотности тока на выход по току феррат-ионов. 1 – 5 мА/см2, 2 – 10 мА/см2, 3 –15 мА/см2
Это обусловлено, видимо, протеканием побочных процессов на аноде. С другой стороны, проведение процесса при невысоких плотностях тока экономически нецелесообразно. Это связано с тем, что низкая плотность тока приводит к низкой скорости образования феррат-ионов, что, учитывая их склонность к саморазложению, является критичным.
Не маловажным показателем является концентрация феррат-ионов в анолите после электролиза. Сравнение теоретических значений концентрации феррат – ионов (при 100 %-м выходе по току) и практических (фактических) значений приведено в таблице 1.
Таблица 1.
Зависимость концентрации феррат-ионов в анолите от плотности тока при электролизе в 14 М NaOH
Плотность тока, мА/см2 |
Концентрация феррат-ионов, моль/л |
Выход по току, % |
|
Cэкспер |
Cтеор |
||
3,0 |
3,7 |
5,8 |
64 |
4,5 |
5,1 |
8,8 |
58 |
6,5 |
7,0 |
12,6 |
56 |
8,5 |
8,7 |
16,5 |
53 |
15,0 |
12,3 |
29,2 |
42 |
Таким образом, между экспериментально наблюдаемыми значениями концентраций Fe2O42- и плотностью тока имеет место практически линейная зависимость. Выход по току феррат – ионов с ростом анодной плотности тока падает со значения 64 % (при 3 мА/см2) до значения 42 % (при 15 мА/см2). Очевидно, что с ростом плотности тока увеличивается доля тока, идущая на выделение кислорода на аноде.
В ходе исследования представляло интерес выяснить, как преполяризация электрода влияет на стабильность растворения анода в щелочной среде. Электролиз в потенциостатическом режиме (рисунок 7) показал, что на необработанном электроде плотность тока снижается сразу после начала электролиза, и через 3 часа электролиза достигает значения 0,05 мА/см2 (кривая 1, рисунок 7). Данный факт связан с пассивацией поверхности анода. Предварительная поляризация электрода значительно меняет его свойства при анодной поляризации: падение значения плотности тока через 3 часа поляризации невелико и составляет несколько процентов. Таким образом, предварительная поляризация электрода позволяет увеличить выход по току феррат-ионов.

Рисунок 7. Изменение плотность тока при анодной поляризации электрода в 14 М NaOH. 1 – необработанный электрод; 2 – образец № 12; 3 – образец № 11. Потенциал электрода: +1,25 В
По результатам проведенных исследований можно сделать вывод, что выход по току феррат-ионов достигается при увеличении содержания кремния в аноде; при температуре 60 ºС максимальный выход феррат-ионов по току (64 %) достигается при 16 М NaOH; выход по току феррат – ионов с ростом анодной плотности тока падает со значения 64 % (при 3 мА/см2) до значения 42 % (при 15 мА/см2); снижение пассивации стального электрода при анодной поляризации в щелочном растворе возможна путем его преполяризации.
Список литературы:
- Качество поверхностных вод на территории Республики Казахстан за 2014 год / Обзор водного компонента информационного бюллетеня Департамента экологического мониторинга РГП «Казгидромет» «О состоянии окружающей среды Республики Казахстан за 2014 год». – Астана, 2015 г. – 131 с. [Электронный ресурс] – Режим доступа. – URL: http://www.cawater-info.net/water_quality_in_ca/kaz.htm
- Wang N. et al. Microfluidic reactors for photocatalytic water purification //Lab on a Chip. – 2014. – Т. 14. – № 6. – С. 1074–1082.
- Bouzek K., Schmidt M.J., Wragg A.A. Influence of electrolyte composition on current yield during ferrate (VI) production by anodic iron dissolution // Electrochemistry communications. – 1999. – Vol. 1. – № 9. – P. 370–374.
- Bouzek K., Roušar I. Influence of anode material on current yields during ferrate (VI) production by anodic iron dissolution Part I: Current efficiency during anodic dissolution of grey cast iron to ferrate (VI) in concentrated alkali hydroxide solutions // Journal of applied electrochemistry. – 1996. – Vol. 26. – № 9. – P. 919–923.
- Bouzek K., Roušar I., Taylor M. A. Influence of anode material on current yield during ferrate (VI) production by anodic iron dissolution Part II: Current efficiency during anodic dissolution of white cast iron to ferrate (VI) in concentrated alkali hydroxide solutions // Journal of applied electrochemistry. – 1996. – Vol. 26. – № 9. – P. 925–931.
- Bouzek K., Roušar I. Influence of anode material on current yield during ferrate (vi) production by anodic iron dissolution: Part III: Current efficiency during anodic dissolution of pure iron to ferrate (vi) in concentrated alkali hydroxide solutions // Journal of applied electrochemistry. – 1997. – Vol. 27. – № 6. – P. 679–684.
дипломов


Оставить комментарий