Статья опубликована в рамках: XXX Международной научно-практической конференции «Научное сообщество студентов XXI столетия. ЕСТЕСТВЕННЫЕ НАУКИ» (Россия, г. Новосибирск, 07 апреля 2015 г.)
Наука: Медицина
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
СОСТОЯНИЕ ФЕРМЕНТНОЙ СИСТЕМЫ ГЛУТАТИОНРЕДУКТАЗА — ГЛЮКОЗО-6-ФОСФАТДЕГИДРОГЕНАЗА В СЛЮНЕ СТУДЕНТОВ РАЗНЫХ СТРАН
Кравченко Денис
студент стоматологического факультета Государственного университета медицины и фармации им. Н. Тестемицану, Молдова, г. Кишинёв
E -mail: cravcencodns @mail.ru
Гаврилюк Людмила Александровна
научный руководитель, д-р мед. наук, профессор, ГУМиФ им. Н. Тестемицану, Молдова, г. Кишинёв
Социально-демографические причины, рост случаев инфицирования через кровь многими опасными заболеваниями, распространение наркомании способствуют поиску новых, неинвазивных и безопасных методов диагностики и контроля состояния пациентов. С этой точки зрения анализ слюны представляет одну из альтернатив анализу крови. Слюна (ротовая жидкость) как биологическая жидкость организма отражает состояние метаболизма, а изменение составляющих её компонентов (бихимических параметров) может иметь клинико-диагностическое значение [1; 2; 3; 4].
Смешанная слюна выполняет многообразные функции и имеет сложный биохимический состав. Одной из важнейших её функций является антиоксидантная, включающая супероксиддисмутазу, каталазу, глутатионпероксидазу, глутатионредуктазу, глюкозо-6-фосфатдегидрогеназу и др. Водорастворимыйтрипептид, глутатион, является важным антиоксидантом, который в организме человека находится в двух формах: окисленной (GSSG) и восстановленной (GSH). Глутатион постоянно синтезируется в организме, и это индивидуально генетически детерминировано. Количество глутатиона у людей варьирует, а у трети населения наблюдается его недостаточное содержание [5]. Восстановленный глутатион составляет около 90—95 % от его общего внутриклеточного содержания. По мнению многих исследователей снижение уровня глутатиона в организме может привести к необратимым последствиям для здоровья. Функции глутатиона в организме многообразны: он инактивирует вредные для организма свободные радикалы кислорода, которые возникают при перекисном окислении липидов клеточных мембран, является коэнзимом многих глутатион-зависимых ферментов, способствует выведению из организма различных токсинов и тяжёлых металлов.
Единственным энзимом, основное биологическое значение которого заключается в поддержании высокого уровня восстановленного глутатиона и низкого окисленного, является глутатионредуктаза, катализирующая реакцию:
GSSG + NADPH + H+ ® 2 GSH + NADP+
Для нормального функционирования глутатионредуктазе необходим коэнзим НАДФН, который генерирует аэробный путь апотомического окисления глюкозы — пентозо-фосфатный путь (шунт).
Целью нашего исследования был сравнительный анализ состояния системы глутатиоредуктаза — глюкозо-6-фосфатдегидрогеназа в слюне студентов, рождённых в разных странах мира.
Материал и методы исследования
В исследовании участвовали 47 здоровых студентов в возрасте 20—23 года, которые были распределены на четыре группы: 1 — молдаване (Молдова); 2 — евреи (Израиль); 3 — арабы (Израиль); 4 — африканцы. В процессе иследования были соблюдены все этико-правовые нормы. Смешанную слюну (ротовую жидкость) собирали утром, центрифугировали при 5000 оборотов/ мин в течение 10 минут. Затем с помощью спектрофотометрических микрометодов (DiaSysDiagnostics, DE) определяли следующие параметры: активность глутатионредуктазы (ГР, КФ 1.6.4.2) методом Horn H.D. [6], глюкозо-6-фосфатдегидрогеназы (Г6ФДГ, КФ 1.1.1.44) методом Noltman E.A. [7], лактатдегидрогеназы (ЛДГ, КФ 1.1.1.27) методом Кузнецова А.В. [8], содержание восстановленного глутатиона методом Sedlak J. [9] и содержание общего белка методом Lowry O.H. (1951). Состав слюны варьирует в течение суток, поэтому, необходимо проводить дополнительный расчёт полученных результатов относительно содержания белка в л слюны, что является более информативным. Полученные результаты статистически обрабатывали с помощью программы Excel и Microsoft:Microstat 2007. Коэффициенты корреляции рассчитывали по методу Спирмена [10].
Результаты и обсуждение
Все студенты были без воспалительных процессов тканей ротовой полости. Исследование содержания общего белка показало незначительное различие между группами студентов (таблица 1).
Восстановленный глутатион (ВГ). Содержание ВГ в слюне представлено в таблице 1. Для проведения сравнительного анализа содержание ВГ в слюне студентов первой группы было принято за 100 %. По отношению к показателю первой группы у студентов второй группы содержание ВГ в слюне было значительно выше как при расчёте на л слюны (184,9 %), так и при расчёте на г белка (185,6 %). Также повышенное сожержание ВГ было у студентов четвёртой группы в л слюны (179,3 %) и относительно г белка (223,4 %). Только у студентов третьей группы содержание ВГ в слюне было значительно ниже как в расчёте на л слюны (64,1 %), так и относительно г белка (56,0 %).
Таблица 1.
Содержание восстановленного глутатиона (ВГ) и белка в слюне студентов
|
Параметр/единицы |
Молдова: 1 гр |
Израиль: 2 гр |
Израиль: 3 гр |
Африка: 4 гр |
|
|
ВГ |
мкмоль/л % |
15,73 ± 10,63 100% |
29,09 ± 9,10 184,9% |
10,09 ± 5,85 64,1% |
28,20 ± 5,00 179,3% |
|
мкмоль/г % |
18,04 ± 8,94 100% |
33,49 ± 12,57 185,6% |
10,10 ± 5,77 56,0% |
40,30 ± 7,85 223,4% |
|
|
Белок |
г/л |
0,809 ± 0,231 |
0,995 ± 0,408 |
1,010 ± 0,204 |
0,745 ± 0,195 |
|
% |
100% |
123,0 % |
124,9 % |
92,1 % |
|
Глутатионредуктаза (ГР). В расчёте на л слюны у студентов первой группы активность была равной 12,0 МЕ (100 %), у студентов второй группы — 20,6 МЕ (171,7 %), у студентов третьей группы — 38,3 МЕ (319,2 %), в четвёртой группе — 29,1 МЕ (242,5 %). Удельная активность ГР, представленная на рисунке 1, также была повышенной в слюне студентов третьей и четвёртой групп, но немного ниже (87,5 %) активности энзима в слюне первой группы. ГР является НАДФН-зависимым энзимом, и для выполнения её внутриклеточной функции требуется в несколько раз больше НАДФН, чем полиферментному комплексу биосинтеза жирных кислот или монооксигеназной цепи микросомального окисления (Cyt P450) для обезвреживания токсических веществ.

Рисунок 1. Удельные активности ГР и Г6ФДГ в слюне студентов Серия 1 — ГР; серия 2 — Г6ФДГ. 1, 2, 3, 4 — группы студентов
ГР связывает энзиматическое разрушение перекисей, образующихся в организме, с пентозофосфатным путём метаболизма глюкозы, одним из ключевых ферментов которого является глюкозо-6-фосфатдегидрогеназа.
Глюкозо-6-фосфатдегидрогеназа (Г6ФДГ). Активность энзима была повышенной во второй — 18,7 МЕ/л (283,3 %), третьей — 8,9 МЕ/л (134,8 %) и четвёртой — 13,1 МЕ/л (198,5 %) группах по сравнению с активностью Г6ФДГ в слюне студентов первой группы (6,6 МЕ/л). Удельная активность энзима была повышенной у студентов второй группы и четвёртой (рисунок 1). В третьей группе удельная активность энзима в слюне была соразмерна активности Г6ФДГ у студентов первой группы (108,1 %). Пентозофосфатный путь генерирует НАДФН, необходимый для обезвреживания токсинов монооксигеназной цепью микросомального окисления, синтеза жирных кислот и липидов, стероидных гормонов, провитамина D. Полученные результаты активности Г6ФДГ в слюне свидетельствуют о более активных анаболических процессах в организме студентов второй и четвёртой групп, по сравнению со студентами первой и третьей. Пентозофосфатный путь (шунт) связан с дихотомическим путём окисления глюкозы, гликолизом, одним из ключевых ферментов которого является лактатдегидрогеназа.
Лактатдегидрогеназа (ЛДГ). На рисунке 2 представлена активность ЛДГ в расчёте на л слюны и на г белка (удельная активность). Как видно из рисунка, активность ЛДГ в слюне у студентов первой группы была выше активностиэнзима у студентов всех остальных групп при обоих способах расчёта.
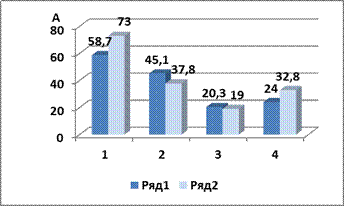
Рисунок 2. Активность ЛДГ в слюне студентов А — активность: серия 1 — МЕ/л; серия 2 — МЕ/г белка
Корреляционный анализ. Принимая во внимание, что ГР, Г6ФДГ и ЛДГ являются функционально связанными энзимами, было решено рассмотреть их взаимоотношения у студентов (таблица 2). Результаты корреляционного анализа Спирмена показали тесную взаимосвязь между ГР и Г6ФДГ у студентов первой, второй и четвёртой групп, в третьей группе эта связь была нарушена (Pt>0,05). Однако, функциональная взаимосвязь между ГР и ВГ была найдена только в третьей группе (Pt<0,0025). У студентов первой и третьей групп была найдена тесная функциональная связь между Г6ФДГ и ЛДГ. Таким образом, поиск корреляционных отношений между энзимами и ВГ с применением непараметрического критерия Спирмена показал, что эта функциональная взаимосвязь не всегда является тесной даже у практически здоровых людей. По-видимому, модификации взаимоотношений этих энзимов отражают метаболический статус организма здоровых студентов из разных стран.
Таблица 2.
Корреляционные взаимоотношения энзимов и глутатиона в слюне студентов
|
Параметры |
Показатели |
Молдова -1 гр |
Израиль- 2 гр |
Израиль - 3 гр |
Африка - 4 гр |
|
ГР – ВГ |
r |
-0,342 (12) |
+0,254 (12) |
+0,664 (14) |
+0,067 (9) |
|
|
Pt |
>0,05 |
>0,05 |
0,0025 |
>0,05 |
|
ГР – Г6ФДГ |
r |
+0,704 |
+0,458 |
+0,316 |
+0,708 |
|
|
Pt |
<0,0025 |
<0,05 |
>0,05 |
<0,0025 |
|
ЛДГ – Г6ФДГ |
r |
+0,507 |
+0,378 |
+0,501 |
+0,567 |
|
|
Pt |
<0,05 |
>0,05 |
<0,025 |
>0,05 |
Примечание. В скобках указано количество студентов
Принимая во внимание молодой возраст студентов, не вызывает особых вопросов повышение активности ГР и Г6ФДГ в слюне, что может свидетельствовать об активных анаболических процессах в их организме. Возможно, в первой группе студентов наблюдалось незначительное повышение, в пределах нормы, активности ЛДГ в сравнении с другими группами. На основании полученных результатов можно сделать следующие выводы:
1. Различия в активности энзимов и восстановленного глутатиона в слюне студентов из разных стран, вероятно, являются генетически детерминированными.
2. Результаты проведённого корреляционного анализа с применением непараметрического критерия Спирмена не показали функциональную тесную взаимосвязь между всеми рассмотренными параметрами, что может свидетельствовать о модификациях метаболических процессов в растущем организме.
Список литературы:
1.Григорьев И.В., Чиркин А.А. Роль биохимического исследования слюны в диагностике заболеваний. //Клин. Лаб. Диагностика. — 1998. — № 6 — С. 18—20.
2.Гублер Е.В., Генкин А.А. Применение непараметрических критериев статистики в медико-биологических исследованиях. М: Наука, 1973.
3.Horn H.D. Glutathione reductase. In: Bergmeyer, H.-U. Ed. Methods of enzymatic analysis. New York: Academic Press, 1963. — p. 875—879.
4.Kuznetsov A.V., Gnaider E. Laboratory protocol lactate dehydrogenase cytosolic marker enzyme.// Mitochondrial Physiology Network. — 2010. — vol. 8. — № 18. — p. 1—8.
5.Liu J., Duan Y. Saliva: a potential media for disease diagnostics and monitoring.// Oral Oncol. — 2012. — vol. 48. — № 7. — p. 567—577.
6.NazzarenoBallatori, Suzame M. Kpance, Sylvia Notenboom, Shujie Shi, Kim Tieu, Cristine L. Hammond. Glutathione dysregulation and the etiology and progression of human diseases.// Biol. Chem.-2009. — vol. 390. — № 3. — p. 191—214.
7.Noltman E.A., Gubler G.J., Kubby S.A. Enzymatic Assay of Glucose-6-Phosphate Dehydrogenase.// J. Biol. Chem. — 1961. — № 236. — p. 1225—1230.
8.Schafer C.A., Schafer J.J., Yakob M., Lima P., Camargo P., Wong D.T. Saliva diagnostics: utilizing oral fluids to determine health status.// Monogr. Oral Sci. — 2014. — № 24. — p. 88—98.
9.Sedlak J., Lindsay R.H. Estimation of total protein-bound, and nonprotein sulfhydryl groups in tissue with Ellman’s reagent.// Anal. Biochem. — 1968. — vol. 25. — № 1. — p. 192—205.
10.Todorovic T., Dozic I., Pavlica D., Marcovic D., Brajovic G., Ivanovic M., Stevanovic G., Mircovic S., Andjelski B.// J. Calif. Dent. Assoc. — 2013. — vol. 41. — № 2. — p. 107—109; 112.
дипломов


Оставить комментарий