Статья опубликована в рамках: IX Международной научно-практической конференции «Научное сообщество студентов XXI столетия. ЕСТЕСТВЕННЫЕ НАУКИ» (Россия, г. Новосибирск, 04 апреля 2013 г.)
Наука: Химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
ИССЛЕДОВАНИЕ ФИЗИКО-ХИМИЧЕСКИХ И КИСЛОТНО-ОСНОВНЫХ СВОЙСТВ НОВЫХ ОБРАЗЦОВ АНИОНИТОВ SYNTHES EV 013 И SXR 002
Землянская Алёна Игоревна
студент 4 курса, кафедра органической и аналитической химии СФУ, г. Красноярск
E-mail: aloyna91g@mail.ru
Кононова Ольга Николаевна
научный руководитель, канд. хим. наук, доцент СФУ, г. Красноярск
С развитием теории и практики ионного обмена все большее внимание уделяется комплексообразующим смолам, способным к избирательному поглощению одного или нескольких видов ионов [1, 2].
Большой интерес в этом плане представляют аминокислотные амфотерные иониты — амфолиты, содержащие одновременно кислотные и основные группы. Наличие азота у аминокислотных групп обуславливает образование дополнительных координационных связей — хелатов, сорбируемых ионов металлов. В результате хелатообразования селективность амфолитов значительно увеличивается по сравнению с катионитами или анионитами. Одной из особенностей амфолитов является изменение функциональных свойств с изменением рН раствора: в щелочной среде они способны к обмену катионов, в нейтральных и слабокислых растворах образуют комплексные соединения, в кислых растворах обладают анионообменными свойствами.
Своеобразие свойств амфотерных ионитов позволяет применять их более эффективно, чем обычные иониты, для выделения и концентрирования следовых количеств металлов, очистки растворов, разделения и улавливания ценных металлов [3].
Целью данной работы было изучение физико-химических и кислотно-основных свойств новых отечественных образцов анионитов Synthes EV 013 и SXR 002, чтобы в дальнейшем исследовать их сорбционные свойства при извлечении ионов благородных и цветных металлов.
Ионообменными материалами — ионитами — называются вещества, способные к обратимому стехиометрическому обмену катионов или анионов, содержащиеся в растворе.
Наибольшее практическое значение имеют иониты на основе синтетических смол, которые по сравнению с другими ионитами отличаются большой химической и механической прочностью и разнообразием свойств.
Синтетические ионообменные смолы состоят из углеводородного каркаса, являющегося матрицей, и закрепленных в ней фиксированных ионов, несущих заряд и определяющих обменные свойства смолы (катионита или анионита).
Каркас ионита обладает положительным или отрицательным зарядом, который компенсируется зарядом противоионов, так что в целом ионит нейтрален. Способность ионита к обмену обусловливается тем, что противоионы обладают определенной подвижностью в пределах каркаса.
Как известно, углеводородная матрица смолы гидрофобна, то есть не растворяется и не набухает в воде. Введение при синтезе ионогенных групп обеспечивает изменение гидрофобных свойств матрицы на гидрофильные вследствие присоединения к ней фиксированных ионов.
Поскольку матрица ионита пространственно «сшита», поперечные связи между углеводородными цепями препятствуют их разъединению. Благодаря этому при погружении в воду органические иониты не растворяются, а лишь набухают, поглощая некоторое количество воды.
Строение матрицы определяет химическую и термическую стойкость ионообменных смол.
В зависимости от величины константы диссоциации катионита в Н-форме различают сильнокислотные и слабокислотные образцы. То же относится и к анионитам: смолы с четвертичной аммонийной группой называются высокоосновными, они практически полностью диссоциированы при всех условиях. Аниониты с первичной, вторичной и третичной аминогруппами называются низкоосновными.
Надежной количественной характеристикой ионизации слабокислотных катионитов и слабоосновных анионитов является константа ионизации К, определяемая различными методами. Как и при изучении водорастворимых кислот и оснований, наиболее распространенным методом определения констант ионизации является потенциометрическое титрование. Этот метод основан на том, что Н-катиониты и ОН-аниониты титруют щелочью и кислотой соответственно подобно растворимым кислотам и основаниям. При наличии активных групп различных типов с достаточно большим различием констант ионизации на кривых титрования ионитов, так же как и растворимых электролитов, обнаруживается несколько скачков. Однако имеются и существенные отличия, обусловленные тем, что противоионы ионитов, реагирующие с титрантом, находятся в твердой фазе.
Во-первых, начальное значение рН при титровании катионитов выше и притом тем выше, чем слабее кислота. Соответственно, начальное значение рН при титровании анионитов тем ниже, чем слабее титруемое основание.
Во-вторых, кривые потенциометрического титрования ионитов в воде идут гораздо более полого, а скачки рН вблизи точки эквивалентности обозначаются менее четко, чем при титровании растворимых кислот или оснований. Добавки нейтральной соли, например NaCl или KCl, выправляют этот дефект, снижая к тому же потери титранта за счет доннановского распределения.
В-третьих, при титровании ионитов в среде разбавленных индифферентных электролитов может наблюдаться суспензионный эффект, заключающийся в различии рН суспензии смолы и находящегося в равновесии с ней раствора. В случае суспензий и паст ионитов он может достигать 1—3 единиц рН, быстро уменьшаясь с ростом концентрации индифферентного электролита.
В-четвертых, в отличие от растворимых кислот или оснований, свойства ионита существенно изменяются в результате повышения суммарного заряда фиксированных ионов и изменения набухаемости при добавлении каждой порции титранта. В результате отрыв следующих противоионов затрудняется и кислотно-основные свойства ионитов по мере увеличения степени нейтрализации ослабевают. По этой причине константа ионизации слабоосновных анионитов и слабокислотных катионитов не является постоянной величиной и зависит от степени нейтрализации.
Следует отметить, что время установления равновесия обмена в реальных условиях потенциометрического титрования меняется в широком интервале в зависимости от константы ионизации активных групп и строения матрицы. Для сильнокислотных катионитов или сильноосновных анионитов оно не больше 1—2 ч, для слабокислотных катионитов или слабоосновных анионитов достигает (особенно вблизи точки эквивалентности) нескольких недель. Поэтому для ускорения работы берут большое число навесок ионита, соответствующее числу планируемых экспериментальных точек на кривой потенциометрического титрования.
Для количественных расчетов при титровании многие авторы применяют уравнение Гендерсона-Гассельбаха:
. (1)
в котором α будет соответствовать степени нейтрализации ионита (т. е. доле нейтрализованных активных групп) на разных стадиях титрования, а рН — концентрации ионов водорода в фазе ионита [4].
Выбор объектов исследования
С развитием теории и практики ионного обмена все большее внимание уделяется комплексообразующим смолам, способным к избирательному поглощению одного или нескольких видов ионов.
В настоящее время накопилась достаточно много информации о синтезе комплексообразующих ионитов, влиянии состава раствора, химической и физической природы ионитов на процесс сорбции, о свойствах образующихся соединений. Теоретическим и практическим исследованиям по этой теме посвящено большое число работ, однако изложенные в них результаты требуют обобщения и дальнейшего развития. Поэтому в данной работе нами были изучены физико-химические и кислотно-основные свойства ионитов. Для исследования были взяты аниониты Synthes EV 013 и SXR 002, синтезированные НПО «Синтез» г. Санкт-Петербург.
Ионит перед работой следует подвергать предварительной обработке, то есть кондиционированию, с целью удаления органических и минеральных примесей.
Воздушно-сухой сорбент подвергают набуханию в насыщенном растворе хлорида натрия в течение суток. Затем раствор сливают, сорбент промывают дистиллированной водой до тех пор, пока вода на выходе не будет давать отрицательную реакцию на хлорид-ионы. Реактивом на хлорид-ионы является раствор нитрата серебра.
Далее сорбент заливают 2М раствором соляной кислоты, после чего промывают дистиллированной водой до слабокислой реакции (рН 3-4).
Следующая стадия кондиционирования — обработка ионита 2М раствором гидроксида натрия, после чего их промывают дистиллированной водой до слабощелочной реакции (рН 8—9). Затем промывают ионит спиртом (1:1).
После кондиционирования сорбент переводят сначала в OH‾-форму, потом в Cl‾-форму.
Переведение в ОН-. Предварительно оттитрованным раствором 2М NaОH 0,2N HCl (приготовленной из фиксанала) насыщаем анионит. Промываем его раствором до тех пор, пока концентрация вливаемого и выходящего гидроксида натрия не станут равны. Пробу в присутствии 2 капель 5N фенолфталеина оттитровываем 0,2N HCl. После этого промываем ионит спиртом и высушиваем на фильтровальной бумаге.
Переведение в Cl-. Промываем анионит водой, далее выполняем насыщение согласно предыдущей методике. Пробы кислоты оттитровываем в присутствии фенолфталеина 0,2N NaOH. После насыщения анионит промывается спиртом и сушится на фильтровальной бумаге.
В колбы на 50—100 мл вносят по 0,5 г воздушно-сухого ионита в OH- или Cl- формах. Навески заливают соответствующими растворами 0,25М NaOH (для ионитов в Cl- форме) и 0,25М NaCl (для ионитов в OH- форме). Количества растворов приведены в таблице 1.
Таблица 1.
Количества растворов для потенциометрического титрования ионитов в ОН- - форме и анионита в Cl- - форме
|
№ колбы |
V (0,2М NaCl), мл |
V (0,2М HCl), мл V (0,2М NaОН), мл |
|
1 |
50,0 |
0 |
|
2 |
45,0 |
5,0 |
|
3 |
40,0 |
10,0 |
|
4 |
35,0 |
15,0 |
|
5 |
30,0 |
20,0 |
|
6 |
25,0 |
25,0 |
|
7 |
20,0 |
30,0 |
|
8 |
15,0 |
35,0 |
|
9 |
10,0 |
40,0 |
|
10 |
5,0 |
45,0 |
|
11 |
0 |
50,0 |
Колбы перемешивают, закрывают крышками и оставляют стоять до установления равновесия (не менее 24 часов).
Затем готовят те же растворы, но без ионитов, и измеряют их pH.
Через 24 часа, измеряют pH растворов с ионитами. По полученным данным строят кривые титрования.
Обсуждение результатов
Физико-химические свойства анионитов представлены в таблице 2.
Таблица 2.
Физико-химические свойства образцов ионитов
|
Образец ионита |
Параметр |
|
|
Гигроскопичность — Х,% |
Набухаемость — Н |
|
|
EV 013 |
10,1 |
0,54 |
|
SXR 002 |
12,6 |
0,42 |
Как следует из этой таблицы, образцы сорбентов обладают хорошими физико-химическими характеристиками, т. е. достаточной набухаемостью, способной обеспечить хорошую сорбционную способность ионитов.
Проникновение воды в фазу сорбента вызывает диссоциацию полярных групп, вследствие чего противоионы получают возможность обмениваться на ионы контактирующего раствора, что характеризуется гигроскопичностью сорбентов.
Таким образом, полученные физико-химические характеристики исследуемых образцов позволяют ожидать в дальнейшем их высокую сорбционную способность при извлечении ионов цветных и благородных металлов.
Результаты потенциометрического титрования представлены на рисунках -2 -5.
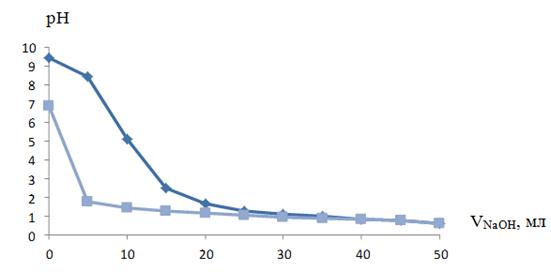
Рисунок 2. Кривая потенциометрического титрования анионитов EV 013 в OH--форме

Рисунок 3. Кривая потенциометрического титрования анионитов EV 013 в Cl--форме

Рисунок 4. Кривая потенциометрического титрования анионитов SXR 002 в OH--форме

Рисунок 5. Кривая потенциометрического титрования анионитов SXR 002 в Cl--форме
Далее нами были рассчитаны по уравнению Гендерсона-Гассельбаха (1) кажущиеся константы кислотно-основного равновесия, представленные в таблицы 3.
Таблица 3.
Значения кажущихся констант кислотно-основного равновесия, рассчитанные по данным потенциометрического титрования
|
Анионит |
|||
|
EV 013 |
SXR 002 |
||
|
Исходная форма |
|||
|
Cl- |
OH- |
Cl- |
OH- |
|
pK |
|||
|
2,06 |
9,45 |
2,48 |
9,23 |
|
7,72 |
8,76 |
11,77 |
8,09 |
|
8,73 |
5,13 |
12,42 |
4,35 |
|
9,49 |
2,50 |
12,72 |
1,79 |
|
9,81 |
1,66 |
12,86 |
1,60 |
|
9,98 |
1,27 |
13,03 |
1,34 |
|
10,10 |
1,10 |
13,13 |
1,17 |
|
10,27 |
1,01 |
13,15 |
1,0 |
|
10,23 |
0,82 |
13,24 |
1,01 |
|
10,35 |
0,76 |
13,29 |
0,71 |
|
10.41 |
0,61 |
13,16 |
0,61 |
На основании проведенного исследования можно сделать вывод:
1. Установлено, что образцы сорбентов обладают хорошими физико-химическими характеристиками, т. е. достаточной набухаемостью, способной обеспечить хорошую сорбционную способность ионитов.
2. Проведено потенциометрическое титрование исследуемых опытных образцов и построены кривые потенциометрического титрования анионитов в различных формах.
3. Рассчитаны кажущиеся константы ионизации анионитов Synthes EV 013 и SXR 002 в различных формах.
4. Образцы сорбентов являются анионитами смешанного типа. В структуре этих ионитов присутствуют как группы сильноосновного характера, так и слабоосновные аминогруппы.
5. Полученные результаты позволяют ожидать успешного применения исследованных опытных образцов для извлечения ионов благородных и цветных металлов из растворов.
Список литературы:
1.Гельферих Ф. Иониты. Основы ионного обмена / Ф. Гельферих. — М.: Изд. иностранной литературы, 1962. — 492 с.
2.Иониты и ионный обмен: Сборник статей / Под ред. Г.В. Самсонова. — Л.: Наука, 1985. — 230 с.
3.Кононова О.Н. Применение хелатных и амфотерных ионитов в анализе и технологии редких металлов./О.Н. Кононова. — Красноярск: КГУ, 1981. — 40 с.
4.Полянский Н.Г. Методы исследования ионитов / Н.Г. Полянский, Г.В. Горбунов, Н.Л. Полянская. — М.: Химия, 1976. — 208 с.
дипломов


Оставить комментарий