Статья опубликована в рамках: XXXVI-XXXVII Международной научно-практической конференции «Естественные и математические науки в современном мире» (Россия, г. Новосибирск, 07 декабря 2015 г.)
Наука: Биология
Секция: Молекулярная биология
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
Статья опубликована в рамках:
Выходные данные сборника:
ОЦЕНКА ТРАНСФЕКЦИОННОЙ СПОСОБНОСТИ ПРОИЗВОДНЫХ ХИТОЗАНА В КАЧЕСТВЕ НОСИТЕЛЕЙ ДЛЯ ДОСТАВКИ КОРОТКИХ ИНТЕРФЕРИРУЮЩИХ РНК
Петрова Александра Валерьевна
м.н.с. «НИИ Гриппа» Минздрава России,
РФ, г. Санкт-Петербург,
аспирант ИФНИТ, СПбПУ им. Петра Великого,
РФ, г. Санкт-Петербург,
E-mail:
Горшков Андрей Николаевич
канд. биол. наук, с.н.с. «НИИ Гриппа» Минздрава России,
РФ, г. Санкт-Петербург,
E-mail:
Егоров Владимир Валерьевич
канд. биол. наук, в.н.с. «НИИ Гриппа» Минздрава России,
РФ, г. Санкт-Петербург,
E-mail:
Бондаренко Андрей Борисович
биологический факультет, СПбГУ, РФ, г. Санкт-Петербург,
лаб.иссл. «НИИ Гриппа» Минздрава России,
РФ, г. Санкт-Петербург
E-mail:
Шурыгина Анна-Полина Сергеевна
канд. биол. наук, c.н.с. «НИИ Гриппа» Минздрава России,
РФ, г. Санкт-Петербург,
E-mail:
Грудинина Наталья Андреевна
канд. биол. наук, с.н.с., ФГБНУ «ИЭМ»,
РФ, г. Санкт-Петербург,
Васин Андрей Владимирович
канд. биол. наук, зав.лаб. структурной и функциональной протеомики
«НИИ Гриппа» Минздрава России, РФ, г. Санкт-Петербург,
доцент, ИФНИТ, СПбПУ им. Петра Великого,
РФ, г. Санкт-Петербург,
E-mail:
CHITOSAN DERIVATIVES, AS CARRIERS FOR SYNTHETIC SHORT INTERFERING RNA CELL DELIVERY
Alexandra Petrova
junior researcher "Influenza Research Institute" Russian Health Ministry, Russian Federation, Saint-Petersburg,
IFNIT graduate student, Peter the Great Polytechnic University,
Russia, Saint-Petersburg
Andrei Gorshkov
PhD, senior researcher "Influenza Research Institute" Russian Health Ministry,
Russia, St. Petersburg,
Vladimir Egorov
PhD, leading researcher "Influenza Research Institute" Russian Health Ministry,
Russia, St. Petersburg,
Andrey Bondarenko
Department of Biology, St. Petersburg State University,
Russian Federation, St. Petersburg,
Lab assistant, "Influenza Research Institute" Russian Health Ministry,
Russia, Saint-Petersburg
Anna-Polina Shurygina,
PhD, senior researcher, "Influenza Research Institute" Russian Health Ministry,
Russia, St. Petersburg,
Grudinina Natalya
PhD, senior researcher, “Institute of Experimental Medicine”,
Russia, St. Petersburg
Andrei Vasin,
PhD, head of the laboratory of structural and functional proteomics
"Influenza Research Institute" Russian Health Ministry,
Russian Federation, St. Petersburg,
Associate Professor, IFNIT, Peter the Great Polytechnic University,
Russia, St. Petersburg.
Данная работа выполнена при финансовой поддержке РНФ (грант № 15-15-00170 «Клеточные микроРНК – новые молекулярные мишени для терапии тяжелых вирусных инфекций».
АННОТАЦИЯ
В данной работе были изучены свойства коммерческих и синтетических производных хитозана при их использовании в качестве поликатионных носителей для доставки коротких интерферирующих РНК (киРНК) в клетки MDCK и HEK293. Была оценена способность носителей к образованию стабильных комплексов с киРНК, а также токсичность ряда коммерческих производных хитозана – хитозан метилгликоля MGly, хитозан гидрохлорида HCl, хитозан олиголактата OL (Sigma), а также модифицированного хитозана Q-348, обогащённого четвертичными аминогруппами, синтезированного в НИИ нефтехимического синтеза им. А.В. Топчиева РАН. Ранняя динамика проникновения, скорость и эффективность доставки киРНК с флуоресцентной меткой в клетки была показана различными методами, включая флуоресцентную и конфокальную микроскопию, а также проточную цитофлуориметрию для хитозанов MGly и Q-348.
ANNOTATION
In this study several commercial and synthetic chitosan derivatives were investigated as polycationic carriers for delivery of short interfering RNAs (siRNAs) on MDCK and HEK293 cell models. Several commercial derivatives of chitosan such as chitosan methylglycol MGly, chitosan hydrochloride HCl, chitosan oligolaktat OL (Sigma), and one synthetic modified chitosan Q-348 enriched quaternary amine, which was made in the Institute of Petrochemical Synthesis Topchieva A.V. RAS, were estimated to form stable polyplexes with siRNA. For all of them the toxicity was estimated as well. The early dynamics, efficiency and speed of fluorescently labeled siRNA delivery was shown and determine by different methods including fluorescent and confocal microscopy and cytofluorometry for only two chitosan MGly and chitosan Q-348.
Ключевые слова: киРНК; поликатионные носители; хитозан; флуоресценция; эндосомальная доставка.
Key words: siRNA; polycations; chitosan; fluorescence; endosomal escape.
РНК-интерференция – это молекулярный механизм регуляции экспрессии генов, опосредованный комплементарным взаимодействием коротких двунитевых РНК с мРНК гена мишени, с последующей остановкой транскрипции при помощи белкового комплекса RISC. Этот процесс с участием эндогенных малых РНК происходит конститутивно в любых эукариотических клетках. А также было показано, что синтетические короткие интерферирующие РНК (киРНК), введенные в клетку, распознаются RISC и могут блокировать мРНК, препятствуя трансляции белков [1].
В последние годы интенсивно изучается подход, основанный на целенаправленном введении киРНК в качестве лекарственного препарата, против многих острых респираторных инфекций, включая грипп [2]. Такой подход является перспективным вследствие высокой специфичности киРНК, отсутствием токсичности у киРНК и возможностью обойти резистентность вируса к такому препарату. Основной проблемой создания такого рода препаратов является правильный выбор носителя для стабильной и эффективной доставки киРНК в клетку. В случае вируса гриппа А (ВГА) человека наиболее эффективным должен быть носитель, подходящий для интраназального введения препарата, так как этот путь минимизирует системную потерю киРНК, доставляя их специфически к месту локализации ВГА-клеткам верхних дыхательных путей. В качестве средства доставки часто используются поликатионные полимеры, способные связывать большое количество киРНК за счет своих положительных зарядов, а также обеспечивающие защиту РНК от нуклеаз клетки. Особо перспективным носителем для доставки киРНК в клетки представляется хитозан и его производные, так как этот природный полимер обладает низкой цитотоксичностью, биодеградируемостью, хорошей биосовместимостью. Хитозан способен связывать нуклеиновые кислоты с образованием стабильных комплексов, размер которых составляет 100–200 нм. Частицы такого размера успешно эндоцитируются эпителиальными клетками. Эффективность хитозан-опосредованной трансфекции определяется способностью комплексов хитозана с киРНК выходить из эндосомального компартмента в цитоплазму (endosomal escape), где и осуществляется киРНК-интерференция. Молекулярная основа endosomal escape в случае хитозана детально не исследована, однако предполагается, что разрыв мембраны эндосомы осуществляется по механизму «протонной губки», аналогично ряду других поликатионов [3].
В нашей работе была исследована способность к комплексообразованию с дц киРНК ряда коммерческих производных хитозана: хитозана метилгликоля MGly (Sigma), хитозана гидрохлорида HCl (Sigma), хитозана олиголактата OL (Sigma), а также модифицированного хитозана Q-348, обогащённого четвертичными аминогруппами. Хитозан Q-348 был синтезирован в НИИ нефтехимического синтеза им. А.В. Топчиева РАН. Также для всех производных хитозана была определена токсичность на клеточной модели MDCK; и оценена способность и динамика попадания в клетку комплексов хитозан-киРНК на клеточной модели MDCK.
В качестве модельной киРНК, для решения задач визуализации, мы использовали синтетические дц киРНК, содержащие флуоресцентную метку на 3’- конце.
Для создания комплексов киРНК с поликатионами смешивались равные объемы водных растворов киРНК и растворов поликатионов с различной концентрацией, чтобы получить следующие соотношения N/P (азотных групп поликатиона к фосфатным группам РНК, в расчёте на один нуклеотид и одно мономерное звено): 1/32, 1/16, 1/8, 1/4 ,1/2, 1/1, 2/1, 4/1,8/1, 80/1. Комплексы эффективно перемешивались встряхиванием, осаждались с помощью микроцентрифугирования и инкубировались при комнатной температуре в течение 1 часа. Проверка связывания киРНК с поликатионом осуществлялась методом электрофоретического разделения в 15 % полиакриламидном геле по гашению флуоресценции бромистого этидия для дцРНК, связанной в комплекс с поликатионом. Было показано, что минимальное соотношение N/P, при котором экранируется полностью дц киРНК в комплексе, составляет 2/1 для хитозана Q-348, и 4/1 для хитозана MGly. Для остальных коммерческих производных хитозана соотношение N/P =80/1 оказалось недостаточным для полного экранирования киРНК; и как следствие эти поликатионы были признаны неэффективными для комплексов с киРНК.
Токсичность полученных растворов поликатионов определяли при помощи микротетразолиевого теста (МТТ) после 24 часов инкубации клеток MDCK с растворами поликатионов, добавленных в среду в трехкратном разведении. Оптическую плотность измеряли в лунках планшетов на планшетном ридере Victor 1420 (Perkin Elmer, Финляндия) на длине волны 535 нм. LD50 для монослоя MDCK в лунках 96 луночного планшета (105 клеток) составила: 188 мкг/мл для хитозана Q-348; 8,2 мг/мл для хитозана MGly; 3,8 мг/мл хитозана OL; 6,6 мг/мл хитозана HCl.
По совокупности данных анализа были отобраны для дальнейшей оценки доставки в клетку только хитозан метилгликоль и Q-348, так как способны образовывать стабильный комплекс с киРНК в концентрациях, не токсичных для клеток.
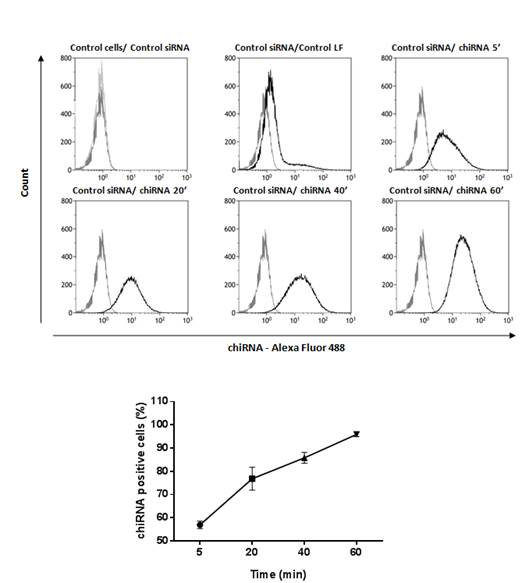
Рисунок 1. Данные проточной цитофлуориметрии для хитозана Q-348. Популяция клеток MDCK содержащая флуоресцентно-меченную киРНК, после 5, 20, 40 и 60 минут инкубации клеток в среде, содержащей комплексы хитозан-РНК
Проникновение комплекса хитозан-киРНК в клетки MDCK оценивалось по данным флуоресцентной микроскопии фиксированных клеток с окраской актина в различные временные интервалы после внесения комплекса в среду от 1 минуты до 24 часов. Было показано наличие и накопление комплексов в цитоплазме начиная с первой минуты эксперимента и до 20 минут. При помощи лазерной проточной цитофлуориметрии («BD FacsCanto2», США) было показано, что 93,5+∆1,5 % клеток содержат комплекс с флуоресцентной меткой после 60 минут инкубации клеток с комплексами (рис.1). Также было показано, что скорость накопления комплексов в клетках не зависит от дозы киРНК в комплексах. Также было подтверждено накопление комплексов хитозан-РНК с флуоресцентной меткой, начиная с первой минуты после внесения, данными микроскопии в режиме реального времени на конфокальном микроскопе (Carl Zeiss, Германия) на клеточных моделях MDCK и HEK249.
Список литературы:
- Ryther R.C.C., Flynt A.S., Phillips J.A., & Patton J.G. (2005). siRNA therapeutics: big potential from small RNAs. Gene therapy, 12(1), 5–11.
- Ge Q., McManus M.T., Nguyen T., Shen C.H., Sharp P.A., Eisen H.N., & Chen J. (2003). RNA interference of influenza virus production by directly targeting mRNA for degradation and indirectly inhibiting all viral RNA transcription. Proceedings of the National Academy of Sciences, 100(5), 2718–2723.
- Richard I., Thibault M., De Crescenzo G., Buschmann M. D., & Lavertu M. (2013). Ionization behavior of chitosan and chitosan–DNA polyplexes indicate that chitosan has a similar capability to induce a proton-sponge effect as PEI. Biomacromolecules, 14(6), 1732–1740.
дипломов


Оставить комментарий