Статья опубликована в рамках: XXXIV Международной научно-практической конференции «Естественные и математические науки в современном мире» (Россия, г. Новосибирск, 07 сентября 2015 г.)
Наука: Биология
Секция: Медицинская биология
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
Статья опубликована в рамках:
Выходные данные сборника:
МОРФОЛОГИЧЕСКИЕ ОСОБЕННОСТИ СТРОЕНИЯ ЯИЧНИКОВ ПРИ СВИНЦОВОЙ ИНТОКСИКАЦИИ
Дуденкова Наталья Анатолиевна
ассистент кафедры биологии, географии и методик обучения
ФГБОУ ВПО «Мордовский государственный педагогический институт имени М.Е. Евсевьева»,
РФ, г. Саранск
E-mail: natalya-dudenkova@yandex.ru,
E-mail: dudenkova_nataly@mail.ru
Шубина Ольга Сергеевна
доктор биологических наук, профессор, зав. кафедрой биологии, географии и методик обучения
ФГБОУ ВПО «Мордовский государственный педагогический институт имени М.Е. Евсевьева»,
РФ, г. Саранск
E-mail: o.shubina@mail.ru
Комарова Нина Анатольевна
канд. биол. наук, доцент кафедры теории и методики физической культуры и спорта
ФГБОУ ВПО «Мордовский государственный педагогический институт имени М.Е. Евсевьева»,
РФ, г. Саранск
E-mail:
THE MORPHOLOGICAL FEATURES OF THE OVARIES DURING LEAD INTOXICATION
Natalia Dundekova
assistant of the Department of biology, geography and teaching methods
Federal State Budgetary Educational Institution of Higher Professional Education “Mordovian State Pedagogical Institute named after M.E. Evsevjev”,
Russia, Saransk
Olga Shubina
doctor of biological Sciences, Professor, head of the Department of biology, geography and methods of teaching
Federal State Budgetary Educational Institution of Higher Professional Education “Mordovian State Pedagogical Institute named after M.E. Evsevjev”,
Russia, Saransk
Nina Komarova
candidate of biological Sciences, assistant professor of the Department of theory and methodology of physical culture and sports
Federal State Budgetary Educational Institution of Higher Professional Education “Mordovian State Pedagogical Institute named after M.E. Evsevjev”,
Russia, Saransk
Работа проводилась при финансовой поддержке Минобрнауки РФ в рамках государственного задания ФГБОУ ВПО «Мордовский государственный педагогический институт имени М.Е. Евсевьева» (проект «Влияние антропогенных факторов на морфофункциональное состояние организма»).
АННОТАЦИЯ
С помощью гистологических и морфометрических методов исследования изучали влияние ацетата свинца на яичники самок белых крыс в период постнатального онтогенеза. После проведенных исследований выявлено, что после 7 суток воздействия ацетата свинца происходит морфологическая перестройка коркового и мозгового вещества яичника. В корковом веществе ярко выражена атрезия вторичных фолликулов. Установлено, что атрезии чаще подвергались вторичные фолликулы. Мозговое вещество содержит более крупные сосуды, что свидетельствует об усилении кровоснабжения яичников.
ABSTRACT
Using histological and morphometric methods of research studied the effect of lead acetate on the ovaries of females of white rats during postnatal ontogenesis. After research revealed that after 7 days of exposure of lead acetate occurs morphological restructuring of cortex and medulla of the ovary. In the cortex pronounced atresia of secondary follicles. Found that atresia was often subjected to secondary follicles. The medulla contains large blood vessels, which indicates an increase of blood supply to the ovaries.
Ключевые слова: яичники; однослойный эпителий; белочная оболочка; мозговое вещество яичника; корковое вещество яичника; фолликулярный аппарат; менструальное желтое тело; ацетат свинца.
Keywords: the ovaries; single-layered epithelium; protein shell; the medulla of the ovary; the cortical substance of the ovary; follicular apparatus; menstrual yellow body; lead acetate.
Введение.
Ухудшающаяся экологическая ситуация в настоящее время является одним из главных факторов нарушения репродуктивной функции человека и животных [6, с. 28]. Среди наиболее опасного антропогенного загрязнения окружающей среды, лидирующие позиции занимает свинец и его соединения [4, с. 128; 5, с. 29], экзогенное воздействие которого на репродуктивную систему организма является важным аспектом в прогнозировании и предупреждении патологии беременности и родов [7, с. 228]. В проведенных нами ранее исследованиях было детально описано влияние соединений свинца на мужскую репродуктивную систему, в том числе и на ее репродуктивную способность [2, с. 1258; 3, с. 55; 11, с. 230; 12, с. 1620]. Однако недостаточно сведений о влиянии свинцовой интоксикации на женскую репродуктивную систему, и в частности на яичники.
Целью работы явилось изучение влияния свинцовой интоксикации на морфологическую структуру яичников самок белых крыс.
Материал и методы исследования.
В качестве биологического тест-объекта в работе использовали самок белых беспородных половозрелых крыс массой 200—250 г. в возрасте от 60 суток, так как, согласно литературным данным, примерно в это время у крыс наступает период полового созревания [1, с. 23; 9, с. 163]. Всего использовано 50 животных.
Выбор белых крыс для проведения исследования обусловлен тем, что они обладают сходными с человеком строением женских половых желез, а также протеканием в них процесса фолликулогенеза.
Эксперимент проводился в течение года в помещении при температуре воздуха 22—25 °C и относительной влажности 67—70 %. Животные находились на общем режиме вивария, имели свободный доступ к корму и воде.
В соответствии с поставленными задачами животные разбивались на две группы. Контрольную группу животных составили самки крыс, содержащихся на общем режиме вивария. Опытную группу составили животные, получавшие в течение 7 суток перорально ацетат свинца Pb(CH3COO)2×3H2O в среднетоксической дозе — 45 мг/кг/сутки (в пересчете на свинец).
Животные забивались путем декапитации под наркозом эфира с хлороформом (1:1) с соблюдением принципов гуманности, изложенных в директивах Европейского сообщества (86/609/ЕЕС) и Хельсинкской декларации, и в соответствии с требованиями правил проведения работ с использованием экспериментальных животных.
Для более точного исследования яичников самок белых крыс забивали в стадию диэструса, которая характеризуется как стадия активности желтого тела [10, с. 5].
Материалом исследования служили яичники половозрелых самок белых крыс. Для гистологического исследования образцы тканей половых желез фиксировали в 10%-ном растворе нейтрального формалина. Зафиксированные образцы после промывки в проточной воде подвергали обезвоживанию путем помещения исследуемого материала в спирты возрастающей концентрации. Заливали в парафин по общепринятой методике. Готовили гистологические поперечные срезы яичников толщиной 10—15 мкм, окрашивали их гематоксилином и эозином [8, с. 125]. Образцы тканей исследовали с помощью цифрового микроскопа Axio Imager.M2 (ZEISS, Япония) с программным обеспечением для анализа изображений AxioVision SE 64Rel. 4.8.3 и ZEN 2011.
При обзорной микроскопии проводили морфологический анализ структурных тканевых компонентов яичников крысы, после чего изучали следующие их морфометрические параметры: толщину однослойного эпителия, покрывающего яичник снаружи; толщину белочной оболочки яичника; площадь поперечного среза яичника; площадь и толщину коркового и мозгового вещества яичника; количество разных типов фолликулов и менструальных желтых тел в корковом веществе яичника; толщину кровеносных сосудов, пронизывающих мозговое вещество яичника.
Морфометрические измерения яичников производили при увеличении 5×10, 20×10 и 100×10. Фотосъемку препаратов производили при помощи встроенной цифровой камеры AxioCam MRc5 (ZEISS, Япония).
Разрешение полученных изображений — 1300×1030 пикселей.
Статистическая обработка цифровых данных проводилась с помощью программ FStat и Excel. Проверка статистических гипотез осуществлялась по t-критерию Стьюдента.
Все наблюдаемые различия считали достоверными при уровне значимости P≤0,05.
Результаты исследования и их обсуждение.
Проведенные гистологические и морфометрические исследования позволили выявить состояние основных структур яичников белых крыс — фолликулов, менструальных желтых тел, а также кровеносных сосудов, как в контроле, так и в опыте.
В результате проведенных исследований показано, что контроле клетки покрывающего яичник снаружи однослойного эпителия имеют кубическую форму. Белочная оболочка имеет однородную структуру. Она слабо васкуляризирована (рис. 1). Хорошо различимы корковый и мозговой слои яичника (рис. 2).
В корковом веществе яичника фолликулы находятся на разных стадиях развития: от примордиальных и вплоть до зрелых третичных фолликулов. Примордиальные фолликулы располагаются в виде компактных групп непосредственно под белочной оболочкой яичника. Лишь изредка встречаются одиночные примордиальные фолликулы. Местами встречаются атретические фолликулы. Фолликулы в большинстве случаев имеют округлую форму (рис. 3). Между фолликулами располагается соединительнотканная строма яичника. Клетки соединительнотканной стромы коркового вещества яичника имеют веретенообразную форму (рис. 4).
После проведенных исследований выявлено, что в контроле менструальные желтые тела располагаются равномерно в корковом веществе яичника. Они покрыты соединительнотканной капсулой, от которой к центру направляются тонкие прослойки, содержащие кровеносные и лимфатические сосуды. Обнаруженные менструальные желтые тела имеют округлую или овальную форму. Большинство из них находятся в стадии образования или зрелости (рис. 5).
После проведенных исследований, было выявлено, что мозговое вещество яичника невелико по сравнению с корковым. Оно хорошо васкуляризировано. Небольшие кровеносные сосуды проходят из мозгового вещества в корковое. Соединительнотканная основа мозгового вещества яичника не упорядочена (рис. 6).
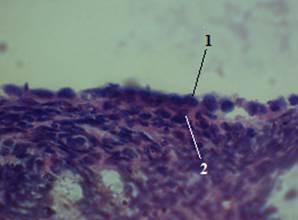
Рисунок 1. Поверхность яичника крысы (контроль). Об. 100 × ок. 10. Окраска гематоксилин-эозин: 1 — однослойный эпителий; 2 — белочная оболочка.

Рисунок 2. Поперечный срез яичника крысы (контроль). Об. 5 × ок. 10. Окраска гематоксилин-эозин: 1 – корковое вещество яичника; 2 – мозговое вещество яичника
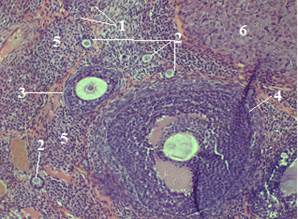
Рисунок 3. Корковое вещество яичника крысы (контроль). Об. 20 × ок. 10. Окраска гематоксилин-эозин: 1 — примордиальные фолликулы; 2 — первичные фолликулы; 3 — вторичные фолликулы; 4 — третичные фолликулы; 5 — соединительнотканная основа; 6 — менструальное желтое тело

Рисунок 4. Клетки соединительно-тканной стромы яичника крысы (контроль). Четко видно, что они имеют веретенообразную форму. Об. 100 × ок. 10. Окраска гематоксилин-эозин
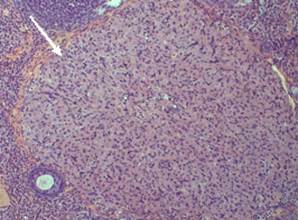
Рисунок 5. Менструальное жёлтое тело в корковом веществе яичника крысы (контроль). Об. 20 × ок. 10. Окраска гематоксилин-эозин

Рисунок 6. Мозговое вещество яичника крысы (контроль). Об. 100 × ок. 10. Окраска гематоксилин-эозин: 1 — соединительнотканная основа; 2 — кровеносный сосуд
В ходе проведенных исследований выявлено, что после 7 суток перорального воздействия ацетата свинца на организм самок белых крыс клетки однослойного эпителия, покрывающего яичник крысы снаружи, имеют более удлиненную форму. Белочная оболочка яичника крысы обладает более плотной структурой (рис. 7). Отмечается увеличение объема мозгового вещества яичника крысы по отношению к корковому (рис. 8).

Рисунок 7. Поверхность яичника крысы (опыт). Об. 100 × ок. 10. Окраска гематоксилин-эозин: 1 — однослойный эпителий; 2 — белочная оболочка
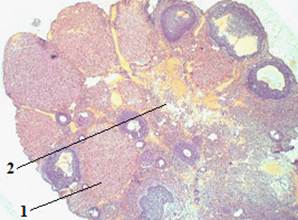
Рисунок 8. Поперечный срез яичника крысы (опыт). Окраска гематоксилин-эозин. Об. 5 × ок. 10: 1 — корковое вещество яичника; 2 — мозговое вещество яичника
Примордиальные фолликулы в корковом веществе яичника крысы располагаются преимущественно одиночно (рис. 9). Обращает на себя внимание высокое содержание атретических фолликулов. Атрезии чаще подвергались вторичные растущие фолликулы, реже третичные фолликулы (рис. 10). Среди более зрелых форм фолликулов, часто встречаются фолликулы овальной и неправильной формы (рис. 11, 12).

Рисунок 9. Корковое вещество яичника крысы (опыт). Об. 20 × ок. 10. Окраска гематоксилин-эозин: 1 — примордиальные фолликулы; 2 — первичные фолликулы; 3 — вторичные фолликулы; 4 — третичные фолликулы; 5 — соединительнотканная основа; 6 — менструальное желтое тело
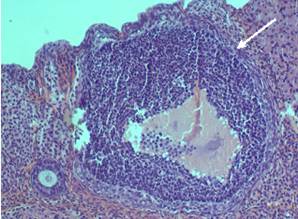
Рисунок 10. Атретический фолликул в корковом веществе яичника крысы (опыт). Об. 20 × ок. 10. Окраска гематоксилин-эозин
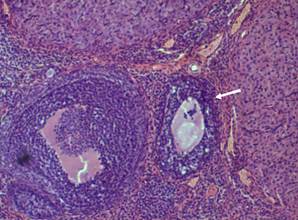
Рисунок 11. Вторичный фолликул в корковом веществе яичника крысы (опыт). Об. 20 × ок. 10. Окраска гематоксилин-эозин

Рисунок 12. Третичный фолликул в корковом веществе яичника крысы (опыт). Об. 20 × ок. 10. Окраска гематоксилин-эозин
Обнаруженные в корковом веществе яичника крысы менструальные желтые тела имели неправильную форму (рис. 13).
После 7 суток перорального воздействия ацетата свинца в мозговом веществе яичника крысы обнаружены более крупные сосуды, чем в контроле, что свидетельствует об усилении их кровоснабжения (рис. 14).
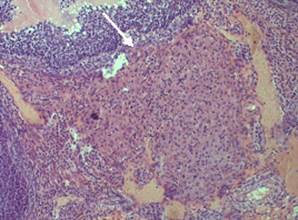
Рисунок 13. Менструальное жёлтое тело в корковом веществе яичника крысы (опыт). Об. 20 × ок. 10. Окраска гематоксилин-эозин
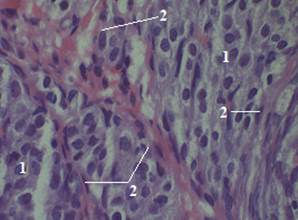
Рисунок 14. Мозговое вещество яичника крысы (опыт). Об. 100 × ок. 10. Окраска гематоксилин-эозин: 1 — соединительнотканная основа; 2 — кровеносные сосуды
Морфометрические исследования показали, что в опытной группе животных, по сравнению с контролем, происходит уменьшение толщины покрывающего яичник крысы снаружи однослойного эпителия, толщины белочной оболочки яичника крысы, толщины и площади коркового вещества яичника крысы соответственно на 35,55 % (P≤0,05), 13,88 % (P≤0,05), 12,04 % (P≤0,05) и 6,18 %. В то же время наблюдалось увеличение площади поперечного среза яичника крысы, площади и толщины его мозгового вещества, а также толщины пронизывающих мозговое вещество яичника крысы кровеносных сосудов, соответственно на 2,85 %, 30,03 % (P≤0,05), 19,01 % (P≤0,05) и 34,02 % (Р≤0,05) (табл. 1).
Количественный анализ фолликулярного аппарата яичников самок белых крыс показал, что в опытной группе животных, по сравнению с контролем, происходит снижение количества примордиальных, первичных, вторичных, третичных фолликулов и менструальных желтых тел соответственно на 15,12 % (P≤0,05), 18,73 % (P≤0,05), 44,32 % (P≤0,05), 49,43 % (P≤0,05) и 45,30 % (P≤0,05). В то же время наблюдалось увеличение количества атретических фолликулов на 66,23 % (P≤0,05) (табл. 2).
Таблица 1.
Макроскопические показатели яичников самок белых крыс
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Примечание: * — P≤0,05 по сравнению с контрольными животными
Таблица 2.
Количественные показатели структурных компонентов коркового вещества яичников самок белых крыс
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Примечание: * — P≤0,05 по сравнению с контрольными животными
Выводы.
Воздействие ацетата свинца приводит к следующим морфологическим и морфометрическим изменениям яичников самок белых беспородных крыс:
1. уменьшается толщина покрывающего яичник крысы снаружи однослойного эпителия;
2. уменьшается толщина белочной оболочки яичника крысы;
3. уменьшается площадь и толщина коркового вещества яичника крысы, при одновременном увеличении площади и толщины мозгового вещества;
4. в корковом веществе яичника крысы уменьшается количество примордиальных, первичных, вторичных, третичных фолликулов и менструальных желтых тел, при одновременном увеличении количества атретических фолликулов;
5. увеличивается диаметра кровеносных сосудов, пронизывающих мозговое вещество яичника крысы.
Таким образом, анализ результатов проведенных исследований позволяет сделать вывод о том, что у самок белых крыс при свинцовой интоксикации отмечается морфологическая перестройка коркового и мозгового вещества яичника. Имеет место нарушение процесса фолликулогенеза, проявляющегося в снижении суммарного содержания фолликулов, изменением фолликулярного состава яичников и образования менструальных жёлтых тел. Мозговое вещество яичников крысы содержит более крупные кровеносные сосуды, что свидетельствует об усилении их кровоснабжения при свинцовой интоксикации.
Список литературы:
- Бабичев В.Н. Нейроэндокринология пола. М.: Наука, 1981. — 222 с.
- Дуденкова Н.А., Шубина О.С. Изменения морфофункционального состояния и продуктивности семенных желез белых крыс при воздействии ацетата свинца // Фундаментальные исследования. — 2013. — № 10. — С. 1253—1259.
- Дуденкова Н.А., Шубина О.С. Цитологическая оценка репродуктивной способности семенников самцов белых крыс после воздействия ацетата свинца // Современная биология: актуальные вопросы: матер. V Междунар. науч.-практ. конф., Санкт-Петербург, 13—14 февраля 2015 г. СПб.: Научный фонд «Биолог», 2015. — С. 53—56.
- Измеров Н.Ф. Свинец и здоровье. Гигиенический и медико-биологический мониторинг. М.: Медицина, 2010. — 256 с.
- Корбакова А.И., Соркина Н.С., Молодкина Н.Н., Ермоленко А.Е., Веселовская К.А. Свинец и его действия на организм (обзор литературы) // Медицина труда и промышленная экология. — 2001. — № 5. — С. 29—34.
- Паранько Н.М., Рублевская Н.И., Белицкая Э.Н., Головкова Т.А., Землякова Т.Д., Чуб Л.Е., Шматков Г.Г. Роль тяжелых металлов в возникновении репродуктивных нарушений // Гигиена и санитария. — 2002. — № 1. — С. 28—30.
- Савельева Г.В., Федорова М.В., Клименко П.А., Сичинава Л.Г. Плацентарная недостаточность. М.: Медицина, 1991. —270 с.
- Семченко В.В. Гистологическая техника. Омск: Омская медицинская академия, 2006. — 285 с.
- Шаляпина В.Г. Эндокринология репродукции. СПб.: Наука, 1991. — 192 с.
- Шейко Л.Д. Влияние малых доз шестивалентного хрома на репродуктивную функцию мелких млекопитающих: Модельный эксперимент: автореф. дис. канд. биол. наук. — Екатеринбург, 1998. — 28 с.
- Shubina O.S., Dudenkova N.A., Teltsov L.P. The effect of lead on the process of spermatogenesis in male albino rats // Ciencia e Tecnica Vitivinicola. — 2014. — Vol. 29. — № 8. — P. 225—233.
- Shubina O.S., Dudenkova N.A. Effect of Lead Acetate on the Productivity of the Seminal Glands of Male Albino Rats // Research Journal of Pharmaceutical, Biological and Chemical Sciences. — 2015. — №6 (1). — P. 1616—1621.
дипломов


Оставить комментарий