Статья опубликована в рамках: I Международной научно-практической конференции «Естественные и математические науки в современном мире» (Россия, г. Новосибирск, 24 декабря 2012 г.)
Наука: Химия
Секция: Органическая химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
ИЗУЧЕНИЕ ФЛАВОНОИДНОГО СОСТАВА ПЧЕЛИНОГО ПРОПОЛИСА
Погребняк Дарья Ивановна
студент магистр, Хакасский Государственный Университет им. Н.Ф. Катанова, г. Абакан
Бортников Сергей Валериевич
канд. хим. наук, Хакасский Государственный Университет им. Н.Ф. Катанова, г. Абакан
E-mail: ddasha29@rambler.ru
Флавоноиды в плане научного познания являются довольно молодым семейством, но эмпирическое знакомство человека с ними уходит в глубину веков, когда ещё не была известна их химическая природа.
Химическая структура флавоноидов имеет полифенольную природу. Интерес к природным флавонам связан с их выраженными антиоксидантными свойствами, для ряда флавоноидов показаны их антиаллергенные, противоспалительные, антивирусные, антибактериальные свойства и другие типы биологической активности.
Флавоноиды — это продукты метаболизма растительных клеток. Однако в природе имеются вещества богатые фенольными соединениями, являющиеся результатом жизнедеятельности и животных организмов [1]. В частности, уникальным веществом с богатым химическим составом, которое с давних пор используется человеком в лечебных целях, является продукт пчеловодства — прополис.
Прополис — универсальное бактерицидное и бактериостатическое средство, благодаря содержанию в нём нескольких десятков различных соединений, обладающих в той или иной степени антибактериальными свойствами. Антимикробная сила прополиса обусловлена веществами, собранными пчёлами с растений. По степени активности он часто превосходит антибиотики, действуя даже на антибиотикоустойчивые микроорганизмы [2].
Целью нашей работы является анализ общего содержания флавоноидов пчелиного прополиса. Исследованию были подвергнуты 4 образца пчелиного прополиса, собранные на территории Республики Хакасия, Новосибирской области, с. Залесово Алтайского края, г. Сочи (образцы 1, 2, 3, 4 соответственно).
В ходе работы нами были проведены качественные реакции на присутствие флавоноидов в образцах пчелиного прополиса. О содержании флавоноидов судили по интенсивности окрашивания реакционного раствора.
Чувствительность всех реакций позволила обнаружить соединения флавоноидной природы во всех образцах, что свидетельствует о достаточном их содержании для количественного анализа.
Таблица 1.
Окрашивание водных дисперсий прополиса в качественных реакциях на флавоноиды
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Наличие у разных групп флавоноидов цветных качественных реакций, суть которых заключается в образовании молекулярных комплексов полициклических фенолов с определенными красителями дает возможность широкому использованию для качественной и количественной оценки флавоноидов хроматографическим методом. Хроматографический анализ проводили всех образцов прополиса (хроматограммы № 1—4), а так же почек березы и тополя (хроматограммы № 5—6). С целью подтверждения предположения о том, что многие компоненты прополиса содержатся в смолистых веществах почек березы и тополя. На хроматограммах присутствуют от 3х до 6х зон абсорбции.
Содержания в прополисе большого количества соединений, в том числе и схожей химической природы, существенным образом затрудняет индивидуализацию и количественное определение отдельных групп, в частности флавоноидов.
Экстракция флавоноидов заключалась в многократной последовательной обработке растворителями органической и неорганической природы. Как показал эксперимент, содержание флавоноидов в изученных образцах прополиса составило 6,7, 4,3, 4,7 и 3,9 процентов.
Таблица 2.
Содержание флавоноидов в пчелином прополисе
|
Содержание флавоноидов, % |
|||
|
образец №1 |
образец №2 |
образец №3 |
образец №4 |
|
6,7 |
4,3 |
4,7 |
3,9 |
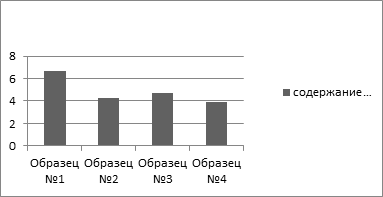
Рисунок 1. Содержание флавоноидов в пчелином прополисе
Следует отметить, что подобное содержание флавоноидов в диапазоне от 0,5 до 20 % является фармакологически пригодным. Большие количества веществ флавоноидной природы оказывают токсическое воздействие для человеческого организма.
Флавоноидный состав большинства образцов пчелиного прополиса, собранных на территории России имеет своё происхождение из смолистых веществ двух основных видов растений — тополя черного и березы повислой. В связи с этим нами были изучены спектральные характеристики флавоноидов пчелиного прополиса и экстрактов почек тополя черного и березы повислой. Для этого были получены электронные спектры спиртовых экстрактов в диапазоне от 200 до 600 нм.
Флавоноиды, являясь полициклическими, ароматическими, фенольными производными характеризуются широким спектром поглощения в видимой и УФ-области. В целом для флавоноидов характерно поглощение в области 210—600 нм.
Полученные спектры поглощения содержат две полосы: одна из них в низковолновой области (240—280 нм), другая — в более длинноволновой части (300—400 нм).
Максимумы поглощения при 245—290 нм характерны для сопряженных двойных связей в ароматическом кольце и электронным переходом в группировке атомов сопряженной гидроксильной группы. Следует отметить схожий характер полученных спектров с двумя максимумами поглощения.
Внутри каждой группы флавоноидов выявлена более «тонкая» картина зависимости положения максимумов полос поглощения от структуры соединения. Например, у ряда флавонов с одинаковым 5,7-дигидроксизамещением кольца А полоса I перемещается в более длинноволновую область по мере возрастания числа гидроксильных групп в кольце В.
Электронные спектры спиртовых экстрактов почек тополя и березы имеют схожий характер с извлечениями прополиса. Отмечается также два максимума поглощения, однако с незначительным гипсохромным смещением — полоса I при 250—280, полоса II при 305—420 нм.
Положение полос поглощения служит в некоторой степени характеристическим признаком отдельных групп флавоноидов. Так, флаваноны и флаванонолы отличаются от других групп флавоноидов положением полосы II в области 270—290 нм и наличием полосы I в виде плеча при 310—330 нм. В то время как для флавонов и флавонолов специфическим признаком служит положение полосы I в области 320—355 и 340—385 нм соответственно. Для халконов характерно положение полосы II в несколько более длинноволновой области.
В ходе данного исследования нами были обнаружены соединения флавоноидной природы, которые можно отнести к группам: флавоны, флаваноны, флавонолы и флаванонолы. Хроматографический анализ извлечений также свидетельствует о присутствии основных групп полифенолов: флавонолы, флавононы и антоцианы. Количественное содержание флавоноидов составило 6,7 %, 4,3 %, 4,7 % и 3,9 %, что является средним показателем и достаточным для использования в медицинских целях. Исследования электронных спектров спиртовых извлечений прополиса показало, что во всех случаях имеется интенсивный основной максимум поглощения при длине волны 300—400 нм (флаваноны) и «плечо» при длине волны 240—280 нм (флаваноны и гидроксикоричные кислоты). Сопоставимые спектральные характеристики обнаружены и для спиртовых извлечений почек тополя и березы, что свидетельствует о прямой генетической связи в флавоноидном составе исследуемых групп веществ.
Список литературы:
1. Золотов, Ю.А. Основы аналитической химии. Методы химического анализа. — М.: Высшая школа, 2002. — 494 с.
2. Соловьёва, В.А. Прополис, воск, мумиё, пчелиный яд. — М.: АСТ, СПб.: Астрель — СПб, 2007 — 159 с.
дипломов


Оставить комментарий