Статья опубликована в рамках: XI Международной научно-практической конференции «Научные достижения биологии, химии, физики» (Россия, г. Новосибирск, 10 сентября 2012 г.)
Наука: Химия
Секция: Неорганическая химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
ИССЛЕДОВАНИЕ СВОЙСТВ И СТРОЕНИЯ ВНУТРИКОМПЛЕКСНЫХ РАЗНОЛИГАНДНЫХ СОЕДИНЕНИЙ ЦЕРИЯ(III) С ГЛИЦИНОМ И ВИННОЙ КИСЛОТОЙ
Кулиев Асаф Джалал оглы
канд. хим. наук, доцент АГПУ, г. Баку
e-mail: AsefQuliyev @yandex.com
Сагиева Фахрия Акиф кызы
магистр 2-го курса, АГПУ, г. Баку
Координационные соединения редкоземельных элементов (РЗЭ) с биологически активными органическими веществами к которым относятся ![]() -аминокислоты и винная кислота, представляют значительный интерес для координационной химии РЗЭ и для получения новых препаратов (РЗЭ), обладающих биологической активностью. Комплексные соединения РЗЭ, содержащие одновременно ионы
-аминокислоты и винная кислота, представляют значительный интерес для координационной химии РЗЭ и для получения новых препаратов (РЗЭ), обладающих биологической активностью. Комплексные соединения РЗЭ, содержащие одновременно ионы ![]() -аминокислот и винной кислоты, изучены недостаточно. Получены разнолигандные комплексные соединения празеодима (III) [3, с. 1927] и европия (III) [4, с. 108] с некоторыми
-аминокислот и винной кислоты, изучены недостаточно. Получены разнолигандные комплексные соединения празеодима (III) [3, с. 1927] и европия (III) [4, с. 108] с некоторыми ![]() -аминокислотами и винной кислотой. Однако к настоящему времени разнолигандные комплексы церия (III), содержащие координированные анионы глицина и винной кислоты, в литературе не описаны. Основной целью данной работы является синтез, исследование свойств и строения внутрикомплексных разнолигандных соединений церия (III), содержащие координированные анионы глицина и винной кислоты
-аминокислотами и винной кислотой. Однако к настоящему времени разнолигандные комплексы церия (III), содержащие координированные анионы глицина и винной кислоты, в литературе не описаны. Основной целью данной работы является синтез, исследование свойств и строения внутрикомплексных разнолигандных соединений церия (III), содержащие координированные анионы глицина и винной кислоты
Экспериментальная часть.
В работе были использованы глицин (НGly) H2NCH2COOH — производства фирмы «Renal» (Венгрия), винная кислота HOOC — CHOH — CHOH — COOH марки «ч. д. а.», СеCl3.6H2O и гидроксид калия марки «х. ч». Состав полученных соединений установлен методом элементного анализа: содержание церия (III) комплексонометрическим титрованием [6, с. 460], углерода и водорода сжиганием в токе кислорода, азота микрометодом Дюма [2, с. 850, 859]. ИК-спектры соединений, диспергированных в таблетки с KBr, записывали на спектрофотометре М-80 в области 500—4000 см-1. Термическую устойчивость и процесс разложения комплексов церия (III) изучали при помощи дериватографа G-1500Д. Дериватограммы сняты при умеренном доступе воздуха к образцам и использованием навески 94 мг, чувствительность весовой системы 100 мг. Нагрев образца в интервале 20—1000 0С осуществляли со скоростью 10 град/мин. Конечные продукты разложения исследовали методами химического и рентгенфа-зового анализа. Измерения рН растворов производили на pH-метре марки ЛПМ-60М со стеклянным электродом. Необходимые значения рН среды достигались добавлением эквимолярного количества раствора KOH.
Синтез соединения формулой [Ce(C2H4NO2)C4H4O6(H2O)2].3H2O осуществляли следующим образом: отдельно приготовленные по 0,01 м/л концентрированные растворы гексагидрата хлорида церия(III), глицина и винной кислоты смешивали и в полученную реакционную смесь добавляли 0,03M KOH. Полученный кристаллический осадок отфильтровывали, промывали дистиллированной водой, затем этиловым спиртом и выдерживали на воздухе в течении двух часов и высушивали до постоянной массы и анализировали.
Найдено, %: Се — 30,46; С — 15,44; N — 2,78; Н — 3,52.
Для [Ce(C2H4NO2)C4H4O6(H2O)2].3H2O вычислено, % :
Се — 30,97; С — 15,93; N — 3,10; Н — 3,98.
Методика синтеза комплекса состава K2[Ce(C2H4NO2)C4H2O6].3H2O по существу аналогична предыдущему и отличается только тем, что к стехиометрическим количествам исходных компонентов добавляли 5 M KOH. Полученный кристаллический осадок высушивали до постоянной массы и анализировали.
Найдено, % : Се — 27,95; С — 14,24; N — 2,48; Н — 2,12.
Для K2[Ce(C2H4NO2)C4H2O6].3H2O вычислено, %:
Се — 28,46; С — 14,63; N — 2,85; Н — 2,44.
Синтез комплексного соединения состава K[Ce(C2H4NO2)2C4H4O6].4H2O осуществляли по выше указанной методике и отличается тем что, соотношение исходных реагентов CeCl3 : глицин : винная кислота составило 1:2:1. Результаты элементного анализа полученного комплекса приведены ниже:
Найдено, % : Се — 25,14; С — 19,14; N — 4,86; Н — 3,31.
Для K[Ce(C2H4NO2)2C4H4O6].4H2O вычислено, % :
Се — 25,59; С — 19,55; N — 5,12; Н — 3,66.
Результаты и их обсуждение.
Как показали исследования образование разнолигандных комплексов церия (III) с глицином и винной кислотой зависит от значения pH. ИК-спектры комп-лексов интерпретировали по сравнению их с ИК-спектрами глицина, винной кислоты, их соединений с металлами [1, с. 2659;]. и литературных данных [5, с. 252, 259]. В ИК-спектрах комплексов обнаружены частоты колебаний, характерные для координированных анионов глицина и винной кислоты (таблица 1). Для синтезированных разнолигандных комплексов церия (III) общим является наличие в их спектрах следующих максимумов основных полос поглощения (см-1);
υ(M-N) ≈515-530; υs(CCN) ≈ 900 − 940; υas(CCN) ≈ 1130 − 1155;
υs(OCO) ≈ 1360 − 1380; υas(OCO) ≈ 1600 − 1630; υ(NH2) ≈ 3270 − 3340
Таблица 1.
Волновые числа (см-1) максимумов основных полос поглощения в ИК-спектрах разнолигандных комплексов церия (III) с глицином и винной кислотой
Комплекс |
ν(MN) |
νs(CCN) |
νas(CCN) |
νs(OCO) |
νas(OCO) |
ν(NH2) |
[Ce(C2H4NO2)C4H4O6(H2O)2].3H2O |
525 |
930 |
1130 |
1370 |
1600 |
3340 3270 |
K2[Ce(C2H4NO2)C4H2O6].3H2O |
515 |
925 |
1135 |
1365 |
1620 |
3320 3260 |
K[Ce(C2H4NO2)2C4H4O6].4H2O |
520 |
940 |
1145 |
1380 |
1625 |
3325 3270 |
Сравнение ИК-спектроскопических данных глицина, винной кислоты и комплексов церия (III) показывает, что координация лигандов ионом металла сопровождается рядом спектральных изменений. В ИК-спектрах комплексов наблюдается исчезновение валентных и деформационных колебаний NH3+ — групп, характерное для исходных молекул ![]() -аминокислот, в то же время появляются интенсивные полосы υ(NH2) от координированной аминогруппы. В спектрах наблюдаются так же полосы поглощения υas(OCO), υs(OCO), υas(CCN), υs(CCN), которые смещены в низкочастотной области спектра. Данные ИК-спектров комплексов показывают, что карбоксильные группы лигандов депротонированы и участвуют в образовании связи Ce — OCO.
-аминокислот, в то же время появляются интенсивные полосы υ(NH2) от координированной аминогруппы. В спектрах наблюдаются так же полосы поглощения υas(OCO), υs(OCO), υas(CCN), υs(CCN), которые смещены в низкочастотной области спектра. Данные ИК-спектров комплексов показывают, что карбоксильные группы лигандов депротонированы и участвуют в образовании связи Ce — OCO.
Сопоставление спектральных данных разнолигандных комплексов церия (III) дает возможность предположить, что в координации глисинат иона принимает участие амино- и карбоксильные группы. Координация тартарат иона осуществляется атомами кислорода карбоксильных и гидроксильных групп.
Сравнительный анализ дериватограмм разнолигандных комплексов церия (III) показал, что термолиз их протекает однотипно, поэтому можно ограничиться описанием процесса разложения комплекса K2[Ce(C2H4NO2)C4H2O6].3H2O, на примере которого необходимо рассмотреть термическое превращение в синтезированных комплексах.
На кривой ДТА соединения (рисунок 1) в интервале температур 50—145 оС наблюдаемый эндоэффект обусловлен удалением внешнесферной воды. Потеря массы при этом составляла — 10,64 % (вычислено,∆m=10,98 %), которая соответствует трем молекулам кристаллизационной воды. Расчеты на ТГ показывают, что в указанном интервале температур соединение обезвоживается. В интервале температур 145—230 оС обезвоженный продукт подвергается термическому разложению. Потеря массы обезвоженного продукта составляет 4,26 %, который соответствует образованию одной молекулы воды (вычислено, Δm=4,11 %)
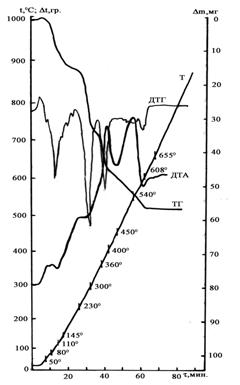
Рис. 1. Дериватограмма соединения K2[Ce(C2H4NO2)C4H2O6].3H2O
С дальнейшим повышением температуры увеличивается скорость реакции разложения соединения. В интервале температур 230—360оС идут процессы термической диссоциации органической части комплекса и окисление летучих продуктов диссоциации. Эффект изменения скорости данного процесса зафиксирован на ДТГ при 300оС. Однако на соответствующем отрезке ДТА имеется «площадка». Вероятно, это связано покрыванием эндотермического процесса начала разложения органической части вещества экзотермическим процессом окисления продуктов разложения
На кривой ДТА в областях 360—450оС и 450—608оС наблюдаемые экзотермические эффекты при 400,540оС (по ДТА) обусловлены выгоранием основной массы органической части вещества, термическими превращениями и формированием конечного продукта термолиза. Конечным продуктом термического разложения комплекса является CeO2.
Список литературы:
- Варшавский Ю.С., Инькова Е.И., Гринберг А.А. Ж. неорган.химии. 1963, т. 8, № 12, с. 2659—2667.
- Гиллебранд В.Ф. и др. Практическое руководство по неорганическому анализу. М., «Химия». 1966, с. 850, 859.
- Кулиев А.Д. Ж. неорг. xимии, 2009, т. 54, № 12, с. 2009—2012., Russian journal of chemistru 2009, Vol. 54, № 12, pp. 1927—1930.
- Кулиев А.Д., Османова С.Н. Азерб. хим. Ж. 2011, № 2, с. 108—110.
- Накамото К. Инфракрасные спектры и спектры КР неорганических и координационных соединений. М., «Мир», 1991. М., «Мир», с. 252, 259.
- Шека З.А. Синявская Э.И. Ж. аналит. химии. 1963, т. 18, № 2, с. 460.
дипломов

Оставить комментарий