Статья опубликована в рамках: V Международной научно-практической конференции «Научные достижения биологии, химии, физики» (Россия, г. Новосибирск, 06 марта 2012 г.)
Наука: Химия
Секция: Физическая химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
ЭЛЕКТРОКАТАЛИТИЧЕСКОЕ ПОВЕДЕНИЕ ПЛАТИНЫ В РАСТВОРАХ ГЛЮКОЗЫ
Мамедов Эльшад Аршад оглы
д-р хим. наук, доцент АзТУ, г. Гянджа
E-mail:
Шарифова Магира Талыш гызы
канд. хим. наук, доцент, зав. лабораторией. Гянджинский Региональный научный центр, г. Гянджа
Амиров Шахин Агамир оглы
канд. хим. наук, доцент АзТУ, г. Гянджа
В последнее время появился ряд работ [1], посвященных изучению процесса окисления глюкозы на различных электродах, главным образом, на платине. В большей части работ выводы о механизме окисления глюкозы делается на основании только вольт-амперных потенциодинамических кривых и анализа продуктов реакции. Исследовалась зависимость стационарного заполнения поверхности гладкого платинового электрода хемосорбированными частицами в кислом растворе глюкозы от потенциала. Адсорбция глюкозы в 0,5 М H2SO4 максимальна при μ=0,2 В и падает при сдвиге потенциала в анодную сторону вследствие окисления хемосорбированных частиц, а при сдвиге потенциала в сторону менее анодных потенциалов--вследствие конкуренции за адсорбцию между водородом и глюкозой.
Сопоставление результатов по снижению адсорбции водорода и по окислению хемосорбированных частицу показывает, что при окислении на одно занятое место требуется 1,5±0,15 электрона, причем это соотношение мало меняется с потенциалом.
Для выявления области потенциалов, при которой происходит электрокаталитическое окисление глюкозы, снимались анодные потенциодинамические кривые, заряжения на платинированном платиновом (Pt/Pt) электроде в растворе фона (0,5 м Н2SО4) и в растворах, содержащих различные концентрации глюкозы.
Изменение величины тока в интервале потенциалов 0—0,3 В характеризует процесс снятия с поверхности платины адсорбированного водорода, интервал потенциалов 0,3—0,6 В характеризует двойнослойную зону, интервал 0,6—1,5 В отвечает процессу адсорбции кислорода на платине. По водородной зоне кривой заряжения вычислялась величина истиной поверхности электрода-катализатора, исходя из того, что при обратимом водородном потенциале, платина покрыта монослоем водорода, для снятии которого на 1 см2 гладкой поверхности требуется затратить 218*10-6кул, Sист=![]() (см2), где
(см2), где ![]() -количество электричества, затраченное на десорбцию водорода.
-количество электричества, затраченное на десорбцию водорода.
Вычисленная таким образом величина Sист=109 см2, при этом видимая Sв=1,6 см2.
После снятия У-Е кривой в фоне на электроде устанавливался потенциал 0,5 В, соответствующий двойнослойной области, при котором электрод свободен от адсорбирован водорода и кислорода. При этом потенциале вводились растворы глюкозы различной концентрации, наблюдалось появлении анодного нестационарного тока, быстро убывающего во времени. Такой характер нестационарного тока свидетельствует о диссоциативном характере адсорбции глюкозы на платине, выраженном процессом ее дегидрирования а нестационарный ток является током ионизации водорода, образующегося при дегидрировании молекул глюкозы.
Вероятно, как и в случае более простых органических веществ дегидрирование глюкозы происходит за счет последовательного отщепления атомов водорода
C6H12O6→(C6H11O6)agc+H++e-
Для альдегидной формы глюкозы хемосорбированная частица может иметь такое строение:
Для циклических ![]() и ß-форме эта частица может быть представлена схемой
и ß-форме эта частица может быть представлена схемой
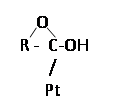
Так как раствор глюкозы представляет собой динамическое равновесие между формами глюкозы: альдегидной формы, ![]() , ß форм шестичленных и пятичленных циклов и их конформаций [2], то вопрос о строении хемосорбированной частицы не может быть решен однозначно.
, ß форм шестичленных и пятичленных циклов и их конформаций [2], то вопрос о строении хемосорбированной частицы не может быть решен однозначно.
Из литературный данных [3] известно, что степень заполнения поверхности платины адсорбированными частицами глюкозы зависит от ее объемной концентрации, причем максимальная степень заполнения поверхности составляет 60 % монослоя (при концентрации глюкозы 0,5 М).
Адсорбция глюкозы идет во времени и, судя по литературным данным [3] для гладкой платины степень заполнения поверхности при различных объемных концентрациях достигает предельной величины в течение 3—5 сек. Поэтому после введения глюкозы в ячейку, электрод выдерживался нами при потенциале 0,5 В до тех пор, пока возникающий при этом анодный ток не достигал постоянной величины. Затем снималась анодная потенциодинамическая кривая от 0 до 1,5 В. наблюдались три области окисления глюкозы: область потенциалов 0—0,3 В; 0,6—0,7В; 1,0—1,5 В.
Расчет количества электричества, пошедшего на анодный процесс в области потенциалов 0—0,3 В показывает, что эта величина в присутствии глюкозы (![]() )А больше количества электричества, затраченного на тот же процесс в фоне (
)А больше количества электричества, затраченного на тот же процесс в фоне (![]() )А. (табл. 1).
)А. (табл. 1).
Исходя из того, что (![]() )А/(
)А/(![]() )А>1 можно заключить, что в области потенциалов 0—0,3 В происходит дегидрирование глюкозы при анодной поляризации. Это может быть процесс более глубокого дегидрирования хемосорбированных частиц глюкозы, с одновременным дегидрированием физически адсорбированных молекул.
)А>1 можно заключить, что в области потенциалов 0—0,3 В происходит дегидрирование глюкозы при анодной поляризации. Это может быть процесс более глубокого дегидрирования хемосорбированных частиц глюкозы, с одновременным дегидрированием физически адсорбированных молекул.
Таблица 1.
Зависимости (![]() )А и (
)А и (![]() )А от концентрации глюкозы
)А от концентрации глюкозы
|
V, в/с |
С глюкозы, М |
( |
( |
( |
|
0,004 в/с |
__ |
1,91*10-2 |
__ |
1,534 |
|
2,37*10-2 |
__ |
2,93*10-2 |
||
|
0,002 в/с |
__ |
2,27*10-2 |
__ |
1,639 |
|
2,27*10-1 |
__ |
3,72*10-2 |
Ток, зафиксированный на У-Е кривой в области потенциалов 0—0,3 В в присутствии глюкозы суммируется из тока ионизации водорода, находящегося на той части поверхности платины, которая свободнее от хемосорбированных частицу органического вещества, а также из тока ионизации водорода, образующегося в результате дегидрирования глюкозы при поляризации.
В области потенциалов 0,6—0,7 В наблюдаются пики окисления глюкозы. Наиболее четко эти пики выражены при скорости развертки потенциала 0,004 в/с. Окисление глюкозы в этой области потенциалов идет до глюконовой кислоты, что подтверждается анализом продуктов реакции. Пики окисления глюкозы имеют хорошую воспроизводимость. Если после выключения анодной поляризации повторно снимать потенциодинамическую кривую от потенциала 0 В, то пик окисления появляется в том же интервале потенциалов и величины Уmax совпадают при многократном повторении данной кривой от 0 до 1,2 В в пределах точности потенциала (±5%).
Если после снятия анодной кривой от до 1,2 В повторно снимать ту же кривую от потенциала 0,5 В, то в области потенциалов 0,6—0,7 В отсутствуют пики окисления глюкозы, повторное же снятие кривой от 0 В воспроизводит пик окисления.
Можно предположить, что частиц глюкозы, адсорбированные на ее поверхности (при потенциале 0,5 В) не могут окислиться в области потенциалов 0,6—0,7 В без более глубокого дегидрирования в процессе анодной поляризации в интервале потенциалов 0—0,3 В. Об этом свидетельствует и тот факт, что если после введения глюкозы в растворе при потенциале 0,5 В, сразу начать снимать анодную потенциодинамическую кривую от 0,5 В, то пики окисления также отсутствуют . Поэтому область потенциалов 0,6—0,7 В может быть выбрана для исследования зависимости скорости окисления глюкозы от ее объемной концентрации, при условии снятия анодной потенциодинамической кривой от 0 В до 1,0 В.
Исследовалась зависимость количества электричества (Q), пошедшего на электрокаталитическое окисления глюкозы в интервале потенциалов 0,6—0,7 В, а также величина плотности тока (i) и максимума тока окисления (в пике) Уmax, находящегося при потенциале 0,65 В, от объемной концентрации глюкозы (с) (табл. 2). Концентрация глюкозы варьировалась в интервале 5*10-4-1 М.
Для каждой концентрации глюкозы снимались потенциодинамические кривые от 0 до 1,0 В. Данные по зависимости Q от С, а также i (и Уmax) от с приведены в табл. 2.
Таблица 2
Зависимость У, i и Q от С.
|
№ |
Сcl, M |
У, mA |
I, mA/cm2 |
Q, кул |
|
1 2 3 4 5 6 7 8 9 10 11 12 |
7*10-4 4*10-3 7,97*10-3 1,2*10-2 1,59*10-2 2,37*10-2 3,92*10-2 4,0*10-2 7,69*10-2 7,7*10-2 1,15*10-1 1 |
0,094 0,3 0,4 0,476 0,506 0,527 0,58 0,56 0,66 0,65 0,604 0,75 |
5,875*10-2 1,875*10-1 2,5*10-1 2,975*10-1 2,575*10-1 3,3*10-1 3,5*10-1 3,6*10-1 4,13*10-1 4,06*10-1 3,78*10-1 4,57*10-1 |
4,5 9,7 12,8 13,6 14,02 14,53 14,85 15,4 16,39 15,83 16,7 17,6 |
В области концентраций 5*10-4-1М наблюдается прямолинейная зависимость Q от С, и imax стремится к предельной величине ввиду того, что степень заполнения поверхности хемосорбированными частицами при этих концентрациях достигает максимальной величины (концентрации 0,5 М), таким образом в области указанных концентраций, которые представляют интерес для пищевой промышленности.
Исследования в растворах, моделирующих физиологические, показали, что ввиду адсорбции ионов хлора, пиков окисления глюкозы в исследуемой области нее наблюдается. Вероятно, для медицинских целей надо использовать другие системы.
Список литературы:
1. Николаева Н. Н, Хазова О. А, Васильев Ю. Б, Электрохимия, М.,1983, вып. 11, с 1476.
2. Николаева Н. Н, Хазова О. А., Васильев Ю. Б. Электрохимия, М., 1980, вып. 8, с 1227.
3. Степаненко Б. И. Химия и биохимия углеводов (моносахариды), М., 1977. с 223.
дипломов

Оставить комментарий