Статья опубликована в рамках: III Международной научно-практической конференции «Научные достижения биологии, химии, физики» (Россия, г. Новосибирск, 27 декабря 2011 г.)
Наука: Химия
Секция: Органическая химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
СИНТЕЗ, СТРОЕНИЕ И PH-ИНДИКАТОРНЫЕ СВОЙСТВА ЭТИЛОВОГО ЭФИРА 3 (4 НИТРОФЕНИЛ)ГИДРАЗОНО-2,4-ДИОКСОПЕНТАНОВОЙ КИСЛОТЫ
Левенец Татьяна Васильевна
аспирант ОГУ, г. Оренбург
E-mail: ltv.2009@yandex.ru
Листопад Екатерина Васильевна
студент ОГУ, г. Оренбург
Козьминых Владислав Олегович
д-р хим. наук, профессор ОГУ, г. Оренбург
E -mail: kvoncstu@yahoo.com
Ранее было установлено, что конденсация Клайзена арилметилкетонов с диалкилоксалатами приводит к образованию эфиров ароилпировиноградных кислот [3], при взаимодействии которых с диазореагентами получены 4-арилпроизводные 3-арилгидразоно-2,4-диоксобутановых кислот [5]. Другие 4-замещенные (например, 4-алкилпроизводные) 3-арилгидразоно-2,4-диоксоалкановые кислоты и их эфиры до наших исследований не были известны [4].
Нами впервые предложена трехкомпонентная однореакторная оксалильная конденсация ацетона с диэтилоксалатом с последующим азосочетанием с хлоридом 4-нитрофенилдиазония, приводящая к ранее неизвестному практически значимому этиловому эфиру 3-(4-нитрофенил)гидразоно-2,4-диоксопентановой кислоты 1.
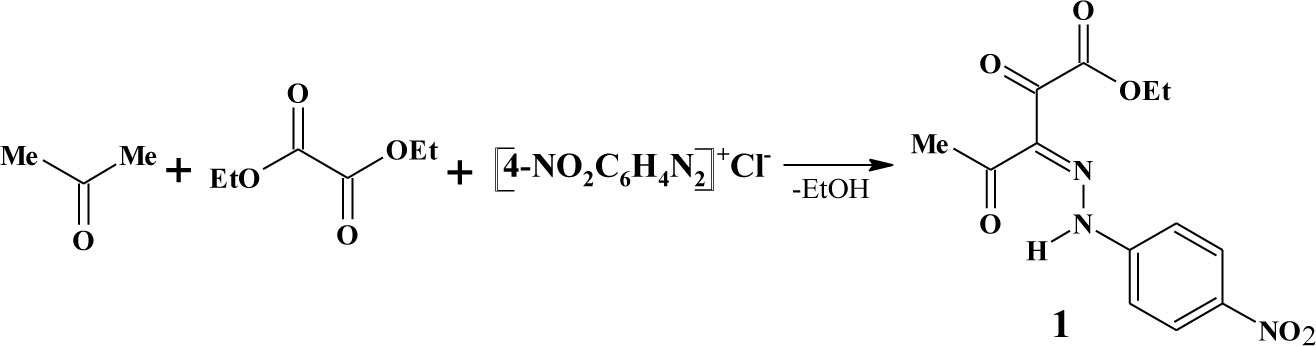
Полученное соединение представляет собой вещество ярко-желтого цвета, которое легко растворяется в обычных органических растворителях и практически не растворимо в воде.
Строение синтезированного соединения установлено на основании данных ИК, ЯМР 1Н и УФ спектроскопии, спектральные характеристики однозначно согласуются с предложенной структурой.
Спектр ЯМР 1Н соединения 1, снятый в растворе дейтерохлороформа, характеризуется отчетливым рисунком всех сигналов с хорошо сопоставимой интегральной интенсивностью и классическими значениями констант спин-спинового взаимодействия. Существенный сдвиг сигнала протона NH-группы в область слабого поля (14,05—14,84 м.д.) свидетельствует о наличии внутримолекулярной водородной связи группы NHфрагмента гидразона с карбонильной функцией.
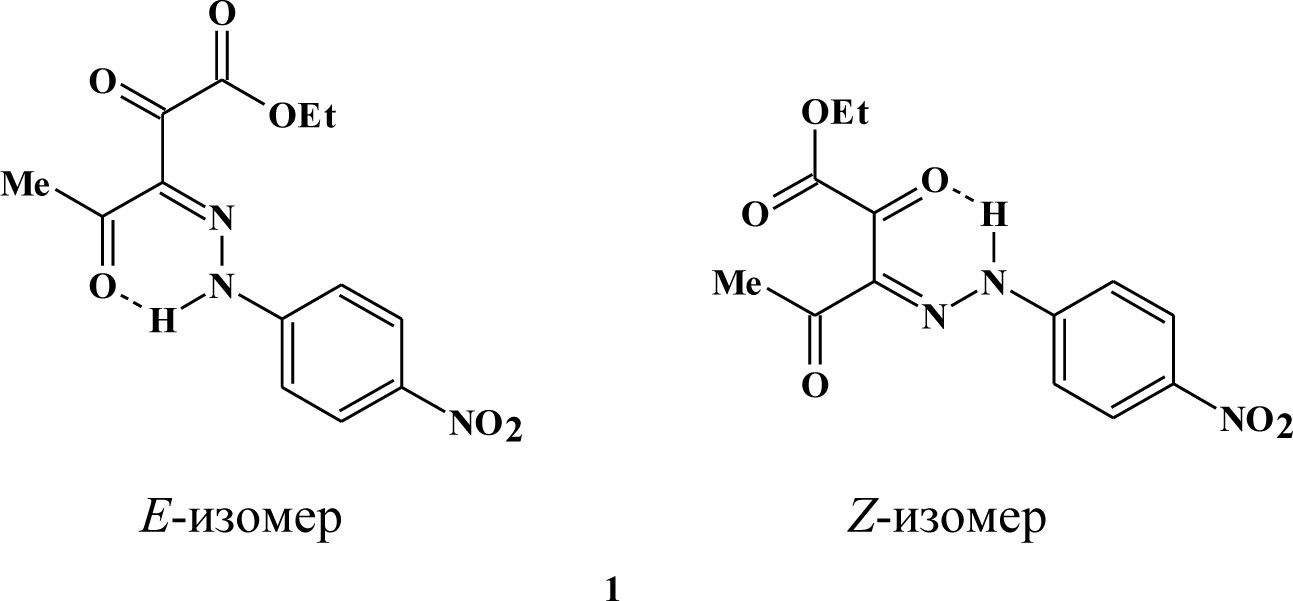
Для синтезированного соединения 1 отмечено наличие двух изомеров (E- и Z-изомеров), обусловленное, по видимому, сильным электроакцепторным влиянием заместителя в ароматическом ядре. Наличие пространственного Z- изомера подтверждается в ЯМР 1Н спектре дублирующимися сигналами протоносодержащих групп преобладающего E-изомера. В ИК спектре присутствуют сигналы в области 3113-3083 см-1, интерпретируемые валентными колебаниями NH-связей, наличие дополнительной полосы валентных колебаний NH-связей, также подтверждает наличие Z-изомера.
В УФ спектре соединения 1 в видимой области наблюдается один максимум поглощения при 381 нм (lgε 4,46), что согласуется со значениями максимумов поглощения α-, b-дикарбонильных соединений, содержащих гидразонный фрагмент [2].
Установлено, что раствор соединения 1 в этаноле изменяет цвет в зависимости от рН среды. Так, в кислой среде раствор окрашен в желтый цвет, в основной — в красный. Определение интервала перехода осуществляли визуальным методом с использованием серии буферных растворов в диапазоне рН=8,0¸10,0 с DрН=0,1 (буферные системы: соляная кислота — борат натрия; борат натрия — гидроксид натрия) [1]. Результаты определения контролировались данными спектров поглощения в видимой области спектра. Интервал перехода окраски для 1 % водно-спиртового раствора соединения 1 составил 8,7—9,5 при визуальном определении; спектральный анализ в видимой области показал первые изменения в структуре при рН=8,3, а при рН>9,3 кривые идентичны кривой поглощения при рН=9,3. При повышении рН происходит резкое изменение окраски раствора, вызванное, по-видимому, отрывом протона от атома азота гидразонного фрагмента и сопровождающееся образованием хиноидной структуры.

Таким образом, нами предложен простой и удобный метод получения этилового эфира 3-(4-нитрофенил)гидразоно-2,4-диоксопентановой кислоты, установлено строение синтезированного соединения спектральными методами, показана возможность его применения в качестве кислотно-основного индикатора.
Экспериментальная химическая часть.
ИК спектр полученного соединениязаписан на спектрофотометре «Инфралюм ФТ-02» в пасте твёрдого вещества в вазелиновом масле. Спектр ЯМР 1H получен на приборе «MERCURYplus-300» (300,05 МГц) в СDCl3, внутренний стандарт — ТМС. УФ спектр полученного соединениязаписан на спектрофлуориметре СМ 2203 в метаноле (концентрация 10-5—10-6 моль/дм3). Протекание реакции контролируют, а индивидуальность полученного вещества подтверждают методом ТСХ на пластинках Silufol UV-254 в системе бензол — диэтиловый эфир — гексан, 1:2:3, хроматограмму проявляют парами йода. Исходные реактивы перед использованием очищают перегонкой.
Синтез этилового эфира 3-(4-нитрофенил)гидразоно-2,4-диоксопентановой кислоты 1. Ксмеси 0,73 мл (10 ммоль) ацетона, 1,36 мл (10 ммоль) диэтилоксалата и 80 мл абсолютного толуола добавляют при перемешивании небольшими кусочками 0,23 г (10 ммоль) натрия и охлаждают до 5 °С и выдерживают в течение 10‑12 часов. К образующейся суспензии добавляют смесь 1,38 г (10 ммоль) 4-нитроанилина, 2 мл концентрированной соляной кислоты и 0,69 г (10 ммоль) нитрита натрия (контроль рН=5-7, t=0-5 °C) в 20 мл воды. Через 1‑1,5 часа интенсивного перемешивания верхний толуольный слой отделяют, растворитель испаряют, остаток перекристаллизовывают из этанола. Выход 1,28 г (42%), Тпл. 128-130 °C.
ИК спектр, n, см-1 (вазелиновое масло): 3113, 3083 νNH(E-, Z-изомеры), 1868, 1843, 1827 νCH, 1735 νC=O, 1680 νC=O, 1642 νC=O, 1596, 1538, 1520, 1509 νCH+νC=N, 1338 νsNO2, 1164, 1099 δплоск.СН, 1100 νC-O-C, 848 (NO2), 822, 792, 733 δнеплоск.СН.
Спектр ЯМР 1H, d, м.д. (CDCl3): 1,41 т (3Н, СН3СН2О, J6,9 Гц, E-изомер 90%), 1,41 т (3Н, СН3СН2О, J6,9 Гц, Z-изомер 10%), 2,52 с (3Н, СН3, Z-изомер 10%), 2,68 с (3Н, СН3, E-изомер 90%), 4,44 кв (2Н, СН3СН2О, J6,9 Гц, E-изомер 90%), 4,46 кв (2Н, СН3СН2О, J6,9 Гц, Z-изомер 10%), 7,45 д (2Н, С6Н4, J9,0 Гц, E-изомер 90%), 7,57 д (2Н, С6Н4, J9,0 Гц, Z-изомер 10%), 8,30 д (2Н, С6Н4, J9,0 Гц, E-изомер 90%), 8,32 д (2Н, С6Н4, J9,0 Гц, Z-изомер 10%), 14,05 с (1Н, NH, Z-изомер 10%), 14,84 с (1Н, NH, E-изомер 90%).
Список литературы:
1.ишоп Э. Индикаторы. В 2 ч. Ч. 1, пер. с англ. И. В. Матвеевой. М.: Мир, 1976. 496 с.
2.Казицына Л. А. Применение УФ-, ИК-, ЯМР- и масс-спектроскопии в органической химии / Л. А. Казицына, Н. Б. Куплетская. — Москва: изд-во Московского гос. ун-та, 1979. — 240 с.
3.Козьминых В. О., Гончаров В. И., Козьминых Е. Н., Ноздрин И. Н. Конденсация Клайзена метилкетонов с диалкилоксалатами в синтезе биологически активных карбонильных соединений (обзор, часть 1) // Вестник Оренбургского гос. ун-та. Оренбург, 2007. Вып. 1. С. 124‑133.
4.Левенец Т. В., Федосеев С. А., Козьминых В. О. Синтез и особенности строения эфиров 3-арилгидразоно-2,4-диоксоалкановых кислот // XIVмолодежная конференция по органической химии. Екатеринбург, 2011. С. 418‑419
5.Пименова Е. В., Хаматгалеев Р. А., Воронина Е. В., Андрейчиков Ю. С. Синтез и антимикробная активность замещенных 4-арил-3-фенилгидразоно-2,4-диоксоалкановых кислот // Химико-фармацевтический журнал. —1999. —Т. 33. —Вып. 8. —С. 22-23.
дипломов
Оставить комментарий