Статья опубликована в рамках: II Международной научно-практической конференции «Научные достижения биологии, химии, физики» (Россия, г. Новосибирск, 30 ноября 2011 г.)
Наука: Биология
Секция: Экология
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
Статья опубликована в рамках:
ПОЛОВОЙ ДИМОРФИЗМ ПО КОМПЛЕКСУ МОРФОМЕТРИЧЕСКИХ ПРИЗНАКОВ В ПОПУЛЯЦИЯХ КРОСНОБРЮХОЙ ЖЕРЛЯНКИ BOMBINA BOMBINA LINNAEUS, 1761 (AMPHIBIA, ANURA, DISKOGLOSSIDAE) ИЗ ВОДОЕМОВ РАЗНОЙ СТЕПЕНИ АНТРОПОГЕННОГО ЗАГРЯЗНЕНИЯ В БОЛГАРИИ
Желев Живко Маринов
гл. асистент кафедры Анатомии и физиологии человека и животных, Пловдивский государственный университет им. П. Хилендарского, г. Пловдив, Болгария
Е-mail: zhivko-m@uni-plovdiv.bg
В природе половой диморфизм вероятно возник в результате неодинакового распределения ресурсов размножения и роста, ведущего со своей стороны к различиям морфометрических признаков и размеров обоих полов. Про эволюцию полового диморфизма выдвинуты три основные гипотезы, опирающиеся на механизмы полового отбора, конкуренцию между полами за ресурсы питания и роль репродуктивной изоляции [13, с. 14].Гипотеза полового отбора основывается на предположени, что половой диморфизм эволюировал тогда, когда признаки, дающие преимущество в процессе размножения (как во время копуляции, так и при выборе и удержании партнера) селектируются в пределах одного пола [12, с. 14]. Гипотеза, рассматривающая дифференциацию сегментов между полами или та, касающаяся способности размножения, объединяются в предположении, что факторы оказывают влияние только на женских [18, с. 15]. Их размеры обычно больше (как абсолютное значение, или пропорционально размерам тела), чем у мужских, поскольку более крупное тело связано с увеличением числа яиц. Конкуренция между полами за ресурсы питания возможно тоже влияет на диморфизм, в основном на структуры, связанные с питанием и пропорциями головы. В развитии полового диморфизма определенную роль играют и конкретные условия обитания [10, с. 14]. Весьма вероятно, половой диморфизм не эволюировал в ответ на конкретные факторы, а мог бы повлияться разными комбинациями факторов, действующих вместе или в отдельности. Каждый из этих факторов в состоянии увеличить или ограничить степень его проявления, под воздействием других факторов [18, с. 15]. К настоящему времени известно несколько работ по комплексному биометрическому исследованию самцов и самок ряда видов земноводных. Так, M. Kminiak [14, с. 14] описал разную степень достоверности половых отличий по морфометрическим признакам у хвостых и бесхвостых амфибий на северо-востоке Словакии. В частности, эти отличия очень значителны для альпийского (Truturus alpestris Laurenti, 1768) и карпатского (Tr. Montadoni Boulenjer, 1860) тритонови обыкновенной жабы (Bufo bufo Linnaeus, 1758), менее выраженны для травяной лягушки (Rana temporaria Linnaeus, 1758). В литературе существуют весьма противоречивые данные относительно полового диморфизма по морфометрическим признакам у бурых лягушек рода Rana. S. Obradovic, Janev B [16, с. 15] обнаружили половой диморфизм по большинству (28 из 33) признаков в популяциях остромордой лягушки R. arvalis Nills, 1842 из центральной Хорватии, в то время как у травяной лягушки R. temporaria — только 7 различающихся признаков из 33. Параллельно, в Подмосковье для тех же видов бурых лягушек получены совершенно иные результаты, а именно — половой диморфизм сильнее выражен у травяной лягушки.[15, с 15]. По более поздним исследованиям бурых лягушек в том же районе РФ половой диморфизм (в особенности по длине отделов передних конечностей и стопы) проявляется у обоих видов бурых лягушек — и остромордой и травяной; отмеченные показатели у самцов достоверно больше, чем у самок [6, с. 13]. В популяции бурых лягушек Белоруского Поозерья половой диморфизм проявляется по двум из 12 морфометрических признаков, касающихся пропорции конечностей [4, с. 13]. Половой диморфизм среди представителей рода Bombina недостаточно изучен. В дельте Дунай (Румыния) для B. bombina не установлен половой диморфизм размеров и веса тела [11, с. 14]. В северном участке Болгарии (р. Дунай), как и на Западнам Предкавказье РФ тоже отсуствуют различия между индивидами обоих полов по основным линийным размерам: L; F; T [8, с. 14]. Сравнение по семи морфометрическим признакам у 271 индивида в 18 популяциях B. bombina и B. variegata Linnaeus, 1758 в Венгрии выдвигает длины тибии как самым надеждный признак разделения обоих видов [19, с. 15]. Сравнительное исследование 9 популяции (3 из них B. bombina, 3 — B. variegatа variegatа и 3 — B. v. scabra) на Ценьтральных Балканах по комплексу 20 морфометрических признаков устанавливает более высокий уровень межполовых различий у B. variegata , чем у B. bombina. У краснобрюхой жерлянки обнаруженые межполовые различия (с более высокими значениями у самцов) сильнее выражены в длине тибии (T,) длине (Lc) и ширине (Lt.c) головы — [17, с. 15].
Цель настоящей работы — рассмотреть направленность и величину межполовых различий по комплексу морфометрических признаков в популяциях краснобрюхой жерлянки B. bombina обитающих в районах разной степени антропогенного загрязнения в Болгарии.
Материал работы собран в период размножения (м. апрель) 2010г. Анализу подвергались 3 популяции краснобрюхой жерлянки (условно обозначенных 1; 2 и 3), обитающих в биотопаах разной степени антропогеннаго загрязнения, два из которых находятся в Южной и один в Северной Болгарии. Популяция 1 обитаеет в биотопе в 12‒15 км на севере от гор. Пловдив — это испускатель воды и верхний участок главного канала, заполняющегосистему рисовых чеков. Испускатель представляет собой водоем искуственного происхождения размерами 50–60 x 30–40м., отгороженный земляным валом высотой 2–3м. В нем круглый год задерживается вода с переменным уровнем. Его дно каменистое, предлагающее естественные укрития земноводным (особенно зимой и ранней весной, когда уровень воды понижается). После весеннего половодья каналов, испускатель регулирует уровень воды в них с помощью системы шлюзов. Здесь поймано 66 жерлянок. Популяция 2 обитает в биотопе, находящемся в 5–7км на западе от гор. Пловдив — это несколько рисовых чеков. Чеки — водоемы прямоугольной формы, размерами 250–300м x 120–130м. Наполняются чеки водой из р. Чепеларской с помощью обводного канала в конце апреля, а сброс воды из рисовой системы производится в конце сентября. Эти рисовые чеки каждый год удобряются пестицидами. Здесь пойманы 53 жерлянок Оба изученные биотопа в Южной Болгарии находятся на расстоянии друг от друга не менее 7–8км. по прямой линии (между ними проходит автомобильная трасса — «Тракия» и несколько второстепенных дорог), из — за чего допускаем, что обмен животными среди обитающих в них популяций земноводных невозможен. Третья популяция обитает в биотопе в Северной Болгарии (отстоит в 200км по прямой линии от остальных двух). Это мелкие разливные водоемы на правом берегу реки Дуная в окрестностях гор. Тутракан. Здесь было отловлено 33 жерлянок. В рисовых чеках под гор. Пловдив налицо активное вмешательство со стороны человека, выраженное регулярным внесением пестицидов. Несмотря на то, что в этих местах обитания, как и в остальных двух биотопах, не проводился физико-химический анализ воды, на основании двух биоидикационных методов (флуктуирующей асимметрии и фенетического состава популяции краснобрюхой жерлянки), ранее [3, с. 13; 9, с. 14] мы показали, что в рисовых чеках на западе от гор. Пловдив (обитаемых популяцией 2) и в разливных водоемах на правом берегу р. Дунай в районе гор. Тутракан (обитаемых популяцией 3) вода загрязненная и стабильность развития краснобрюхой жерлянки сильно нарушена. С другой стороны вода в испускателе и главном канале, заполняющем систему рисовых чеков на севере от гор. Пловдив, поступает из водоема «Оризаре». Это водоем, используемый для выращивания рыбы и спортивной рыбалки, отвечающий на основании данных бюллетеня о состоянии воды в нем от 2009‒2010 [2, с. 13] водоему второи категории согласно закону о водах в Республике Болгария и распоряжению №7/08.07.1986 КОПС, МНЗ и КТЦУ [7, с. 14] о показателях определения качества проточных вод. Первые рисовые чеки находятся не менее, чем в 4км от испускателя, вода в нем относительно чистая и в нашей работе мы рассматриваем популяцию 1, как обитающую при условиях среды, близких к оптимальным. Далее она принята как контрольная группа.
Измерения 10 стандартных морфометрических признаков (длина тела — L, длина головы — L.c., ширина головы — Lt.c., расстояние от конечника морды до переднего края глаза — D.r.o., расстояние от ноздри до переднего края глаза — D.n.o., найбольшая длина глазной щели — L.o., найбольшая ширина верхнего века — Lt.p., расстояние между внутренними краями верхних век — Sp.p., длина бедра — F, длина голени — T)проводились с помощью штангенциркуля с точностью до 0,1 мм по общепринятой методике [1, с. 13], после умертвления животных. Жерлянки разделяли по полу (после вскрытия животных и определения степени развития репродуктивных органов). Все животные в исследовании взрослые, половозрелые. Статистический анализ проведен по принятой методике [5, с. 13] и включает дескриптивную статистику (нормальност распределения признаков проверена D — тестом Колмогорова-Смирнова, установившим нормальное разпределение: p<0.001, что позволило сравнить средние значения исследуемых признаков параметрическим t — тестом) и дискриминантный анализ (для сравнения самцов и самок по совокупности всех признаков и для оценки величины вклада каждого из них в различия между полами), с использованием пакета программ «STАТИСТИКА 6.0».Применение метода дискриминантного анализа объясняется тем, что сравнимые группы мы разделяли по степени загрязнения водоема (для этой цели мы объединили популяции в Болгарии, обитающие в двух загрязненных биотопах — 2 и 3 и сопоставили их с популяцией, обитающей в относительно чистом биотопе) и по полу (самцы и самки различали по половым признаком, не входящим в числе морфометрических признаков,которые мы использовали для анализа половых различий.
Обработанные данные дескриптивной статистики исследованных морфометрических признаков среди индивидов обоих полов в сравниваемых популяциях краснобрюхой жерлянки в Болгарии показаны в табл.1), а данные проведеного дискриминантного анализа соответственно в таблицах 2; 3 и рис. 1.
Таблица 1.
Сравнения морфометрических показателей самцов и самок краснобрюхой жерлянки из биотопов разной степени антропогенного загрязнения (Мin – Mах;  ± m)
± m)
|
Показатели (мм) |
Популяции |
t |
|||
|
1 Относительно чистый биотоп |
(2+3) Грязные биотопы |
||||
|
L |
♂ n=37 |
(33.2–48.7) 38.96±0.65 |
♂ n=41 |
(29.6–47.4) 35.6±0.80 |
3.26* (p<0.001) |
|
♀ n=29 |
(33.6±58.2) 46.52±0.82 |
♀ n=45 |
(30.2–56.3) 41.49±1.22 |
3.42* (p<0.001) |
|
|
t |
7.20* (p<0.001) |
4.03* (p<0.001) |
|||
|
♂чист/♀грязн |
1.83 (p>0.05) |
♀чист/♂грязн |
9.58* (p<0.001) |
||
|
Lc |
♂ n=37 |
(9.6–20.3) 11.35±0.35 |
♂ n=41 |
(9.5–20.3) 11.41±0.53 |
0.10 (p>0.05) |
|
♀ n=29 |
(14.1–24.4) 20.22±0.55 |
♀ n=45 |
(9.8–24.7) 15.03±0.89 |
4.99* (p<0.001) |
|
|
t |
13.65* (p<0.001) |
3.48* (p<0.01) |
|||
|
♂чист/♀грязн |
3.83*(p<0.001) |
♀чист/♂грязн |
11.59* (p<0.001) |
||
|
Lt.c. |
♂ n=37 |
(9.3–14.2) 10.32±0.16 |
♂ n=41 |
(7.7–20.5) 11.28±0.49 |
1.84 (p>0.05) |
|
♀ n=29 |
(10.7–22.6) 18.28±0.54 |
♀ n=45 |
(9.5–23.2) 13.97±0.73 |
4.74* (p<0.001) |
|
|
t |
13.96* (p<0.001) |
3.06* (p<0.01) |
|||
|
♂чист/♀грязн |
4.87*(p<0.001) |
♀чист/♂грязн |
4.74* (p<0.05) |
||
|
D.r.o. |
♂ n=37 |
(2.9–7.4) 3.69±0.16 |
♂ n=41 |
(2.6–7.6) 4.41±0.22 |
2.57* (p<0.05) |
|
♀ n=29 |
(5.1–9.3) 6.87±0.19 |
♀ n=45 |
(2.8–9.7) 5.40±0.34 |
3.77* (p<0.001) |
|
|
t |
13.72* (p<0.001) |
2.41* (p<0.01) |
|||
|
♂чист/♀грязн |
4.50*(p<0.001) |
♀чист/♂грязн |
8.20* (p<0.001) |
||
|
D.n.o |
♂ n=37 |
(2.0–6.0) 2.9±0.11 |
♂ n=41 |
(2.4–6.1) 3.49±0.15 |
3.27* (p<0.001) |
|
♀ n=29 |
(3.3–7.4) 5.61±0.18 |
♀ n=45 |
(2.2–8.2) 4.16±0.20 |
5.58* (p<0.001) |
|
|
t |
12.90* (p<0.001) |
2.79* (p<0.01) |
|||
|
♂чист/♀грязн |
5.73*(p<0.001) |
♀чист/♂грязн |
9.22* (p<0.001) |
||
|
L.o |
♂ n=37 |
(1.8–5.6) 2.27±0.13 |
♂ n=41 |
(1.7–6.7) 3.46±0.21 |
4.76* (p<0.001) |
|
♀ n=29 |
(3.2–7.4) 5.36±0.17 |
♀ n=45 |
(1.4–7.6) 4.37±0.31 |
2.75* (p<0.01) |
|
|
t |
14.05* (p<0.01) |
2.46* (p<0.01) |
|||
|
♂чист/♀грязн |
6.18*(p<0.001) |
♀чист/♂грязн |
7.04* (p<0.001) |
||
|
Lt.p. |
♂ n=37 |
(1.8–5.7) 3.0±0.12 |
♂ n=41 |
(2.2–6.1) 3.63±0.11 |
4.20* (p<0.001) |
|
♀ n=29 |
(3.0–6.3) 4.77±0.17 |
♀ n=45 |
(2.0–6.8) 4.1±0.17 |
2.79* (p<0.01) |
|
|
t |
8.85* (p<0.001) |
2.35 p<0.05) |
|||
|
♂чист/♀грязн |
5.50*(p<0.001) |
♀чист/♂грязн |
5.43* (p<0.001) |
||
|
Sp.p. |
♂ n=37 |
(1.7–4.6) 2.29±0.09 |
♂ n=41 |
(1.7–4.2) 2.45±0.09 |
1.23 (p>0.05) |
|
♀ n=29 |
(2.5–4.4) 3.69±0.07 |
♀ n=45 |
(1.7–5.1) 2.99±0.13 |
4.33* (p<0.001) |
|
|
t |
12.27* (p<0.001) |
3.38* (p<0.01) |
|||
|
♂чист/♀грязн |
4.38*(p<0.001) |
♀чист/♂грязн |
10.82* (p<0.001) |
||
|
F |
♂ n=37 |
(12.2–14.9) 13.83±0.10 |
♂ n=41 |
(10.6–15.7) 13.48±0.09 |
2.69* (p<0.05) |
|
♀ n=29 |
(11.7–15.7) 14.32±0.11 |
♀ n=45 |
(12.4–15.6) 14.18±0.21 |
0.61 (p>0.05) |
|
|
t |
3.27* (p<0.01) |
3.04* (p<0.01) |
|||
|
♂чист/♀грязн |
1.52(p>0.05) |
♀чист/♂грязн |
6.46* (p<0.001) |
||
|
T |
♂ n=37 |
(11.2–13.8) 12.77±0.09 |
♂ n=41 |
(9.3–14.4) 12.53±0.14 |
1.41 (p>0.05) |
|
♀ n=29 |
(10.8–14.8) 13.28±0.10 |
♀ n=45 |
(10.5–14.3) 13.0±0.14 |
1.65 (p>0.05) |
|
|
t |
3.92* (p<0.001) |
2.35*(p<0.05) |
|||
|
♂чист/♀грязн |
1.35(p>0.05) |
♀чист/♂грязн |
4.41* (p<0.001) |
||
Примечание: * — статистически значимые различия для α=0.05
На основании полученных с помощью дискриминантного анализа данных установлен половой диморфизм по комплексу из 10 морфометрических признаков в изученных популяциях краснобрюхой жерлянки, обитающих в биотопах разной степени анртопогенного загрязнения в Болгарии. Судя по приведенным в табл. 2, 3 данным, значение расстояния Махаланобиса самое высокое у самцов и самок в популяции, обитающей в относительно чистом биотопе — 1 (данные дескриптивной статистики в табл. 1 указывают статистически достоверно на преобладание самок по абсолютным величинам всех десяти размерных признаков над самцами). Следующим по величине значением расстояния Махаланобиса является то между самцами объединенной групы популяций 2 и 3, обитающих в условиях загрязнения и самками в относительно чистом биотопе. Здесь, как и в рассмотренных выше случаях, абсолютные значения всех 10 морфометрических признаков у самок в популяции 1 статистически достоверно (у восьми из них с высоким уровнем гарантийной вероятности р<0,001) выше тех у самцов обитающих в биотопах с антропогенным загрязнением (табл. 1). Значение расстояния Махаланобиса указывает на существование отличии по комплексу изучаемых морфометрических признаков между самцами, обитающих в относительно чистом биотопе и теми, обитающими в условиях загрязнения (у самцов в загрязненных биотопах абсолютные значения четырех признаков: L; D.r.o.; Lo.; Lt.p., статистически достоверно ниже и междувременно два другие: D.n.o и F статистически достоверно выше тех у самцов, обитающих в чистом биотопе — табл. 1). Межполовые отличия по комплексу морфометрических признаков отчитываются (хотя выражены слабее, чем первые три описанные случая) и между самками в загрязненных биотопах и теми в популяции из относительно чистого биотопа, а также между самками, обитающими в условиях загрязнения и самцами в популяции 1. Из таблицы 1 видно, что в популяциях самок, обитающих в условиях антропогенного загрязнения, абсолютные значения 8-ми исследованных признаков (L; Lc; Lt.c; D.r.o; D.n.o; Lo; Lt.p и Sp.p) статистически достоверно ниже тех у самок, обитающих в чистом биотопе и в то же время 7 признаков (Lc.; Lt.c; D.r.o; D.n.o; Lo; Lt.p и Sp.p) имеют статистически достоверно более высокие значения, чем эти в популяции 1. Здесь интересно отметит, что по трем линейным признакам, характеризирующим размеры тела и конечностей (L; F и T), между самками, обитающими в условиях загрязнения и самцами из относительно чистого биотопа не устанавливается статистически достоверной разницы. И наконец, самое малое значение расстояния Махаланобиса по комплексу исследованных морфометрических признаков у самцов и самок в популяциях, обитающих в условиях загрязнения (из табл. 1 видно, что в этой популяции абсолютные значения 10-ти метрических признаков у самок выше соответствующих им у самцов: p<0,05). На основании этих суждений о расстояния Махаланобиса, касающихся комплекса морфометрических признаков у индивидов обоих полов, обитающих в биотопах разной степени антропогенного загрязнения в Болгарии, из табл. 2 можно вывести главные информативные признаки дискриминации самцов и самок в чистых и загрязненных биотопах. Главные информативные признаки, дифференцирующие индивидов по полу, в изученных популяциях, обитающих в водоемах разной степени антропогенного загрязнения Болгарии, по степени «убытка информативности» раскладываются следующим образом: длина тела (L); наибольшая ширина верхнего века (Lt.p); расстояние от ноздри до переднего края глаза (D.n.o); наибольшая длина глазной щели (L.o); длина головы (Lc); расстояния между внутренними краями верхних век (Sp.p).
Таблица 2.
Результаты сравнения (дискриминантный анализ) самцов и самок из чистых и грязных биотопов Болгарии по совокупности признаков
|
Wilks' Lambda |
Partial Lambda |
F-remove (3,139) |
p-level |
Toler. |
1-Toler. (R-Sqr.) |
|
|
L |
0.321970 |
0.850047 |
8.173473 |
0.000047 |
0.159720 |
0.840280 |
|
Lc |
0.298305 |
0.917480 |
4.167301 |
0.007336 |
0.049445 |
0.950555 |
|
Lt.c |
0.285867 |
0.957403 |
2.061496 |
0.108137 |
0.099059 |
0.900941 |
|
D.r.o. |
0.275434 |
0.993666 |
0.295329 |
0.828723 |
0.140487 |
0.859513 |
|
D.n.o. |
0.315413 |
0.867717 |
7.063504 |
0.000187 |
0.280011 |
0.719989 |
|
L.o |
0.302229 |
0.905568 |
4.831584 |
0.003136 |
0.120801 |
0.879199 |
|
Lt.p |
0.315848 |
0.866524 |
7.137036 |
0.000171 |
0.237254 |
0.762746 |
|
Sp.p |
0.290252 |
0.942937 |
2.803919 |
0.042126 |
0.186011 |
0.813990 |
|
F |
0.279569 |
0.978970 |
0.995332 |
0.397060 |
0.121438 |
0.878562 |
|
T |
0.280484 |
0.975776 |
1.150224 |
0.331189 |
0.137788 |
0.862212 |
Таблица 3.
Величина расстояния Махаланобиса у самцов и самок краснобрюхой жерлянки из чистых и загрязненых биотопов Болгарии (M — самцы; F — самки)
|
грязныеM |
грязныеF |
чистыйM |
чистыйF |
|
|
грязныеM |
0.000000 |
1.572699 |
4.970857 |
7.550482 |
|
грязныеF |
1.572699 |
0.000000 |
3.499051 |
3.759653 |
|
чистыйM |
4.970857 |
3.499051 |
0.000000 |
8.999568 |
|
чистыйF |
7.550482 |
3.759653 |
8.999568 |
0.000000 |
|
F-values; df = 10,139 |
||||
|
грязныеM |
грязныеF |
чистыйM |
чистыйF |
|
|
грязныеM |
3.168814 |
9.07978 |
12.04513 |
|
|
грязныеF |
3.16881 |
6.67273 |
6.22701 |
|
|
чистыйM |
9.07978 |
6.672734 |
13.74139 |
|
|
чистыйF |
12.04513 |
6.227012 |
13.74139 |
|
|
p-levels |
||||
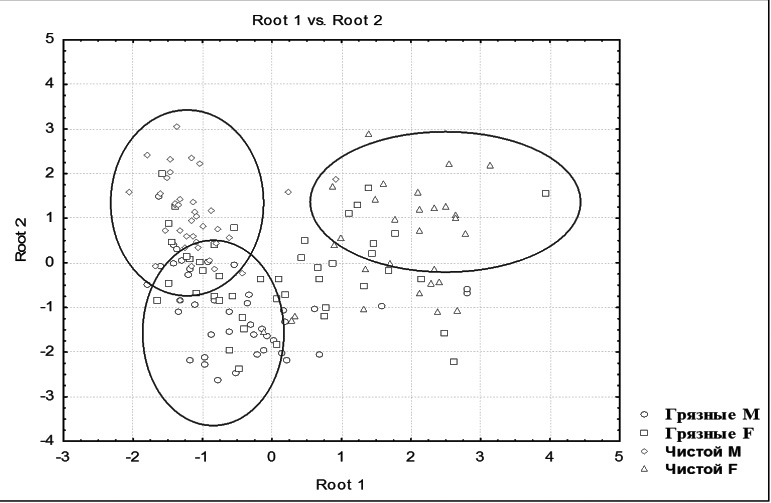
Рисунок 1. Графическое выражение дискриминации самцов и самок краснобрюхой жерлянки из биотопов разной степени антропогенного загрязнения в Болгарии.
На рис. 1 представлено графическое выражение дискриминирования по полу, на основании комплескса 10 морфометрических признаков (6 из которых самые информативные) у индивидов изученных популяции краснобрюной жерлянки, обитающих в водоемах разной степени антропогенного загрязнения в Болгарии. Видно, что в многомерном пространстве формируются три различные облака: в первом группируется основная часть самцов, обитающох в загрязненных биотопах, во второе облако попадает большинство самцов, обитающих в относительно чистом биотопе, а третье обособлено основной группой самок из чистого биотопа. Облако, формированное самками популяции 1, приблизительно одинаково отдаленное в пространстве от двух остальных, пока между облаками самцов из относительно чистого водоема и тех из антропогенно загрязненных водоемов вырисовывается небольшая зона перекрытия. Учитывая расстояния Махаланобиса и графичное выражение дискриминации по полу, на основании комплекса морфометрических признаков в изученных популяцииях краснобрюхой жерлянки, обитающих в биотопах разной степени антропогенного загрязнения в Болгарии, можем сделать следующие выводы:
1. Отчитываем четко выраженный половой диморфизм между следующими группами:
а) Самками из относительно чистого биотопа и самцами в той же популяции (абсолютные значения 6-ти самых информативных морфометрических признаков статистически достоверно выше, чем у самок).
б) Самками из относительно чистого биотопа и самцами в популяциях объединенной группы, обитающих в антропогенно загрязненных биотопах (абсолютные значения 6-ти самых информативных метрических признаков статистически достоверно выше у самок).
в) Самцами в относительно чистом биотопе и теми в антропогенно загрязненных, но здесь отличия выражены слабее, чем в остальных двух случаях и не такие однозначные: самцы в относительно чистом биотопе имеют статистически достоверно более высокие значения абсолютных размеров двух из признаков: L и Lc, пока у самцов в популяциях, обитающих в условия загрязнения, статистически достоверно более высокие абсолютные значения четырех из признаков: Lt.p; D.n.o; L.o. и Sp.p.
2. На основе выведенных результатов дискриминации индивидов по полу на базе комплекса 10 морфометрических признаков в популяциях краснобрюхой жерлянки из водоемов разной степени антропогенного загрязнения в Болгарии, можем заключить, что при обитании в среде с ухудшенными жизненными условиями комплекс морфометрических признаков у самцов изменяется более динамично по сравнению с его изменениям у самок, что и справедливо с эволюционной точки зрения.
Список литературы:
1. А. Банников, И. Даревский, В. Ищенко, А. Рустамов, И. Щербак. Определитель земноводных и пресмыкающихся фауны СССР., М: «Просвещение»., 1977. — 414 с.
2. Бюлетини за състоянието на во дата в р. Марица и яз. Оризаре в периода 2009‒2010гг. Министерство на околната среда и водите. Басейнова дирекция за управление на водите. Източнобеломорски район. Пловдив, 2010. — 262 с.
3. Желев Ж. М., Пескова Т. Ю. Флуктуирующая асимметрия краснобрюхой жерлянки Bombina bombina Linnaeus, 1761 (Amphibia, Anura, Diskoglossidae) у южной границы ареала вида // Проблемы изучения и сохранения позвоночных животных антропогенных водоемов. Саранск, 2010. — С. 45‑49.
4. Косова Л. В. Сравнительная оценка морфометрической структуры популяций остромордой и травяной лягушек на территории Поозерья // Сохранение биологического разнообразия Белорус. Поозерья. Витебск, 1996. — С. 36‑37.
5. Лакин Г. Ф. Биометрия. М.: Высшая школа, 1990. 352 с.
6. Ляпков С. М., Черданцев В. Г., Черданцева Е. М. Половой диморфизм по морфометрическим признакам у остромордой лягушки (Rana arvalis) // Зоол.журн., 2007. Т. 86, № 10. — С. 1237‑1249.
7. Наредба №7/08.07.1986, Закон за водите в република България, 1999. — С. 48‑50.
8. Пескова Т. Ю. Желев Ж. М. Размеры краснобрюхой жерлянки Bombina bombina Linnaeus, 1761 (Amphibia, Anura, Discoglossidae) у южной границы ареала вида // Поволжский экологический журнал, 2010а. № 4 — С. 447–451.
9. Пескова Т. Ю., Желев Ж. М. Фенотипическая структура популяций краснобрюхой жерлянки Bobbina bombina Linnaeus, 1761 (Amphibia, Anura, Discoglossidae) у южной границы ареала вида // Проблемы изучения и сохранения позвоночных животных антропогенных водоемов. Саранск, 2010б. — С. 123‑126.
10. Butler M., A., Lossos J. B. multivariate sexual dimorphism, sexual selection, and adaptation in greater Antillean Anolis lizards // Ecological Monographis, 2002. V. 72(4). — P. 541-559.
11. Cogălniceanu Dan, Claude Maiud. Variation in life history traits in Bombina bombina from the lower Danube floobplain // Amphibia-Reptilia, 2004. V. 25.— P. 115‑119.
12. Darwin C. The Descent of Man and Selection in Relation to Sex., 1871 John Murray, London.
13. Hedrick A. V., Temeles E. J. The evolution of sexual dimorphism in animals: hypotheses and tests // Trends Ecol. Evol., 1989. V. 4. — P. 136‑138.
14. Kminiak M. Biometrische Untersuchungen der Populationen einiger Amphibienarten auf dem Gebiet Spiśská Magura (nordċstliche Sloẃakei) // «Zool listy», 1971. V. 20, № 1. — Р. 29‑38. РЖ Биология 1971, 9И300.
15. Lyapkov S. M. Sexual dimorphism in morphometric characters and its formation in Rana temporaria and Rana arvalis // Herpetology 97: Abstr. lll World Congr. Herpetol., Prague, 1997. — 9 p.
16. Obradovic S., Janev B. Morphometric study of two brown frog populations (Rana arvalis and Rana temporaria) from Central Croatia // Herpetology 97: Abstr. lll World Congr. Herpetol., Prague, 1997. — 21 p.
17. Radoлčič J. M., Cvetkovic D. D., Tomovic L. M., Džukić G. V., Kalezić M. L. Sexual dimorphism in fire-fellied toads Bombina spp. From the central Balkans // Foolia Zool., 2002.V. 51(12). — P. 129‑140.
18. 18 Shine R. Ecological causes for the evolution of sexual dimorphism: a review of the evidence // Quarterly Review of Biology, 1989. V. 64. — P. 419‑464.
19. Voros J., Korsos Z., Szalay F. A comparative morphological study of two Hungarian discoglossid toad species Bombina spp.// Biota, 2002. V. 3/1-2. — P. 171‑177.
дипломов

Оставить комментарий