Статья опубликована в рамках: XX Международной научно-практической конференции «Современная медицина: актуальные вопросы» (Россия, г. Новосибирск, 01 июля 2013 г.)
Наука: Медицина
Секция: Фармацевтическая химия, фармакогнозия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
КОМПЛЕКСООБРАЗОВАНИЕ ФИТИНА С ЖЕЛЕЗНЫМИ И КАЛЦИЕВЫМИ ИОНАМИ (СПЕКТРОМЕТРИЧЕСКОЕ ИССЛЕДОВАНИЕ)
Пенчева Иванка Димитрова
доцент, Фармацевтический факультет, Медицинский университет
г. София, Болгария
Обрешкова Данка Петрова
профессор, Фармацевтический факультет, Медицинский университет
г. София, Болгария
Пейкова Лили Пламенова
ассистент, Фармацевтический факультет, Медицинский университет
г. София, Болгария
Папанов Стоян Илиев
ассистент, Фармацевтический факультет, Медицинский университет
г. Пловдив, Болгария
Петкова Екатерина Георгиева
доцент, Медицинский колледж, Медицинский университет
г. Пловдив, Болгария
E-mail:
Иванов Калин Валентинов
ассистент, Фармацевтический факультет, Медицинский университет
г. Пловдив, Болгария
Петров Георги Йорданов
ассистент, Фармацевтический факультет, Медицинский университет
г. Пловдив, Болгария
Трайкова Николета Иванова
доцент, Медицинский колледж, Медицинский университет
г. Пловдив, Болгария
Божкова Мария Кръстева
ст.преп., Медицинский колледж, Медицинский университет
г. Пловдив, Болгария
Панкова Стефка Ачкова
студент, Фармацевтический факультет, Медицинский университет
г. София, Болгария
Григоров Любен Данчов
студент, Фармацевтический факультет, Медицинский университет
г. Пловдив, Болгария
COMPLEXFORMING OF FITIN WITH FERROUS AND CALCIUM IONS (SPECTROMETRICAL RESEARCH)
Penchev Ivanka Dimitrova
associate Professor Faculty of Pharmacy, Medical University, Sofia, Bulgaria
Obreshkova Danka Petrova
professor Faculty of Pharmacy, Medical University, Sofia, Bulgaria
Peykova Lily Plamenova
assistant Faculty of Pharmacy, Medical University, Sofia, Bulgaria
Papanov Stoyan Iliev
assistant Faculty of Pharmacy, Medical University Plovdiv, Bulgaria
Petkova Ekaterina Georgieva
associate Professor, College of Medicine Medical University, Plovdiv, Bulgaria
Kalin Ivanov Valentine
assistant Faculty of Pharmacy, Medical University,Plovdiv, Bulgaria
Petrov, Georgi Yordanov
assistant Faculty of Pharmacy, Medical University, Plovdiv, Bulgaria
Traykova Nikoleta Ivanova
associate Professor, College of Medicine Medical University, Plovdiv, Bulgaria
Bozhkova Maria Krasteva
senior Lecturer., College of Medicine Medical University, Plovdiv, Bulgaria
Pankov Stefka Achkova
student of Faculty of Pharmacy, Medical University, Sofia, Bulgaria
Grigorov Luben Danchov
student of Faculty of Pharmacy, Medical University, Plovdiv, Bulgaria
АННОТАЦИЯ
Фитин — это белый аморфный порошок, без вкуса и запаха, нерастворимый в воде и в минеральной, а также в органической кислотах.
Одна часть фитина растворяется в 10 частях соляной кислоты, и таким образом получается чистый раствор.
С повышением температуры в присутствии кислоты, основы и воды фитин гидролизуется до фосфорной кислоты и миоинозитола.
Настоящая разработка выявляет результаты спектрометрического (ультрафиолетового и инфракрасного) исследования возможности для компексооразования фитина и Fe(NO3), и характеризует ультрафиолетовое спектрофотометрическое исследование возможностей для комплексообразования фитина и CaCl2.
ABSTRACT
The Fitin is a amorphous powder- odorless and savourless, water, mineral and organic acid digested.
One part of Fitin is dissolves in ten parts hydrochloric acid and that forms clear liquid.
When the temperature increase within the acid, the bases and the fitin water are hydrolysis into phosphoric acid and mioinositol.
The present development, reveal the results of spectrometrical (UV and Infra-red) researches and give the possibility for Fitin and Fe(NO3) complexforming, and to reveal the UV spectrofotometrical researches for the complexforming of Fitin and CaCL2.
Ключевые слова: фитин, комплексообразование, спектрометрия
Keywords: Fitin, Complexforming, Spectrometry
Введение
Фитин — это белый аморфный порошок, без вкуса и запаха, нерастворимый в воде и в минеральной, а также органичной кислотах. Установлено, что одна часть фитина растворяется в 10 частях соляной, и таким образом получается чистый раствор. По мнению некоторых авторов, фитин содержит 36 % фосфорной кислоты. При нагревании в присутствии разбавленной кислоты, основы и воды, фитин гидролизуется, и получается фосфорная кислота и миоинозитол.
Фитин относится к группе органических фосфатов и представляет смесь из кальциево-магнезиевой соли и фитиновой кислоты.
Название фитин, а также первые сведения о получении и описание соединения дал С. Пастернак (1921). Он считал, что это фосфорное соединение промежуточный продукт синтеза хлорофиллина. Позже это утверждение было отвергнуто, но наименование фитин сохраняется для обозначения продуктов, получаемых из семен житных, бобовых и масличных растений.
Цель
Настоящая статья раскрывает результаты спектрометрического (ультрафиолетового и инфракрасного) исследования возможностей для комплексообразования фитина и Fe(NO3), а также ультрафиолетового спектрометрического исследования возможностей для комплексообразования фитина и CaCL2.
Спектрометрическое исследование возможностей для комплексообразования фитина с железными и кальциевыми ионами
Материалы и аппаратура
· исходные вещества: Чистая субстанция Phytin (G) Таблетки PHYTIN® 250 mg — Софарма Капсулы "Cell Forte" — USA Fe(NO3)3 *9H2O — для анализа
Art.3883 MERCK MM=404,00
СаС12 — безводный ММ= 110,90
· реактивы:
Солная кислота (1M HCl)
Дистиллированная вода
· аппаратура:
UV-VIS спектрометр HP 8452А
IR-спектрометр
Приготовление раствора для анализа:
Приготовление раствора на Fe(NOз)з
Измеряем аналитическими весами 0,5000 g Fe(NO3)3 и растворяем в 10 ml воды.
Приготовление раствора CaCl2
Измеряем аналитическими весами 1,0000 g фитин и растворяем его в 10 ml воды.
Приготовление раствора Phytin (G)
Измеряем аналитическими весами 1,0000 g. Фитин и растворяем в 20 мл.1М HCl.
Приготовление раствора фитина («Фитин» 250 mg — Софарма)
Стираем в порошок таблетку фитина 250 mg. Из полученной гомогенной массы аналитическими весами измеряем массу таблетки для анализа, эквивалентную 1,0000 g фитина. Точное количество массы растворяется в 20 ml 1MHCl и потом фильтруется.
Приготовление раствора фитина (“Cell Forte” — USA)
Капсула, содержащая фитин, открывается и капсульная масса отделяется от обëртки. Аналитическими весами измеряем массу для анализа, эквивалентную 1,000 g фитина. Точное количество массы растворяется в 20 ml 1MHCl.(1,3)
UV-спектрометрическое исследование возможностей фитина и Fe(NO3)3 для комплексообразования.
Сущность метода. Результаты
20 ml раствора Phytin (G.) смешивается с 10ml раствора Fe(NO3)3 *9H2O и непрерывно размешивается электрической мешалкой. Получается аморфный осадок, которой фильтруется стеклянныm фильтром. Усадок сушится при температуре 20—220С. Полученное гомогенное соединение — белое и без запаха. Оно нерастворимо в воде и в органических растворителях. Соединение частично растворяется в ацетоне. Соединение мало растворимо в 1 M. HCl и очень растворимо в к.HCl. (1,2)
Одна часть из полученного соединения растворяется в 1M HC1 и потом спектрометрируется.
Наблюдается большое гиперхромное отклонение по сравнению со сравнительным раствором Phytin (G) и раствором Fe(NO3)3 (рис. 1). Величина абсорбции при 340 nm e как следует:
АФигин = 0.39900 АFе(ш) = 0.61685 Акомпл =0.97400
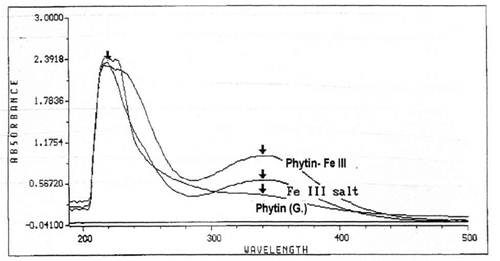
Рисунок 1. Сравнительный анализ абсорбций фитина и его комплексов
IR спектрометрическое исследование комплекса фитина с Fe(NO3)3 Сущность метода. Результаты
20 ml раствора фитина («Фитин» — Софарма и "Cell Forte" — USA) смешивается с 10 ml из раствора Fe(NO3)3*9H2O и непрерывно размешивается электрической мешалкой. Получается аморфный осадок, который фильтруется стеклянныm фильтром. Осадок сушится при температуре 20—220С. Новое соединение исследуется спектрометром. Стираем в порошок пробу с помощю суспендиращой жидкости и получаем гомогенную пасту. Паста наносится между пластинками NaCl, они прижимается, и таким образом получается равномерный слой. В кювете между галогенидными пластинками есть слой жидкого парафина (нуйола) При снятия спектра исследованного вещества надо обратить внимание на адсорбционную полосу жидкого парафина (нуйола). Полученные спектры сравниваюется с IR спектром чистой субстанции Phytin (G) (рис. 2).(1,4)
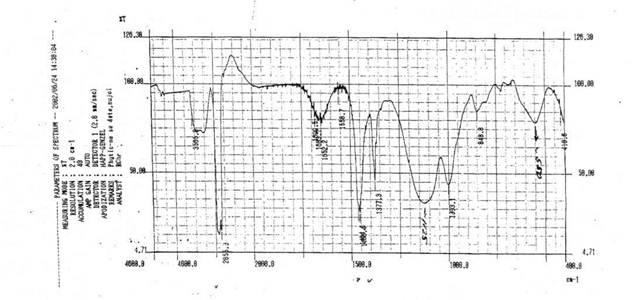
Рисунок 2. ИК спектър на чистая субстанция Phytin(G)
ER спектрометрические исследования комплекса Фитин («Фитин» — Софарма) и Фитин ("Cell Forte" — USA) c Fe(NO3)3, представленные на рис. 3
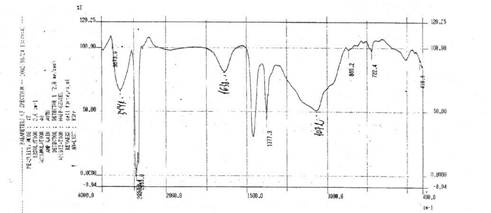
Рисунок 3. ИК спектър на комплекс на Phytin (“Cell Forte” — USA) и Fe(NO3)3
Представленные спектры сравняется по групповым частотам для:
РО42- 1110—970 cm-1 неорганическая кислота или эстер с неорганической кислотой,
-Р-О- 900—550 cm-1 кислотная группа,
Р-О-H 2800—2000 cm-1 кислотная группа,
ОН 3580—3200 cm-1 внутримолекулярные и внешнемолекулярные Н-связи
С-С 1350—1100 cm-1 связи С-С в цикле.
Выводы
1. В IR спектре полученных соединений (рис. 2 и рис.3) можно увидеть абсорбционные полосы в 1072 cm-1 и 950 cm-11 за (Cell forte) и 1074 cm-1 — 950 cm-1 за («Фитин»). Для субстанций (Phytin G.) эти полосы в интервале 1125 cm-1 — 1003 cm-1. Есть отклонения с 50 cm-1.
2. В трëх спектрах отсутствует пик кислотной группы (Р-О-Н). Есть кислотная группа (-Р-О-). Абсорбционнав полоса жидкого парафина (нуйолола) покрывает абсорбционную полосу связи (С-С).
Список литературы:
1.Аврамова П., Георгиев Г., Йовчев Й., Йорданова К., Лазанова-Йовчева О., Найденова Е., Христов М. Ръководство за практически упражнения по фарм. Анализ, МФ. — София, 1996. — С. 36—42.
2.Димов Н. Хроматографиите във фармацевтичния анализ. НИХФИ, 1999. — С. 22—46.
3.Крисчън Г., Д. О`Рейли. Инструментален анализ, Университетско издателство “Св. Климент Охридски”, 1998. — С. 13—22.
4.Watson D., Pharmaceutical analisys, Edinburg — Toronto, 2005. — С. 45—48.
дипломов


Оставить комментарий