Статья опубликована в рамках: XVII Международной научно-практической конференции «Современная медицина: актуальные вопросы» (Россия, г. Новосибирск, 08 апреля 2013 г.)
Наука: Медицина
Секция: Педиатрия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
АРИЛ-ГИДРОКАРБОНОВЫЙ РЕЦЕПТОР И ЕГО РОЛЬ В РАЗВИТИИ ВРОЖДЕННЫХ ПОРОКОВ СЕРДЦА
Швецов Ярослав Дмитриевич
аспирант кафедры биологии, медицинской генетики и экологии Курский Государственный Медицинский Университет, г. Курск
Email: shvecov.miogu@rambler.ru
Актуальность данной темы обусловлена тем, что в развитие врожденных пороков сердца значимую роль играет сигнальный каскад арил-гидрокарбонового рецептора. Известно о роли AHR не только в ответе на интоксикацию ксенобиотиков и их детоксикацию, но и участие в процессах пролиферации и дифференциации клеток.
Индукция экспрессии генов ферментов метаболизма ксенобиотиков в ответ на химическое воздействие можно найти у большинства организмов. У позвоночных арил-гидрокарбоновый рецептор (AhR) является одним из нескольких химических, лиганд-зависимых внутриклеточных рецепторов, которые стимулируют транскрипцию генов в ответ на воздействие ксенобиотиков. Способность связывать и быть активированным целым рядом структурно различных химических веществ позволяет предположить, что AhR содержит довольно беспорядочные сайты связывание лигандов. Помимо синтетических и химических веществ окружающей среды были также выявлены многочисленные естественные и эндогенные лиганды. Загрязнители окружающей среды, такие, как HAHs и негалогенизированные ПАУ, представляют собой наиболее широко охарактеризованные классы AhR-лигандов. Хотя многочисленные гены регулируются арил-гидрокарбоновым рецептором, лучше изучены ферменты метаболизма ксенобиотиков, такие как белки группы цитохромов. Индукция семейства CYP-белков является ответом, который в виде каскада реакций участвует в начальных этапах детоксикации у большинства видов. Текущая модель AhR действий представлена на рисунке 1.
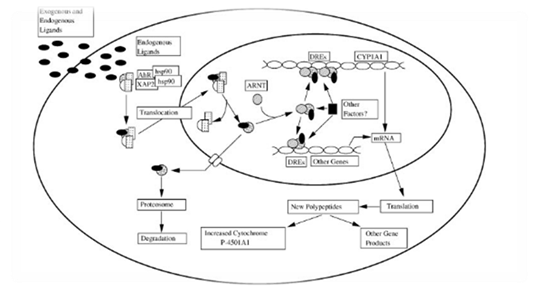
Рисунок 1. Молекулярный механизм активации экспрессии генов и действие арил-гидрокарбонового рецептора
Химическое вещество, поступая в цитоплазму быстро делящейся клетки, с высоким аффинитетом связывается с цитозольным AhR, который существует как мультипептидный комплекс, содержащий две молекулы шаперона белка hsp90 (белок теплового шока 90 кДа), X-связанного белка 2 [XAP2] и недавно идентифицированный 23-кДа ко-шаперон белок, именуемый p23. После связывания лиганда, AhR проходит ряд конформационных изменений, приводя к перемещению комплекса в ядро. Отсоединение лиганда AhR с его последующей димеризацией с соответствующим ядерным белком Arnt преобразует AhR, чтобы достичь высокого аффинитета связывания с ДНК. AHR-ARNT гетеродимер связывает AHR, диоксин, или элемент ответа на действие ксенобиотиков (AHRE) последовательность 5-TNGCGTG-3, расположенную в промоторной области генов-мишеней AHR, коактиваторов и белков хроматина, которые являются важными компонентами в транскрипционной индукции генов AHR цепи. Связывание гетеромерного лиганда AhR/Arnt комплекса специфичного сайта связывания ДНК, DRE, запускают каскад белков семейства цитохромов и других AhR-зависимых генов, стимулируя их транскрипцию. Присутствие AhR и AhR-сигнальных каскадов в спектре разнообразных видов тканей, типов клеток в сочетании с его способностью действовать как лиганд-зависимый транскрипционный фактор, свидетельствует о том, что многие токсические и биологические эффекты лигандов AhR в результате дифференциального изменения экспрессии генов в восприимчивых клетках играют важную роль в морфогенезе ткани [3, с. 309].
Арил-гидрокарбоновый рецептор (AHR) является лиганд-активированным транскрипционным фактором, который опосредует индукцию CYP1 семейства цитохрома Р450 и ряда ферментов II фазы детоксикации, принадлежит к семейству белков, характеризующихся наличием basic helix-loop-helix/PER-ARNT-SIM (PAS) области. Хотя индукция этих генов лучше всего характеризует AHR функции, он не объясняет разнообразие опосредованных эффектов. Активация арил-гидрокарбонового рецептора в ответ на TCDD и других агонистов ксенобиотиков непосредственно затрагивает несколько метаболических путей, ведущих к идентификации многих AHR-направленных эффектов диоксина, участвующих в регуляции сигнальных факторов роста, клеточного цикла пролиферации, дифференциация и апоптоза.
Исследования с целью определения механизмов, ответственных за развитие ВПС в результате воздействия TCDD в эмбриональном развитии является очень важным для профилактики сердечно-сосудистой патологии, причина которой — влияние факторов окружающей среды на генотип. Помимо своей роли посредника производить оценку ксенобиотической токсичности, важная роль AHR в ряде биологических процессов только начинает признаваться, связывая свои гены-мишени в сигнальных путях и играя основополагающую роль в регуляции клеточного цикла. Сигнальный путь арил-гидрокарбонового рецептора играет важную роль в контроле баланса между процессами пролиферации клеток, способствует инициации, промоции и прогрессии патологического процесса, в конечном счете, приводит к существенным изменениям экспрессии генов. Клапанный стеноз и синдром гипоплазии левых отделов сердца являются наиболее распространенными формами врожденных дефектов в организме человека, выявляемых у восьми новорожденных на каждые 1000 живорождений и составляющие 25—30 % от всех случаев человека врожденных пороков сердца. В целом эти ВПС являются основной причиной неонатальной и младенческой смертности и одной из основных причин сердечной недостаточности у взрослых, тем самым показывая связь сердечно-сосудистых заболеваний плода и взрослого. Интересно, что 10% больных с гипоплазией левых отделов сердца имеют другие врожденные дефекты. Основные факторы риска развития врожденных пороков сердца (ВПС) являются генотип и воздействие опасных химических веществ на организм матери во время беременности, но точный молекулярный механизм остается неизвестным. С экологической точки зрения, хлорорганические соединения эпидемиологически связанны с ВПС. Дети, рожденные от матерей, живущих вблизи мусоросжигательных заводов, где происходит выброс сложных смесей диоксинов, фуранов, твердых частиц и тяжелых металлов демонстрировали более высокую частоту врожденных пороков сердца, не совместимых с жизнью. В ходе независимых исследований, заболеваемость синдромом гипоплазии левых отделов сердца эпидемиологически связанны (отношение шансов ¼ 3,0, р <0,005) с воздействием галогенированных углеводородов на материнский организм, диоксинов и полихлорированных бифенилов во время беременности [2, с. 1127]. Несмотря на убедительные генетические и эпидемиологические данные наше понимание механизмов, посредством которых диоксины оказывают кардиотоксический эффект в организме человека ограничен, и прямой причинно-следственной связи между врожденным пороком сердца плода и воздействием диоксинов еще предстоит выявить. Получение таких данных осложняется тем, что многие ВПС являются результатом спонтанных абортов или незамеченными выкидышами, которые не регистрируются в эпидемиологических исследованиях. Развивающаяся сердечно-сосудистая система является чувствительной мишенью для многих экологических загрязнителей, включая диоксины, диоксиноподобные полихлорированные дифенилы (ПХД) и некоторые пестициды, такие как метилпаратион. Лабораторные исследования продемонстрировали ряд биологических моделей для выявления возможных механизмов, которые опосредуют кардиотератогенез и установить чувствительности различных видов для прогнозирования потенциального риска для здоровья человека и окружающей среды. Исследования диоксинов и диоксин-подобных ПХБ показал, что эмбрионы млекопитающих характеризуются различными структурными изменениями сердечно-сосудистой системы в зависимости от индивидуальных моделей. Следует отметить, что во всех моделях диоксин-связанных кардиотератогений просматривается увеличение сердечно-сосудистого апоптоза и снижение пролиферации кардиомиоцитов. В настоящее время значительно возрос вклад генетики в развитие ВПС. Есть, по крайней мере, 15 различных типов врожденных пороков сердца, которые могут варьироваться по тяжести и анатомическим различиям, с возможностью незначительных дефектов выявляться только во взрослый период. Такой вариант предполагает потенциал для различных механизмов, характеризующихся взаимодействием окружающей среды и генотипа [4, с. 279]. Недавно обнаружено, что лечение дифференциации эмбриональными стволовыми (ЭС) клетками с TCDD Nkx2.5 подавляет экспрессию генов и других сердечных маркеров, как следствие AHR активации [5, с. 460]. При исследовании экспрессии траекторий маркеров кардиомиоцитов во время ES-терапии, дифференцировки клеток в присутствии TCDD обнаружено, что TCDD угнетает выражение Nkx2.5 и кардиомиоцит-специфических генов, включая гены, кодирующие сердечный тропонин-Т и β-миозин тяжелой цепи, а также ингибирует образование характерного фенотипа дифференциации ЭС клеток. На основании данных иммунопреципитации хроматина, AHR был ключевым медиатором эффектов TCDD. Пороки развития сердца человека из-за факторов окружающей среды (органохлорированных соединений) или генетических (NKX2.5 мутации) причин могут быть выявлены в опыте и последующим развитием экспериментов in vivo. Ингибирование дифференцировки кардиомиоцитов является результатом взаимодействия между AHR, TCDD и NKX2.5 и может быть продемонстрировано в биологических моделях с целью изучения молекулярных механизмов развития патологического процесса. Репрессии Nkx2.5 с помощью TCDD-ассоциированной активации AHR характеризуют потерю функции в результате мутации или воздействия диоксина. Эта биологическая модель помогает определить регуляторный путь контроля управления Nkx2.5 функции, что детерминирует эмбриональную идентичность и прогресс дифференцировки сердечной ткани и как эти функции могут нарушиться вследствие активации AHR. Значительное количество генов помимо NKX2.5 играют важную и селективную роль в морфогенезе сердца, опираясь на сигнальные пути, которые регулируют эндотелиальную, гладкомышечную, сердечную и мезенхимальную клеточную пролиферацию и дифференцировку как в развивающемся, так и постнатальном сердце. Многие из этих генов являются компонентами сигнальных путей, таких как VEGF, NFATc1, BMP10, Notch, WNT/b-catenin, TGF-b и других, что перекрещивается с AHR-сигнальным путем [1, с. 256].
Исходя из проведенных исследований, можно с уверенностью говорить о том, что арил-гидрокарбоновый рецептор пусть и косвенно, но оказывает значительное влияние на развитие врожденных пороков сердечно-сосудистой системы. Это обусловлено его способностью контролировать экспрессию генов системы детоксикации ксенобиотиков. Относительный вклад эффектов арил-гидрокарбонового рецептора в морфогенезе сердца является еще одной актуальной областью для научных исследований.
Список литературы:
1.Alvaro Puga Perspectives on the Potential Involvement of the Ah Receptor-Dioxin Axis in Cardiovascular Disease// Тoxicological sciences 120(2), 2011. — Р. 256—261.
2.Karen S Kuehl, Christopher A Loffredo Genetic and environmental influences on malformations of the cardiac outflow tract// Expert Review of Cardiovascular Therapy November 2005. Vol. 3. № 6. — P. 1125—1130.
3.Michael S. Denison and Scott R. Nagy Аctivation of the aryl hydrocarbon receptor by structurally diverse exogenous and e ndogenous chemicals// Pharmacol. Toxicol. 2003. 43:309—334.
4.Phillip G. Kopf, Mary K. Walker Overview of Developmental Heart Defects by Dioxins, PCBs, and Pesticides// Environmental Carcinogenesis and Ecotoxicology Reviews, 27:4. — 2009. — Р. 276—285.
5.Todd Heallen, Min Zhang, Jun Wang, Margarita Bonilla-Claudio, Ela Klysik, Randy L. Johnson, James F. Martin Hippo Pathway Inhibits Wnt Signaling to Restrain Cardiomyocyte Proliferation and Heart Size// Science 332 (6028): 458—461, 2011.
дипломов


Оставить комментарий