Статья опубликована в рамках: XLVI-XLVII Международной научно-практической конференции «Современная медицина: актуальные вопросы» (Россия, г. Новосибирск, 09 сентября 2015 г.)
Наука: Медицина
Секция: Патологическая анатомия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
Статья опубликована в рамках:
Выходные данные сборника:
МОРФОЛОГИЧЕСКИЕ МАРКЕРЫ ТОКСИЧЕСКИ ОБУСЛОВЛЕННОЙ КИСЛОРОДНОЙ НЕДОСТАТОЧНОСТИ ТКАНИ ПЕЧЕНИ МЫШЕЙ
Купша Елена Ивановна
канд. мед. наук, ассистент кафедры гистологии и эмбриологии
Медицинской Академии Крымского федерального университета им. В.И. Вернадского,
РФ, г. Симферополь
E-mail: liver-life@yandex.ru
Бондаренко Владимир Витольдович
канд. мед. наук, доцент кафедры гистологии и эмбриологии
Медицинской Академии Крымского федерального университета им. В.И. Вернадского,
РФ, г. Симферополь
MORPHOLOGICAL MARKERS OF TOXICCONDITIONALITY OF TISSUE HYPOXIA MICE LIVER
Kupsha Elena
candidate of medical sciences, assistant of the Department of Histology and Embryology Medical Academy Crimean Federal University. V.I. Vernadsky,
Russia, Simferopol
Bondarenko Vladimir
candidate of medical sciences, associate professor of the Department of Histology and Embryology Medical Academy Crimean Federal University. V.I. Vernadsky,
Russia, Simferopol
АННОТАЦИЯ
Комплексными методами изучен сосудистый компонент печеночных долек белых мышей в условиях длительного поступления в организм малых доз свинца и токоферола. Выявленные морфологические признаки свидетельствуют о развитии циркуляторной и гемической гипоксий в печени мышей всех экспериментальных групп. Приоритетными мишенями свинца являются эритроциты и эндотелиоциты. Токоферол не устраняет гипоксическую патологию.
ABSTRACT
Complex methods studied vascular component hepatic lobules white mice in long-term intake of small doses of lead and tocopherol. Revealed morphological features indicate the development of circulatory and hemic hypoxia liver of mice of experimental groups. The priority targets of lead are red blood cells and endothelial cells. Tocopherol not eliminate hypoxic pathology.
Ключевые слова: печень; свинец; сосуды; эритроциты; гипоксия.
Keywords: liver; lead; blood vessels; erythrocytes; hypoxia.
Гипоксия является ведущим патогенетическим звеном в развитии некротических и дистрофических изменений в паренхиматозных и непаренхиматозных клеточных структурах печени при вирусных и токсических ее повреждениях [4] и является триггерным механизмом для активации коллагенсинтезирующих непаренхиматозных клеток [3]. Свинец индуцирует окислительный стресс с последующим пероксидативным гемолизом эритроцитов. Вовлечение гемопоэтической системы проявляется свинециндуцированными анемиями [7]. Более чем 95 % содержащегося в крови свинца накапливается в эритроцитах. Таким образом, эритроциты считаются ранней и основной мишенью свинец-индуцированной токсичности в сердечно-сосудистой системе. Связываясь с фосфатидилхолином мембран эритроцитов и изменяя их липидный состав, свинец способствует нарушению их целостности, проницаемости и функции и, как следствие, усиление секвестрации в селезенке и возрастание эритрофагоцитоза [5; 6]. Идентификация морфологических маркеров кислородной недостаточности ткани печени при ее биопсии может помочь в подборе адекватных схем лечения, в основе которых лежит патогенетический подход. Учитывая доминирование энтерального пути поступления свинца с загрязненными продуктами и питьевой водой в бытовых условиях, представляется необходимым продолжать исследования по оценке морфофункционального состояния печени в условиях длительной экспозиции организма соединениями свинца.
Целью нашей работы явилось определение светооптических и электронномикроскопических признаков, а также морфометрических параметров системы интралобулярной гемомикроциркуляции и приносящих междольковых сосудов, а также системы внутрисосудистой крови, как маркеров гипоксии, развивающейся в печени в условиях длительного поступления субтоксических доз ацетата свинца, как в изолированной форме, так и в сочетании с антиоксидантом альфа-токоферолом.
Материал и методы
Трехмесячная свинцовая интоксикация моделировалась на 36 половозрелых самцах белых мышей линии balb /c, которые получали перорально ацетат свинца в дозе 1 мг/100 г массы в течение 30, 60 и 90 суток. 15 животных служили контролем. Эксперимент включал 2 серии опытов. В 1-ой серии применяли ацетат свинца изолированно (18 мышей). Во 2-й серии использовали ацетат свинца в сочетании с пероральным введением альфа-токоферола (18 мышей). Используемые методы: гистологический, электронномикроскопический, полутонких срезов, морфометрический. Анализировалось состояние внутридолькового и междолькового сосудистого русла, компонентов внутрисосудистой крови. Проводили количественный подсчет площадей, периметра и диаметра синусоидных капилляров. Морфометрия проведена с применением оптического анализатора изображения «OLIMPUS BH-2» и стандартного пакета статистических программ Excel с учетом числа срезов и количества животных. Использовали t-критерий Стьюдента. Статистически достоверными считали изменения при Р≤0,05.
Результаты и обсуждение
При изолированной экспозиции белых мышей ацетатом свинца в системе внутридольковой гемодинамики, призванной обеспечить достаточный объем перфузируемой крови, отмечалась редукция синусоидных гемокапилляров. Она наиболее выражена на 30 и 90 сутки эксперимента. При этом площадь профильного поля обменных гемомикрососудов составла 83,34±11,80 мкм2 (30 суток) и 78,89±6,19 мкм2 (90 суток), в то время как в контроле — 164,55±16,09 мкм2. Статистически достоверно снижены также показатели периметра и максимального диаметра синусоидного капиллярного ложа. Признаки свинцовой ангиотоксичности проявлялись потерей эндотелиальным монослоем сплошной протяженности в сосудах внутри дольки. В центральных венах гидропически набухшие эндотелиоциты теряли как межклеточные связи друг с другом, так и обычную циркулярную ориентацию. В местах отсутствия эндотелиоцитов отмечался перикапиллярный отек. В составе синусоидных капилляров на отдельных участках выявлялась не характерная для них базальная мембрана. В цитоплазме дистрофически измененных эндотелиоцитов синусоидов и центральных вен наблюдался дефицит транспортных микропиноцитозных пузырьков. Нередко отмечалась практически полная обтурация просвета капилляра иммунными клеточными ассоциатами, состоящими из лимфоцитов и клеток Купфера, что препятствовало доставке эритроцитов к гепатоцитам.
Довольно часто наблюдалось полное разрушение стенки междольковых сосудов. Выявлялись признаки нарушений в системе внутридольковой гемореологии во все сроки эксперимента. Выражены явления стаза эритроцитов и плазмы крови, сладж-феномена и гемолиза эритроцитов как в системе приносящих междольковых вен, так и в обменных внутридольковых капиллярах (Рис. 1).
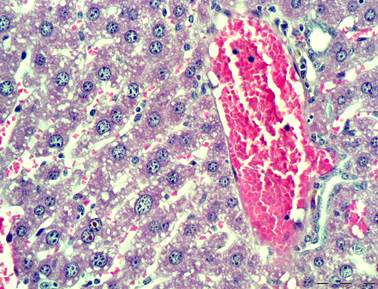
Рисунок 1. Серия Pb60. Дистрофические изменения в стенке междольковой вены. Стаз и сладж эритроцитов. Гидропическая дистрофия гепатоцитов. Альдегид-фуксин и гематоксилин. Ув. х 300
В условиях сочетанного с ацетатом свинца применения альфа-токоферола светооптический анализ сосудистого ложа выявил следующее. Морфометрические показатели площади профильного поля капилляров в динамике 1—2—3 месяца эксперимента составили 153,20±12,70 мкм2, 105,11± 6,19 мкм2 и 200,45±19,62 мкм2 соответственно, при значениях контроля 164,55±16,09 мкм2. Значительная редукция капиллярного ложа, как вместилища тканевых транспортеров кислорода, наблюдалась при 2-х месячном сроке эксперимента. При этом, показатель среднего диаметра капилляров также статистически достоверно ниже контрольного значения — 11,74 ±0,38 и 14,70±0,79 мкм соответственно (Р<0,05). Сохранялась гидропическая дистрофия и некробиоз эндотелиоцитов в стенке внутридольковых гемомикрососудов. К исходу 90-х суток эксперимента наблюдалось патологическое ремоделирование междольковых сосудов, которые значительно расширялись, ветвились и вызывали компрессию и деформацию долек. Сохранялись явления стаза эритроцитов и плазмы крови, а также сладжирования красных форменных элементов. Регистрировалось увеличенное количество внутрисинусоидальных аномальных и незрелых эритроцитов — анулоцитов и эхиноцитов во временном интервале 60-90 суток эксперимента, а также их внутрисосудистый гемолиз.
Известно, что доставка адекватного количества эритроцитов к клеткам паренхимы обеспечивается стабильной сердечной и регионарной внутригепатической гемодинамикой, призванной обеспечить достаточный объем внутридольковой перфузируемой крови. В ее основе лежит структурная целостность стенок приносящих междольковых сосудов и сохраненная функциональная морфология эндотелия, обеспечивающего эндотелий-зависимую вазодилатацию гемомикрососудов в ответ на повышенный запрос кислорода паренхиматозными и непаренхиматозными клетками [1]. При этом, достаточное развитие синусоидной капиллярной сети является наиболее значимым для адекватного снабжения гепатоцитов кислородом. Идентифицируемые нами светооптические и электронномикроскопические признаки неблагополучия регионарной гемодинамики позволяют утверждать, что имеет место стойкая циркуляторная гипоксия с преимущественной локализацией ангиопатологии в системе гемомикроциркуляции. Об этом свидетельствуют признаки деэндотелизации междольковых и внутридольковых сосудов, редукции общей площади синусоидной капиллярной сети, уменьшения показателей периметра и среднего диаметра капилляров, деструкции стенки приносящей междольковой вены, закупорка части синусоидов ассоциатами иммуноцитов.
При доставке к гепатоцитам даже необходимого количества эритроцитов, диффузия запрашиваемого количества кислорода значительно зависит от функциональной морфологии собственно красных форменных элементов крови, их формы, степени деформируемости, насыщенности гемоглобина кислородом, поведением эритроцитов в кровотоке и их взаимоотталкиванием [2]. Нами идентифицированы признаки токсического влияния свинца на структурную организацию эритроцитов и степень их внутрисосудистой агрегации. Критически неблагополучными являются обусловленные свинцом сладж — феномен и гемолиз, а также более легкие формы гемореологической патологии — стаз плазмы, сепарирование ее от форменных элементов, стаз эритроцитов. Характерной чертой дизадаптации в системе эритрона является обнаружение в просвете внутригепатических сосудов стареющих и молодых форм красных форменных элементов — анулоцитов и эхиноцитов, которые, как известно, являются функционально неполноценными транспортерами кислорода. Явления стабильно выявляемых массивных стазов и сладжа эритроцитов в капиллярах, эффекты сепарирования крови на плазму и сладжированные красные кровяные тельца на фоне повреждения эндотелия, являются структурным базисом не только существующей гемической и циркуляторной гипоксии, но и, ввиду степени выраженности процесса, вероятным предикатором, как минимум, предишемического и возможного коагулопатического состояний. Массивные сладжи эритроцитов в данном контексте можно обозначить как гемомикроциркуляторную микроокклюзию внутридольковых обменных микрососудов (Рис. 2).
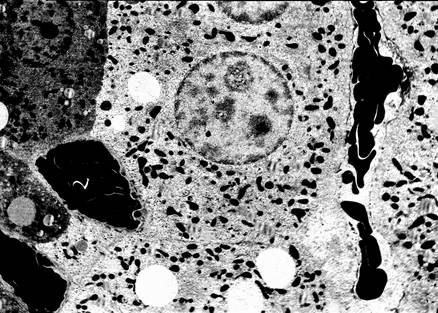
Рисунок 2. Серия Е60. Темный и светлый гепатоциты. Сладж эритроцитов. Электронная микрофотография. Ув. х 4000
Выводы
1. 30—90-суточная изолированная экспозиция белых мышей ацетатом свинца вызывает развитие смешанной формы внутриорганной гипоксии, признаки гемического и циркуляторного кислороддефицитных состояний. Степень выраженности каждой из гипоксических составляющих зависит от временных сроков свинцового воздействия.
2. Применение альфа-токоферола совместно с ацетатом свинца неэффективно устраняет гипоксическую патологию и способствует в ряде сроков усилению одной из составляющих гипоксии.
Список литературы:
- Зайко Ю.В., Быць Ю.В. (ред.) Патологическая физиология. Изд. 2-е М.: МЕДпресс -информ, 2004. — 640 с.
- Зайчик А.Ш. Чурилов Л.П. Общая патофизиология (с основами иммунопатологии).СПб: ЭЛБИ-Спб, 2005. — 656 с.
- Купша Е.И., Бондаренко В.В. Морфофункциональная характеристика стромального компонента печени белых мышей, при длительном поступлении в организм малых доз свинца и фармакологической коррекции процесса / Инновации в науке: материалы XLVII международной научо-практической конференции (29 июля 2015 г.). — Новосибирск: СибАК, 2015. — № 7 (44). — С. 117—127.
- Шерлок Ш., Дули Дж. Заболевания печени и желчных путей: Практическое руководство. Пер. с англ. / [под ред. З.Г. Апросиной, Н.А. Мухина]. М.: Гэотар. Медицина, 1999. — 864 с.
- Gurer H., Ercal N. Can antioxidants be beneficial in the treatment of lead poisoning? // Free Radic Biol Med. — 2000. — V. 29. — № 10. — Р. 927—945.
- Low Level of Lead Can Induce Phosphatidylserine Exposure and Erythrophagocytosis: A New Mechanism Underlying Lead-Associated Anemia / Won-Hee Jang, Kyung-Min Lim, Keunyoung Kim [et al.] // Toxicological Sciences — 2011. — V. 122. — № 1 — Р. 177—184.
- Selection of micronutrients used along with DMSA in the treatment of moderately lead intoxicated mice / Liao Y., Yu F., Jin Y.[et al.] // Arch. Toxicol. – 2008. – V. 82 – Р. 37 – 43.
дипломов


Оставить комментарий